第三节 pH敏感脂质体
一、脂质体内吞入胞途径
1980年,有人提出设计一种脂质体,使其在pH略低(6.0左右)的环境中,如肿瘤组织,释放出其内容物,可能具有临床应用价值。更新型的pH敏感脂质体是通过细胞内pH触发脂质体包封成分的释放(由内吞入胞途径释放进入胞液)。
为此,需要了解胶体和颗粒(如脂质体)的摄取及细胞内递送的细胞机理。所有的真核细胞均采取一种或多种胞吞方式,大多数脂质体通过这些途径之一被摄入细胞内。
脂质体接触质膜后,被部分质膜分离形成的囊泡摄入,随后被内吞到细胞内(图5-3,步骤1)。已发现3种可能的胞吞机理,即吞噬、网格蛋白依赖型胞吞或非网格蛋白依赖型胞吞。胞吞方式不同,质膜囊泡(plasma membrane vesicle,PMV)的特征不同。
①吞噬。发生于各种哺乳动物的免疫细胞,如巨噬细胞。血清蛋白调理的颗粒与受体蛋白接触,随后被膜的伪足突起捕获。囊泡被内吞并迅速与早期核内体(early endosome,EE)融合。
②网格蛋白依赖型胞吞。发生于受体与特异性配体结合之后。当被网格蛋白覆盖的PMV与EE接触后,网格蛋白回到质膜表面被重新利用。
③非网格蛋白依赖型胞吞。存在于内皮细胞。作为巨噬细胞、树突细胞和纤维原细胞的另一种摄取机理,也可定义为巨胞饮作用(macroPinocytosis),因为在这些细胞中形成的PMV粒径可达1~5μm。
通常,细胞摄取的第一步与微管系统无关,之后内吞的PMV与早期核内体融合(图5-3,步骤2)。EE是对诸如受体蛋白等成分进行快速分类的腔室,受体蛋白返回质膜重新利用,而其他被内吞的物质(如脂质体)最终被转运到细胞内,即细胞核周围的区域。脂质体在EE内仅滞留2~3 min,微酸环境(pH6.8~6.3)中最多10 min,随后在微管系统的介导下,脂质体被载体囊泡(图5-3,CV,步骤3)运送至后期核内体(late endosome,LE)和溶酶体。EE的内容物在LE中蓄积并浓缩(图5-3,步骤4)。在这些囊泡内已经含有水解酶(由与来自高尔基体的囊泡融合转运而来)。因为LE可能引发内容物的降解过程,因此也称其为前溶酶体(pre-lyso-some)。该降解过程在溶酶体中完成(图5-3,步骤5)。在降解发生之前,脂质体或至少是其活性成分应从核内体系统逃逸至细胞液内。
在20 min至3 h的转运时间内,CV内的pH降低至约5.5(与细胞的类型有关)。这一pH的降低成为pH敏感脂质体触发内容物核内体逃逸的基本思想。
颗粒的摄取的差异主要在于步骤(1),在此步骤中,质膜囊泡形成并被内吞。该步骤可能是吞噬、网格蛋白依赖型内吞或非网格蛋白依赖型内吞,这取决于细胞的类型。转运及与早期核内体的融合非常快。EE的内容物和膜被迅速拣选(2)并通过载体囊泡再循环至细胞外或在微管系统的帮助下转运至细胞内,pH降低可诱发活性成分从pH敏感脂质体向胞液中释放(3)。未被释放的物质被转运到细胞核周区域,并接触到晚期核内体中更低的pH和细胞溶解酶(从高尔基体运送来)(4),随后进入溶酶体(5)。
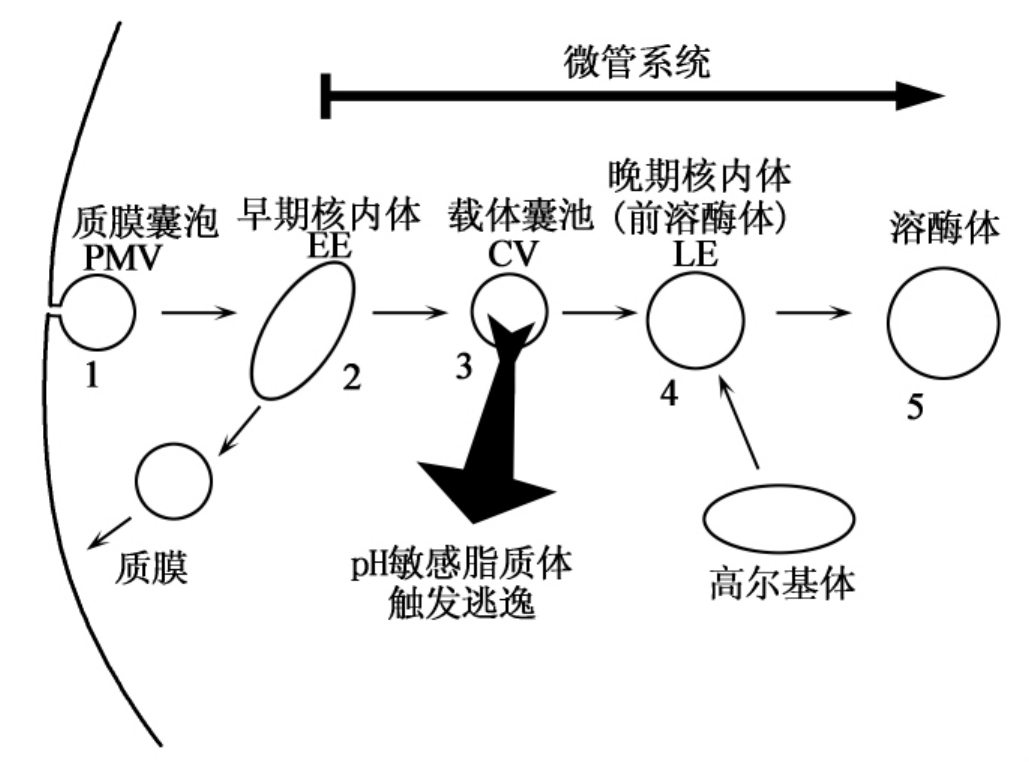
图5-3 物质内吞入胞的途径
二、pH敏感的机理
目前已研究了为数众多的pH敏感脂质体(PSL),其处方中含有pH敏感的脂质或脂质与大分子的混合物,用来提高活性物质向靶细胞作用位点的递送效率。PSL由在pH约7.4的生理条件下呈片层相的成分构成。当pH降低至临界值或5.5左右时,脂质体具有融合性,易于与核内体膜融合,这是我们所期望的将脂质体内容物释放至胞液的一种机理。融合能力的决定性因素是片层相向立方相HⅡ的转变,使脂质结构中亲脂部分占据更大的空间。同时,产生一种不良的副效应(膜缺陷),这将导致被包封的物质释放进入脂质体周围的腔室,即核内体囊泡。因此,药物释放和膜融合能力的定量是PSL研究过程中重要的体外测试指标。脂质体的融合可用荧光共振能量转移(FRET)进行监测。
为了获得期望的结构变化,需要使用能随pH降低而改变分子形状的化合物,不同脂质混合物的一种可能性是,在中性pH下呈圆锥或倒圆锥状的脂质混合物,总体呈片层结构。圆锥形化合物具有小的极性头基,而疏水的尾部占据较大的空间。多不饱和磷脂酰乙醇胺具有此类膜脂质的显著特征,其单一化合物仅在pH大于9时呈片层相,在感兴趣的pH范围内(4.5~7.5)为两性离子。多数情况下使用的是二油酰磷脂酰乙醇胺(DOPE),即使在远低于0℃时也呈圆锥状。由于热运动影响分子疏水尾部的大小,含DOPE的脂质混合物对温度敏感。
适当的圆锥或倒圆锥形状的脂质在中性pH下形成整体片层结构。偏离片层膜结构产生融合性。阴离子脂质在较低的pH时被质子化,可诱导这种结构重组,从而丧失电荷和部分水化。脂肪酸从膜中释放也能使片层相丧失稳定性。pH敏感的脂质混合物可用中性和阴离子脂质和混合物或者阳离子脂质和过量的阴离子脂质混合物制备。
需要的第二种化合物为呈倒圆锥状的脂质,通常为酸性脂质,含羧基。文献报道了大量此类脂质。本节仅详细讨论其中两种,一种为胆固醇半琥珀酸酯(CHEMS),当其含量超过20 mol%时,可以稳定DOPE/CHEMS混合物的片层相。CHEMS本身呈pH敏感的多晶型,当pH降低至其pKa值5.8左右时,该弱酸的质子化程度增加,失去电荷,水化程度降低,头基变小,结构由倒圆锥形转变为圆柱形或类锥形,DOPE/CHEMS的整体片层结构也因此而丧失。
应用CHEMS有许多优势:DOPE/CHEMS混合物对血浆蛋白相对稳定。为了抑制体内血浆蛋白的吸附,PSL中常混有PE锚合的聚乙二醇(PEG-PE)。也有报道,DOPE/CHEMS膜与PEG-PE有良好的相容性。
长链脂肪酸(FA),如油酸(OA),也可作为第二种化合物以类似的方式应用,膜融合的临界pH可以由FA的种类来调控。但是,在核内体中的作用机理可能另外涉及FA重新分布人核内体膜,从而诱发PSL和核内体膜渗漏,已经讨论过脂质体膜的直接接触而诱发PSL渗漏的情况。pH下降使DOPE/OA混合物呈立方相,而与钙离子的相互作用使其更易产生膜内脂质颗粒。FA释放和插入细胞膜的速率相对较快可能是导致DOPE/ OA构成的PSL在血浆中严重泄漏的原因。为了提高血浆稳定性,可在DOPE/OA混合物中加入高达40 mol%的胆固醇,但这会导致pH敏感性下降。
最近研究的PSL含有阴离子和阳离子脂质的二元混合物。中性pH时,混合物总体呈负电性。随着pH降低,部分酸性磷脂质子化而不荷电。当PSL膜的净表面电荷为零时,制剂的融合性达到最佳。临界酸值可通过调节脂质的组成控制在pH4.0~6.7之内。
必须注意,PSL的体外和体内作用模式可能不同。因此,除了大量的生物物理研究外,还进行了许多细胞试验或在体研究。这些研究大多采用DOPE/CHEMS或DOPE/OA。静注后,普通的非pH敏感脂质体迅速分布于网状内皮系统(RES),即主要进入肝和脾。相反,DOPE/OA构成的PSL则主要蓄积在肺中。因此,开发具有预期生物分布的PSL面临着挑战。PEG化是改善循环时间和器官分布的首要步骤。将PEG-PE插入DOPE/ CHEMS,可避免血清蛋白对PSL稳定性的影响,但会降低体外pH敏感性(如标记物释放的测试结果所示)。令人惊奇的是,PEG化的PSL仍然能诱导化合物由核内体向胞液中释放,这一现象可以用膜融合前PSL膜的相分离加以解释。
研究第二代PSL的下一步是利用共价键合配体介导的特异性靶向。传统的偶联过程需要一个可反应的锚合物,在脂质体制备过程中插入膜内。大多数情况下,反应对象为配体(如多肽或蛋白质)的氨基。如果脂质体表面存在多余的游离氨基(如PSL中的PE),可反应的锚合物与邻近氨基之间的反应将极大地降低配体偶联效率。因此,对于PSL,配体必须预先与脂质锚合物偶联,并用适当的方法将其插入预先制备的PSL。可用一种有机溶剂或洗涤剂扰动PSL膜,促进锚合物-配体分子插入。另一种可能是选择一种本身即具有较强的插入膜内倾向的脂质锚合物。
除了由pH敏感脂质混合物构成的PSL外,近来还研究了许多其他处方,其中的表面活性剂或大分子是pH敏感的基础。随着pH下降,这些与PSL连接的分子构象发生改变,导致膜渗漏或融合。需要指出的是核酸也可作为pH敏感系统的组成部分。
多数pH敏感脂质体在生理pH7.4时为负电性。脂质体和细胞表面负电荷的斥力可能削弱其相互作用,从而限制脂质体的细胞摄取。因此,在中性pH时也可应用表面荷正电的PSL。
三、pH敏感脂质体的制备
1.pH敏感脂质体的制备方法
一般而言,只要能确保制备过程中pH不降低至酸性,多数常用的脂质体制备技术均适用于PSL脂质体的制备。
由于PSL是亲水性化合物(如寡核苷酸和蛋白质)的有效递送系统,因此期望有较高的药物包封率。逆相蒸发-挤出和冻融-挤出制备法均可获得高包封率。
逆相蒸发-挤出法制备FITC-右旋糖酐pH敏感脂质体方法如下:①将30 mL HEPES缓冲液与50 mL乙醚混合,小心振摇,制备缓冲乙醚。②将44.6mg DOPE(二油酰磷脂酰乙醇胺)与22.9 mg CHEMS(胆固醇半琥珀酸酯)置于50 mL长颈圆底烧瓶中,用6 mL缓冲乙醚溶解。③加入2 mL FITC-HEPES(异硫氰酸荧光素右旋糖酐)缓冲液,混合物超声3 min。④减压蒸发除去有机溶剂。在此过程中形成黏稠的凝胶,数分钟后塌陷。继续减压蒸发,直至完全除去有机溶剂。⑤将脂质体通过LiposoFast挤出仪挤出,依次通过800 nm、400 nm和200 nm孔径的聚碳酸酯膜(每一孔径挤出5次)。⑥用Sepharose CL-4B凝胶色谱柱分离未包封的FITC-右旋糖酐。
2.pH敏感脂质体的表征
PSL的表征包括粒径、ξ-电位、脂质浓度、降解产物及其他。由于PSL的稳定性对温度敏感,必须谨慎考虑实验条件。
3.pH敏感脂质体的细胞结合
对于理解不同递送系统的机理和提高递送率而言,研究细胞摄取和细胞内递送过程非常重要。对于PSL,研究胞吞作用有助于验证PSL与核内体膜的融合触发其内容物释放进入胞液。
用显微技术或流式细胞仪分析研究pH敏感脂质体与细胞的结合,方法如下:①按上述方法制备脂质体,显微分析需在部分孔内加载玻片。②孵化实验前1~2d,将细胞接种于6孔板中(加或不加载玻片),以使实验时细胞生长至50%~80%(约5×106个细胞)。③孵育前2 h更换介质,每孔中用1 mL相同的介质培养细胞。用含或不含血清的介质考察血清的影响。④每孔加入30μL经凝胶色谱纯化的脂质体(约200 nmol/L脂质/孔),将脂质体与细胞在37℃、调湿环境孵育适当时间(15~120 min);倾去介质,用PBS洗涤细胞2次。⑤对于显微分析,用20 mg/mL多聚甲醛固定细胞(室温,20 min)。将载玻片包埋在抗衰减介质内,并盖好盖玻片。⑥对于流式细胞仪分析,用胰蛋白酶/EDTA对细胞进行消化处理,37℃孵育5 min。1200 g离心细胞5 min,用0.5 mL PBS洗涤细胞2次,将细胞重新混悬于0.5 mL FACS缓冲液中,在冰浴中贮存直至FACS分析(每次实验最好级数10000个细胞)。
显微分析通过观察内容物位于胞液、还是包入细胞的囊泡室内而得到定性信息。FACS分析则通过计数实验细胞群内发荧光的细胞数来提供定量数据。但是,FACS分析无法给出任何关于脂质体内的荧光物质是吸附于细胞膜上,还是内化到细胞内的信息。
对此方法稍做改动,即可对胞吞作用的某些方面进行研究,为阐明核内体酸化在PSL应用中发挥的作用。
4.pH敏感脂质体的胞吞作用
以Bafilomycin Al(一种液泡质子ATP酶特异性阻断剂)阻断核内体的酸化为例:①参照与细胞结合的操作步骤1~4。②在第5步操作之前,各孔中均加20 mmol/L Bafilomycin Al,孵育1 h。③按与细胞结合中步骤5的说明加入脂质体,并按余下的步骤操作至完成。注意:在研究过程中不可移去介质,移去后应立即固定细胞,因为Bafilomycin Al的作用在15 min之内可逆。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















