亲和分离就是根据生物分子间专一结合的特性而设计的一种分离方法。它不仅可用于生物分子的制备,也可用于细胞及其组分的分离和生物专一性结合分析,如放射免疫分析、放射受体分析等。其选择性强、效率高,在生命科学研究中具有重要意义。
随着质谱技术在免疫学领域,如抗原表位的测定、抗体分子量的测定及结构分析、抗原-抗体免疫复合物的分析、免疫应答以及疫苗开发等领域的广泛应用,20世纪90年代出现了亲和质谱,该技术将免疫亲和分离技术与质谱分析技术结合起来,成为分子免疫学研究领域的一项新技术。
亲和质谱法测定抗原表位基本方法有两种:一是水解抗原成肽段并用抗体分别与表位肽结合,除去未与抗体结合的肽段,然后分离出与抗体结合的表位肽进行分析;二是部分水解固定在抗体上的抗原并除去未与抗体结合的肽段,然后分离出与抗体结合的表位肽进行分析。刘志强等采用亲和质谱技术对β2-微球蛋白抗原表位进行了系统研究,通过固定在琼脂糖珠上的单克隆抗体与β2-微球蛋白发生免疫亲和反应,再用4种蛋白酶依次水解β2-微球蛋白,然后采用基质辅助激光解析电离飞行时间质谱技术对与抗体连接受保护而未发生水解的肽段进行了研究,发现β2-微球蛋白抗原表位位于整个蛋白分子氨基酸序列的61~67位,并通过合成肽段的分析,证明了亲和质谱分析的准确性,同时该方法将完整的抗原分子与固定的单克隆抗体结合,不破坏抗原分子的原始构象,可测定连续表位和非连续表位。β2-微球蛋白抗原的质谱图如图9-11所示。
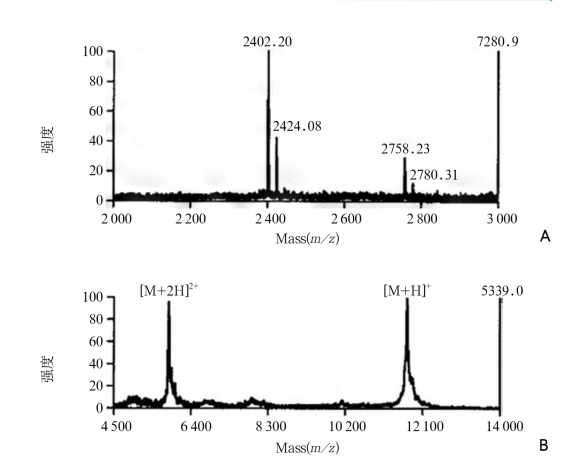
图9-11 β2-微球蛋白抗原的质谱图
A.亲和固定的β2-微球蛋白抗原经Glu-C酶解后的MALDI-TOF质谱图;
B.亲和结合到固定的单克隆抗体上的β2-微球蛋白的MALDI-TOF质谱图
随着生命科学、生物技术和制药工业的迅速发展,对于多肽、蛋白质、酶等活性生物大分子的分离及检测要求日益提高。传统的亲和分离与生物质谱技术的结合具有快速、高效等优点,必将使其在生物大分子的分离纯化检测一体化进程中发挥越来越大的作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















