第四节 其他细胞的分离与培养
一、脐静脉内皮细胞培养
内皮细胞易于从大血管分离培养成单层细胞,对于研究内皮细胞再生、肿瘤促血管生长因子(TAF)等有很大价值。研究人内皮细胞培养以人脐带静脉灌流消化法最为简便,其法为:①产后新鲜脐带,无菌剪取10~15cm长一段,如不能立即培养,可于12h内保存于4℃;②用三通注射器吸取温PBS液注入脐静脉中洗去残血,在入口处用线绳扎紧,以防液体反流;③用血管钳夹紧脐带一端,从另一端向脐静脉中徐徐注入终浓度为0.1%的粗制胶原酶,充满血管,消化3~10min,注入口用线绳扎,以防液体反流;④吸出含有内皮细胞的消化液,于离心管中,注入温PBS轻轻反复冲洗后,一并注入离心管中(此步骤可重复);⑤离心去上清,加入RPMI1640培养基制成细胞悬液,接种入培养器皿中,置温箱培养。2~3d可见细胞长成单层,呈铺路石样生长(图28-14)。

图28-14 第二代脐静脉内皮细胞(×200)
皮肤微血管内皮细胞和内皮组细胞的分离培养方法见第一篇第10章第五节。
二、脂肪细胞的分离培养
(一)前脂肪细胞的分离培养
将手术切除组织或抽吸出的脂肪组织用无菌D-Hanks液保存。充分冲洗去除大部分血细胞。将脂肪组织剪碎成泥,加入适量0.2%胶原酶D,于37℃消化30~60min,间断摇动。100目不锈钢筛网过滤,每分钟1 500转离心5min,弃液面的脂肪细胞层及上清液。反复4~5遍以洗去胶原酶。记数后接种。培养基可为含10%胎牛血清的DMEM或1∶1混合的DMEM/F12,37℃,5%CO2、95%空气、100%湿度下培养。
脂肪间充质干细胞的分离培养参照第二篇第18章。
(二)单房脂肪细胞培养
单房脂肪细胞,即含单房脂滴的成熟白色脂肪细胞。标本来源于鼠或女性整形术获得的脂肪组织。原代培养基用含10%胎牛血清的F12培养基。
(三)脂肪细胞的分离
D-Hanks液冲洗充分冲洗去除血细胞。切碎脂肪组织,0.2%胶原酶消化,100目筛网过滤,离心,留漂浮在离心管表面的一薄层白色物质。为了避免前脂肪细胞、成纤维细胞、其他间质细胞污染,脂肪组织应消化到悬液中仅含单个细胞,重复吹打、洗、离心3遍。
(四)脂肪细胞的原代培养(天花板培养法)
天花板法,即培养瓶加满培养基,脂肪细胞升到培养基顶部并黏附到内表面顶部,待细胞粘牢后翻转。
新生鼠的脂肪细胞在培养2d后黏附好。3~4d时,单房脂肪细胞改变形态成半球状或几乎扁平。在此阶段,这些细胞仍有大的脂滴,但也开始在周围出现很多细小脂滴。此称多房脂肪细胞。多房脂肪细胞经历细胞分裂产生同型脂肪细胞或只含少数小脂滴的成纤维细胞样脂肪细胞。这种形态改变在3~14d大的新生鼠脂肪细胞在培养后几天发生,但人脂肪细胞要花2~3周。单房脂滴的分裂在常规培养基(可能指不加胰岛素等添加物)条件下少见。多房脂肪细胞或成纤维细胞样脂肪细胞融汇时增生达到极限。
三、汗腺分泌部上皮细胞的分离培养
(一)标本来源
外科整形术患者腋部全层皮肤。
(二)分离汗腺
取约0.3cm×3cm大小的皮条,术后立即置D-Hanks液中反复冲洗5遍,用眼科剪剪碎,置PBS中重悬,将组织悬液置解剖显微镜(×20)下观察,用眼科镊直接挑取汗腺。
(三)胶原酶消化法分离汗腺腺上皮细胞
将挑取的汗腺置入体积分数为0.2%的Ⅱ型胶原酶中,37℃消化4~6h,待组织完全消化后,加入D-Hanks液中,每分钟2 500转离心5min,反复离心5遍,以K-SFM重悬获得的细胞。
(四)接种
汗腺腺上皮细胞的培养基为添加5μg/L的EGF和50mg/L的牛垂体提取物的KSFM。将分离的细胞接种到涂有胶原的培养瓶中,接种密度为5×104个/cm2,台盼蓝计数活细胞数,37℃,5%CO2的孵箱培养,约3d换液一次。
24h后可观察到细胞贴壁,3~4d观察到细胞呈多个克隆样麦粒样生长,3周左右细胞融合呈铺路石样生长,基本铺满瓶底,融合后的汗腺腺上皮细胞为扁平多角形,中间有圆形核(图28-15)。
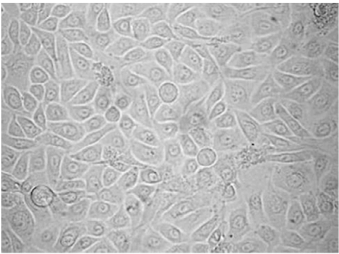
图28-15 呈铺路石样汇合生长的汗腺腺上皮细胞(×400)
四、黑素细胞的培养
(一)原代培养
将包皮组织去除皮下组织,消毒、冲洗后剪成1mm宽皮条,0.25%分离酶4℃消化16h,分离表皮,在0.25%胰酶中37℃消化5min,吸管反复吹打,制成细胞悬液,细胞浓度以1×105个/ml,接种于黑素细胞培养基中。报道的黑素细胞培养基有添加5%胎牛血清(FCS)、0.15ng/ml EGF、25μg/ml牛垂体提取物(BPE)、20ng/ml佛波酯(TPA)、0.2μg/ml霍乱毒素(CT)的K-SFM培养基;添加10%FCS、0.2μg/ml CT、20ng/ml bFGF的DMEM/F12培养液;添加200μl/ml人黑素细胞生长添加剂(HMGS,含FCS、bFGF、BPE、TPA、肝素、胰岛素、转铁蛋白、氢化可的松)的154培养基;添加1ml/100ml人黑素细胞生长添加剂(HMGS)的MCDB254等。
(二)传代及纯化
原代细胞长至70%~80%时,可用0.25%胰蛋白酶进行消化3~5min传代。利用细胞对胰酶的耐受性差异来筛选纯化(黑素细胞先脱落)、换用无血清培养基短暂培养、用G418抑制Fb的生长等方法来纯化培养黑素细胞。
含TPA培养基的培养基培养效果最好,但存在致瘤危险;仅含牛垂体浸出液或bFGF的培养基原代培养成功率偏低,易被Fb污染。培养的黑素细胞呈星状、树突状分支(图28-16)。
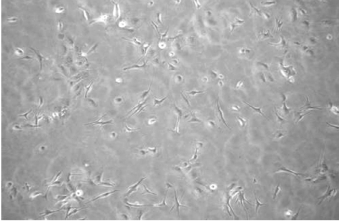
图28-16 原代培养的黑素细胞(×100)
(朱堂友 伍津津)
参 考 文 献
[1]伍津津,朱堂友,鲁元刚,等.表皮真皮分离方法的探索.第三军医大学学报,2004,26(24):2242
[2]Wu JJ,Liu RQ,Lu YG,et al.Enzyme digestion to isolate and culture human scalp dermal papilla cells:a more efficient method.Arch Dermatol Res,2005,297(2):60
[3]Hybbinette S,Bostrom M,Lindberg K.Enzymatic dissociation of keratinocytes from human skin biopsies for in vitro cell propagation.Exp Dermatol,1999,8(1):30
[4]Duval C,Smit NPM,Kolb AM,et al.Keratinocytes Control the Pheo.Eumelanin Ratio in Cultured Normal Human Melanocytes.Pigment cell res,2002,15:440
[5]Magerl M,Kauser S,Paus R,et al.Simple and rapid method to isolate and culture follicular papillae from human scalp hair follicles.Exp Dermatol,2002,11(4):381
[6]Zhang Y,Xiang M,Wang Y,et al.Bulge cells of human hair follicles:segregation,cultivation and properties.Colloids and Surfaces B:Biointerfaces,2006,47:50
[7]Limat A,Hunziker T:Use of Epidermal E- quivalents Generated from Follicular Outer Root Sheath Cells in vitro and for Autologous Grafting of Chronic Wounds.Cell Tissue Organ,2002,172(2):79
[8]Gho CG,Braun JEF,Tilli CMLJ,et al.Human follicular stem cells:their presence in plucked hair and follicular cell culture.Br J Dermatol,2004,150(5):860
[9]R.I.弗雷谢尼.动物细胞培养-基本技术指南.章静波,徐存拴,等,译.第4版.北京:科学出版社,2004:180-227
[10]朱堂友,郝飞,伍津津,等.构建人头皮毛乳头细胞和真皮鞘细胞的分离培养.中国临床康复,2005,9(18):72
[11]钟白玉,吕中法,刘荣卿,等.毛囊真皮鞘成纤维细胞的培养.第三军医大学学报,1999,21(12):935
[12]雷霞,伍津津,鲁元刚,等.人汗腺腺上皮细胞快速分离培养的初步研究.中华皮肤科杂志,2006,39(2):86
[13]Osada A,Iwabuchi T,Kishimoto J,et al.Longterm culture of mouse dermal papilla cells and De Novo hair follicle induction.Tissue Eng,2007,13(5):975
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















