案例十一 课堂五步教学法的运用·化学必修
《第1节 元素周期表》的教学设计
宁都中学 刘 杰
[教学目标]
(一)知识与技能:利用元素在周期表中的位置,初步掌握元素的性质和原子结构的关系;了解位置、结构、性质三者之间的关系并学会初步运用元素周期表掌握同周期、同主族元素性质递变的规律;学生能够从原子结构的角度进一步认识元素周期表的实质,为元素周期律打下更扎实的基础。
(二)过程与方法:通过活动探究第三周期:钠、镁、铝;第I A族:钠、钾;第VIIA族: Cl、 Br、 I等元素的性质实验,理解科学探究的意义,进而培养学生在实验过程中的严谨性。在学习过程中,进一步熟练运用实验、观察等多种手段获取信息,归纳同周期、同主族元素性质的递变规律。
(三)情感态度与价值观:培养学生不断探索的品质;通过利用原子结构的理论解释这些规律,培养学生的分析推理能力;培养学生比较、归纳、抽象能力,通过实验培养学生动手能力及团结协作能力。
[教学重点]
第三周期钠、镁、铝元素的原子结构和元素性质。
碱金属元素的原子结构和元素性质。
卤族元素的原子结构和元素性质。
[教学难点]
同周期、同族元素性质的相似性和递变性。
[教学方法]
综合启发式教学法、实验活动探究法
[教学用具]
(试剂)盐酸(1mol. L-1),NaOH溶液,蒸馏水,金属钠,金属钾,金属镁,金属铝,酚酞溶液, NaI和KBr溶液,新制氯水,溴水。
(仪器)试管,培养皿,烧杯,小刀,滤纸,试管夹,酒精灯,玻璃片,镊子,胶头滴管。
(电教设备)电脑
第一课时
[教学过程]
(引入新课):同学们,上节课我们学习了元素周期表。第一张元素周期表是由俄国科学家门捷列夫制出。他是按相对原子质量排列的,后来不断完善。我们现在常用的元素周期表是按原子的核电荷数排列的。按照元素在元素周期表中的顺序给元素编号,得到原子序数。原子序数和元素结构之间存在着以下关系:
原子序数=核电荷数=质子数=核外电子数
在元素周期表中,有7个横行,叫做“周期”,其中短周期有3个,长周期有3个,不完全周期有1个。
今天,我们就来看看第三周期钠、镁、铝等元素性质如何变化,请同学们根据已经学过的元素周期表完成教材第6页的“科学探究”。
[板书]一、同周期元素性质的递变:
[学生分小组展开科学实验探究] :钠、镁、铝分别与水及盐酸(1 m o l. L-1)的反应巡视,请学生观察,比较钠、镁与水,镁、铝与盐酸反应的现象并作比较,认真填写课本的实验记录,展开交流讨论。(学生结论)金属活动性:钠>镁>铝
[板书]2Na+2H2O=2NaOH+H2↑
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(扩展提示)第三周期除了钠、镁、铝,还有Si、 P、 S、 Cl、 A r,请运用实验、查阅资料结合原子结构示意图(学生独立完成)等方法分析这些元素原子失电子能力或得电子能力的相对强弱。
[科学探究]查阅元素周期表中的有关信息,填写下表。
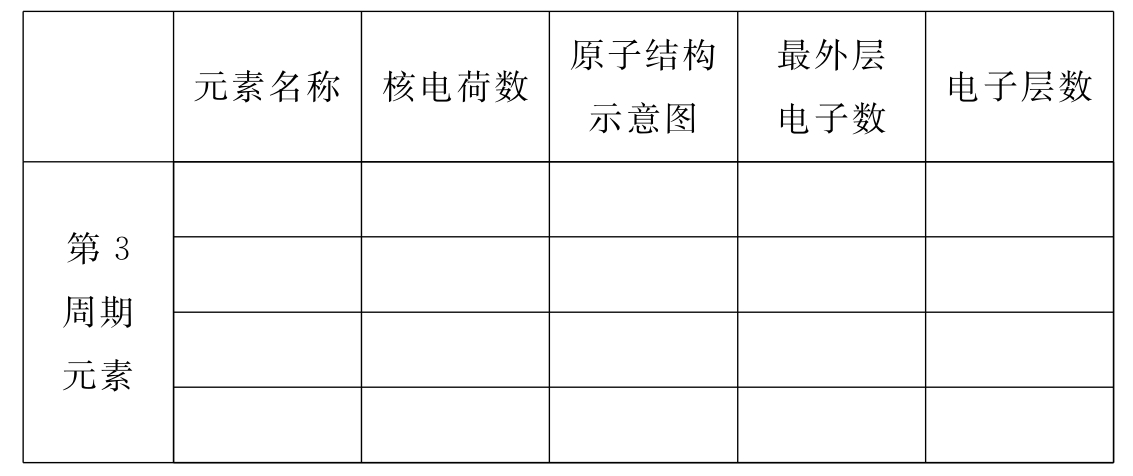
[交流]填写情况,总结异同点。
[板书] [结构异同]异:核电荷数:由小→大;最外层电子数由少→多;同:电子层数相同。
[老师归纳]在第三周期中从钠、镁、铝、 Si、 P、 S、 Cl、 Ar元素比较来看,我们可以看出:同周期元素,从左到右,电子层数相同,核电荷数越来越大,最外层电子数越来越多,原子半径逐渐减少(除稀有气体外),核对电子的引力增强,得电子能力越来越强,失电子能力越来越弱,他们单质的金属性越来越弱,非金属性越来越强。
[板书]规律:同一周期的元素,从左到右(即随着核电荷数的增多),原子半径逐渐减少(除稀有气体外),得电子能力逐渐增强,失电子能力逐渐减弱,非金属性逐渐增强,金属性逐渐减弱。
第二课时
(引入新课)前一节课,我们学习了同周期元素性质的递变规律(让学生复述),那么同主族元素性质又如何递变呢?
周期表中有1 8个纵行,称为“族”,族有主族和副族之分。主族的族序数后面加“ A”,副族呢?加“ B”。另外还有第八族和0族。
在周期表中有些族的元素还有一些特别的名称,例如:
第ⅠA族:碱金属元素(锂,钠,钾,铷,铯)
第ⅦA族:卤族元素(氟,氯,溴,碘,砹)
今天,我们来看看碱金属元素和卤素。
[板书]二、同主族元素性质的递变:
{投影}查阅元素周期表中的有关信息,填写下表。
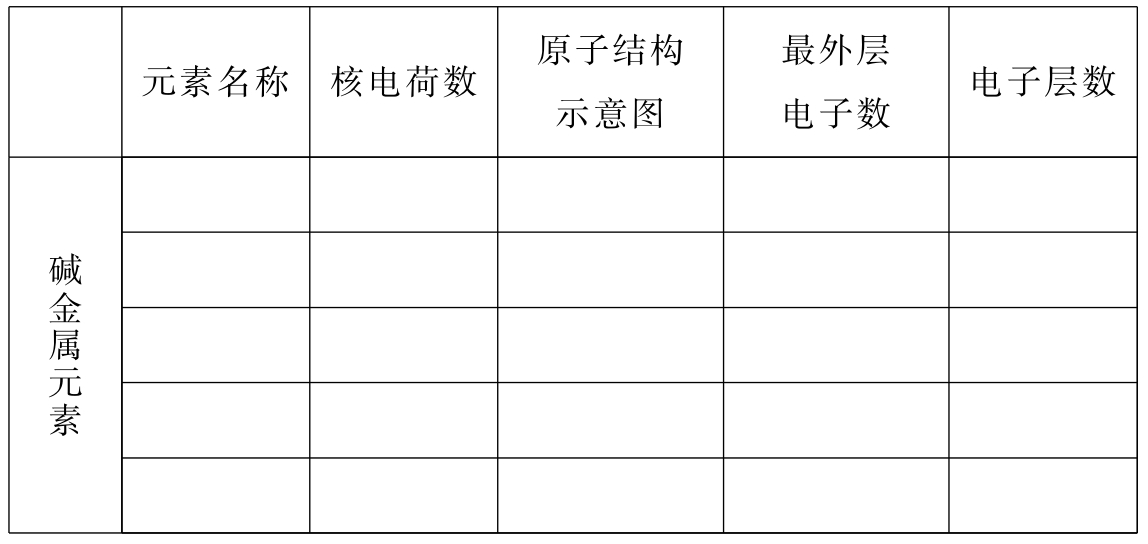
[提问]它们的核电荷数是?最外层电子数呢?电子层数呢?原子半径呢?
[学生回答、交流]填写情况,总结异同点。
[板书] [结构异同] :异:核电荷数:由小→大;电子层数:由少→多;同:最外层电子数均为1个。
师:半径越大,最外层电子离原子核就越远,原子核对最外层电子的吸引力就越小。由此我们可以推测他们的活泼性,应该随着电子层数的增加,越来越活泼。那是不是这样的呢?请同学们根据已经学过的元素周期表完成教材第6页的“科学探究”。本实验有一定的危险性,你们在进行实验时要严格按照老师所给的量进行实验。
[学生分组实验]钾与水反应实验
巡视并强调取用绿豆大小及吸干煤油(注意安全);请学生观察,跟钠与水反应的现象作比较。
[回答]钾比钠活泼,轻微爆炸。
[思考交流]钠与钾的性质有什么相似性与不同?这与原子结构有什么关系?
我们再来看一下金属钾和水的反应:
[切取钾,演示]大家观察一下钾。
[将钾投入水中]注意观察。
[提问]钾和水反应的现象?
[学生回答] [若正确,追问比较]
刚才我们看了钾与水的反应,看到了钾和水反应比钠与水更剧烈。我们推测一下,铯和水反应,应该是比钾和水反应更剧烈。我为大家准备了一小段录像,大家请看一下是不是这样的。
我们看到,铯投入水中,立刻就爆炸了。
请同学在黑板上写出钠和钾分别和水反应的方程式。
[板书]2Na+2H2O=2NaOH+H2↑(评讲方程式)
通过在做钠与水的反应时,我们看到,钠的切口有金属光泽,但迅速变暗了。钾也有相同的情况,为什么呢?
[学生回答]因为和空气中的氧气发生了反应。
碱金属元素的原子最外层都有1个电子,他们的化学性质相似,比如说:都可以和氧气反应,都可以和水反应。在反应的产物中,碱金属的元素化合价都是+1。随着电子层数的增加,他们的原子半径逐渐增加,原子核对最外层电子的引力逐渐增强,跟水和氧气反应时,也表现出一些差异,钾比钠更剧烈,铷、铯的反应就更剧烈。
在书上的第7页边上,有这样的几行小字:元素的金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来比较。若单质越容易从水(或酸)中置换出氢,它的金属性就越强。最高价氧化物的水化物的碱性越强,那么这种元素的金属性就越强。
[归纳]金属性:锂<钠<钾<铷<铯
第三课时
[增设]实验探究:卤素单质间的置换反应:
[实验1]在NaBr滴加氯水,摇荡,再滴加CCl4
[实验2]在KI滴加氯水,摇荡,再滴加CCl4
[实验3]在KI滴加溴水,摇荡,再滴加CCl4
(注意)认真填写实验记录,展开交流讨论
实验记录:

[思考与交流]主族元素随原子核外电子层数增加,他们得失电子能力、金属性、非金属性、递变的趋势。
[小结]卤族元素从上到下,氟、氯、溴、碘原子电子层数越来越多,原子半径越来越大,得电子的能力越来越弱。
{学生阅读}课本P 9:方法引导栏目的文字
[归纳]活泼性: F 2>Cl2>Br 2>I 2
[老师归纳]从碱金属单质和卤素单质这两族的元素性质比较来看,我们可以看出,同族元素,从上到下,核电荷数越来越大,电子层数越来越多,最外层电子数相同。他们单质的化学性质相似——相似性。随电子层数增加,他们金属性越来越强,非金属性越来越弱,失电子能力越来越强,得电子能力越来越弱——递变性。
[板书]规律:同一主族的元素,从上到下(即随着核电荷数的增多),电子层数增加,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
备注:在实施教学的过程中,结合教材呈现的材料,如:方法引导、资料在线、历史回眸、概括整合等资源呈现的知识渗透到教学中。
【练测反馈】
1.下列各组中的性质比较正确的是( )
①酸性:HClO 4>HBrO 4>HIO 4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③稳定性:HCl>H2S>PH3
④还原性:F->Cl->Br-
A.①②④ B.②③④
C.①②③ D.都正确
2.下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一周期主族元素从左往右,其离子半径逐渐减小
D.V I I族元素的氢化物比同周期V I族元素的氢化物更稳定
3.下表为元素周期表的一部分,用化学式或元素符号回答下列问题:
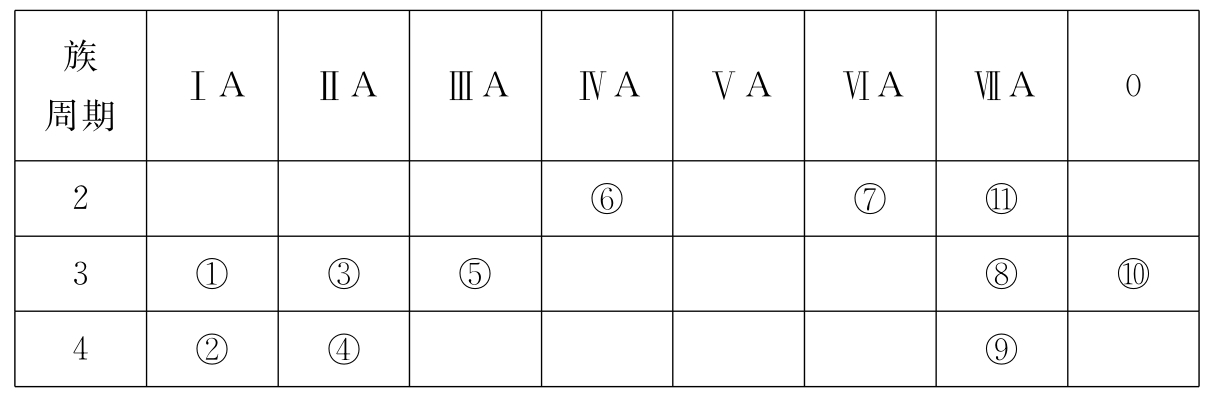
(1)11种元素中,化学性质最不活泼的是______;
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是______;
(3)②③④中形成的简单离子,半径由大到小的顺序是______ ____________________________;
(4)元素⑦的氢化物化学式为______,该氢化物常温下和元素②的单质反应的离子方程式为_________________________________,该氢化物常温下和元素⑧的单质反应的离子方程式为______ ____________________________;
(5)①和⑨的最高价氧化物对应的水化物化学式分别为______和______,①和⑨两元素形成化合物的化学式为__________,该化合物灼烧时的焰为______,该化合物的溶液与元素⑧的单质反应的离子方程为_________________________________;
(6)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________;
(7)⑥和⑧形成的化合物的电子式为____________,该化合物溶解⑨的单质所得的溶液为____________________________________;
(8)⑧⑨ 三种元素形成的气态氢化物最稳定的是________ _________________________。
三种元素形成的气态氢化物最稳定的是________ _________________________。
【板书设计】
第1节 元素周期表
第一课时
一、同周期元素性质的递变:
2Na+2H2O=2NaOH+H2↑
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
金属活动性:钠>镁>铝
[结构异同]异:核电荷数:由小→大;最外层电子数由少→多;同:电子层数相同。
规律:同一周期的元素,从左到右(即随着核电荷数的增多),原子半径逐渐减少(除稀有气体外),得电子能力逐渐增强失电子能力逐渐减弱,非金属性逐渐增强,金属性逐渐减弱。
二、同主族元素性质的递变:
第二课时
[结构异同] :异:核电荷数:由小→大;电子层数:由少→多;同:最外层电子数相同。
2Na+2H2O=2NaOH+H2↑
金属性:锂<钠<钾<铷<铯
第三课时
2NaBr+Cl2=2NaCl+Br2
2NaI+Cl2=2NaCl+I2
2NaI+Br2=2NaBr+I2
[归纳]活泼性: F2>Cl2>Br 2>I 2
规律:同一主族的元素,从上到下(即随着核电荷数的增多),电子层数增加,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















