水通道蛋白(aquaporin,AQP)是一类在细胞膜上介导水分子及其他中性代谢分子跨膜转运的特异性孔道,属于一个主要内源性蛋白(major intrinsic proteins,MIP)家族。AQP最早从血红细胞中分离纯化获得,在非洲爪蟾(Xenopus laevis)卵母细胞表达系统中证实了其具有水通道的功能(Preston GM et al,1992)。研究表明,AQP在水分运输、离子选择透过性、渗透压调节等过程中均起到重要作用。在渗透压作用下,水势的变化不仅影响到水通道孔道的开闭,而且会影响到水通道蛋白的合成,而生物体中70%~90%的水分是通过水通道进行转运的,因此AQP在维持细胞内外的渗透压平衡中发挥着关键的作用。水通道管的空间尺寸限制了比水分子大的小分子的通过,与此同时水通道管的高度亲水环境阻碍了水溶液中离子的通过,所以水通道只允许水分子的通过。另外,两个高度保守的天冬氨酸−脯氨酸−丙氨酸(NPA)结构域位于水通道三维结构的核心,在膜脂双层中间形成一个可双向运输水分的孔道。水通道蛋白的这些特殊结构使得水分能够顺畅地出入细胞,使细胞始终处在一个稳定的渗透压环境中,在机体的渗透压调节中发挥重要作用。关于AQP的研究主要集中在植物和昆虫上,在水产动物中仅有少量相关报道。研究报道表明,AQP在金头鲷(Sparus aurata)(Deane EE et al,2006)、黑鲷(Acanthopagrusschlegeli)(An KW et al,2008)、斑马鱼(D. rerio)(Tingaud-Sequeira A et al,2010)、欧洲鳗鲡(Anguilla anguilla)(Maclver B et al,2009)和日本鳗鲡(Anguilla japonica)(Kim YK et al,2010)等鱼类的渗透压调节中均发挥重要作用,但其在甲壳动物中的研究尚未见报道。
本研究利用从三疣梭子蟹cDNA文库中筛选获得的水通道蛋白基因EST序列,采用RACE技术首次克隆三疣梭子蟹水通道蛋白(PtAQP)基因序列,全长1.7.2 bp,包含771 bp的开放阅读框,编码1个由256个氨基酸组成的多肽(图40)。序列分析发现,PtAQP基因编码的氨基酸序列含有6个跨膜区,具有MIP家族高度保守的氨基酸序列,表明其属于MIP家族。此外,PtAQP基因含有两个NPA结构单元,研究报道表明,进化过程中的原位重复导致AQP基因含有两个NPA特征结构单元(丁炜东等,2012),其均与水通道蛋白功能密切相关,其中任何一个的缺乏均会导致水输送能力的下降。同源性分析表明,三疣梭子蟹PtAQP与可口美青蟹AQP1的同源性高达87%(图41)。系统进化分析表明,三疣梭子蟹PtAQP与可口美青蟹AQP1紧密聚为一支(图42)。
PtAQP基因的表达具有组织特异性,实时荧光定量PCR结果显示(图43),PtAQP基因在三疣梭子蟹第1对鳃、第6对鳃、肝胰腺、肌肉、眼柄、血细胞、心脏、肠和胃中均有表达。其中,在胃中的表达量最高,其次为肌肉、肝胰腺和眼柄,鳃中的表达量较低,而心脏和血细胞中仅有微量表达。Borgnia等(Borgnia M et al,1999)研究发现,AQP1在哺乳动物的眼睛、呼吸道(相当于甲壳动物的鳃)、肾脏、脑、消化道和肝脏中均有表达,这与本研究结果一致。Aoki等(Aoki M et al,2003)研究发现,在日本鳗鲡消化道器官如食管、胃和肠中,AQP1具有相对较高的表达量,与本研究结果一致,说明胃是参与水生动物渗透压调节相关的重要器官。

图40 三疣梭子蟹PtAQP基因核苷酸序列及其推导的氨基酸序列
ATG:起始密码子;*表示终止密码子;NPA结构单元用方框表示;MIP家族保守序列用下划线表示。

图41 三疣梭子蟹PtAQP氨基酸序列与其他物种AQP氨基酸序列比对

图42 利用MEGA4.0软件构建的基于AQP氨基酸序列的NJ系统进化树
分叉处数值表示1 000次重复抽样所得到的置信度;标尺长度代表每个位点发生0.1次置换。各物种AQP登录号:可口美青蟹(AFR36904)、罗氏沼虾(AET34919)、斑节对虾(AEI25531)、山松甲虫(AEE63193)、家白蚁(BAG72254)、埃及伊蚊(AAF64037)、白斑角鲨(AEJ08190)、斑马鱼(NP_001003749)、野鸽(EMC82019)、小鼠(BAE38677)、猕猴(EHH17401)、人类(CAQ51480)。
高盐度胁迫3 h后,PtAQP基因的相对表达量出现显著下调现象,随后于3~72 h保持较低的相对表达水平,各时间点差异不显著(P , 0.05)(图44)。低盐胁迫组中,PtAQP基因的相对表达量于低盐胁迫3 h后出现显著下调,并于12 h达到最小值,相对表达量为对照组的0.14倍(P , 0.05);随后,PtAQP的相对表达量于24 h开始上调,并于48 h达到最大值,相对表达量分别为对照组的1.07倍(P , 0.05),随后相对表达量再次出现下调现象(图45)。Real-time PCR检测了三疣梭子蟹盐度胁迫后不同时间点肝胰腺中PtAQP基因的相对表达情况。与对照组相比,高盐胁迫后3 h,PtAQP基因的相对表达量出现显著下调,并于12 h达到最小值,为对照组的0.15倍(P , 0.05);随后于24 h出现上调,但差异不显著(P . 0.05);然后相对表达量于48 h再次显著下调(P , 0.05),并于72 h恢复到初始水平(图46)。低盐胁迫后,PtAQP基因的相对表达量于6 h出现下调现象,并达到最小值,但差异不显著(P . 0.05);随后于12~24 h出现显著上调(P , 0.05),相对表达量为对照组的6.99倍,然后于48~72 h出现下调现象(图47)。
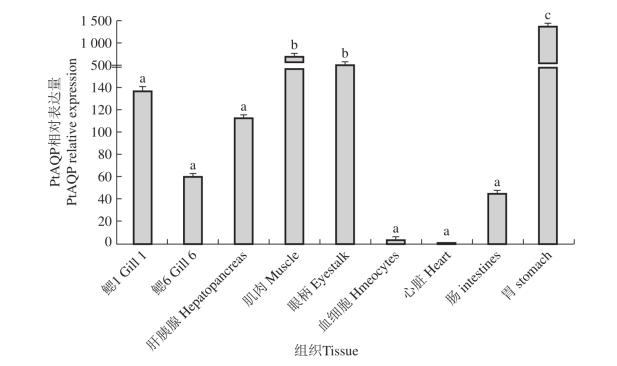
图43 三疣梭子蟹PtAQP基因在不同组织中的表达分布
不同字母表示组间差异显著(P , 0.05),相同字母表示组间差异不显著(P . 0.05)。

图44 高盐胁迫下三疣梭子蟹鳃中PtAQP基因的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)
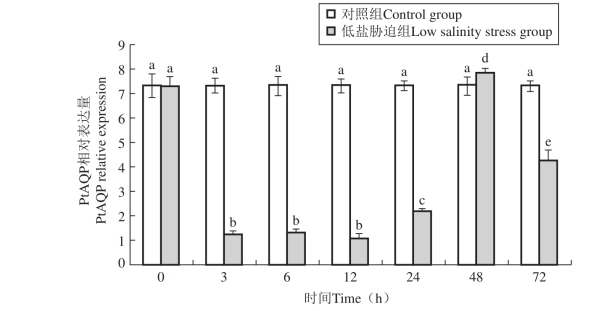
图45 低盐胁迫下三疣梭子蟹鳃中PtAQP基因的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)。

图46 高盐胁迫下三疣梭子蟹肝胰腺中PtAQP基因的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)。
关于水通道蛋白AQP在渗透压方面的研究,在植物中相对较多,而在水生动物中的研究则相对较少。Mahdieh等(Mahdieh M et al,2008)研究了烟草水通道蛋白基因在干旱胁迫条件下的表达水平变化,结果显示其在干旱胁迫12 h的表达量明显下调,表明水通道蛋白基因在转运水分的过程中发挥重要作用,其表达量下调可以降低水的渗透倒水度。Barrieu等(Barrieu F et al,1999)研究发现,轻度干旱胁迫下水通道蛋白存在失水和复水两个非常关键的过程。本研究中,在盐度胁迫下三疣梭子蟹适应盐度变化也存在类似的两个过程。盐度胁迫下PtAQP基因的表达总体呈先下调后回升再下调至初始水平的表达规律。根据表达模式推测其作用机理可能为:盐度胁迫初期,体内外渗透压失衡,三疣梭子蟹首先通过抑制水通道蛋白活性以避免大量水分子流失和渗入,从而降低盐度胁迫对机体的损伤;之后机体通过离子转运或自由氨基酸途径主动调整体内渗透压水平,当体内外渗透压再次趋于平衡时,又部分恢复水通道蛋白活性,以维持机体正常运转或代谢。在盐度胁迫的过程中,鳃中低盐胁迫组的PtAQP表达量始终高于高盐组,表明低盐度胁迫时PtAQP的渗透倒水活性明显高于高盐度胁迫,这与Giffard-Mena等(Giffard-Mena I et al,2007)在鲈中的相关研究结果一致。这种调节方式提高了三疣梭子蟹抵抗盐度胁迫的能力,但是其具体的调节机制还有待于进一步的研究。

图47 低盐胁迫下三疣梭子蟹肝胰腺中PtAQP基因的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















