氯离子通道是分布于细胞膜或细胞器质膜上的一类能够转运氯离子及其他阴离子的通道蛋白(陈丽娥等,2010)。研究表明,氯离子通道可调控不同的生理过程和细胞功能,如:Cl2运输、渗透压调节、离子稳态、胞内pH、细胞容积调节、电兴奋性、金属耐性和信号识别与转导(Uchida S et al,1993;Adachi S et al,1994;Hechenberger M et al,1996),甚至在细胞迁移、细胞增殖和分化等过程中也起到一定作用(Jentsch T J et al,1994)。氯离子通道分为三种类型:氯通道(chloride channel,CLC)、囊性纤维化跨膜传导调解因子(cystic fibrosis transmembrane conductance regulator,CFTR)和胞内氯离子通道(chloride intracellular channel,CLIC)。CLIC家族成员大多数为单次跨膜蛋白,与谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)具有一定的同源性。1997年Valenzuela等(Valenzuela S M et al,1997)从人类单核细胞中克隆了第一个CLIC1基因。现在已经发现了六个CLIC家族成员,各成员之间高度保守。2003年Berry等(Berry K L et al,2003)在线虫中发现了编码一种CLIC样蛋白的基因EXC-4。目前关于氯离子通道蛋白的研究主要集中在哺乳动物、两栖类、昆虫和植物,在水产动物中研究较少,而在甲壳动物中更是尚未见报道。
本研究从本实验室构建的三疣梭子蟹转录组文库中筛选到胞内氯离子通道蛋白基因(PtCLIC)序列,采用RACE技术克隆获得该基因全长cDNA序列,该基因全长为2.0.0 bp(GenBank登录号为KJ186099),包括76 bp的59端非编码区(UTR),1.1.2 bp 的39端非编码区和762 bp的开放阅读框(ORF)。39端含有一个PolyA尾和一个多聚腺苷酸加尾信号(AATAAA)(图33)。DNAstar软件分析表明,PtCLIC基因编码一个由253个氨基酸组成的的蛋白质,相对分子质量为29.2.3 103,理论等电点为5.93。ProtParam tool软件分析表明,PtCLIC蛋白带有负电的氨基酸残基为36个(Asp和Glu),带有正电的氨基酸残基为31个(Arg和Lys),不稳定系数为46.34,亲水性平均数为20.449,属于不稳定蛋白。InterProScan和TMHMM2.0软件分析表明,PtCLIC基因翻译的蛋白质结构中无跨膜结构域,且相对分子质量较小,推测该蛋白本身并不是氯通道,而仅仅起到氯通道活化蛋白的功能。另外,在与PtCLIC同源关系较近的蚤状溞(D. pulex)和地中海实蝇(C. capitata)等物种的CLIC氨基酸序列上亦不存在跨膜结构域,这与本实验结果一致。同源性分析表明(图34),PtCLIC与蚤状溞等物种CLIC的同源性均高于80%,确认该基因为三疣梭子蟹CLIC基因。多氨基酸序列比对分析表明,PtCLIC氨基酸序列保守性较高,与NCBI数据库中氨基酸序列比对结果未能确认本研究所得PtCLIC基因具体亚型,因此PtCLIC基因的分型工作有待于深入研究。系统进化分析表明(图3),PtCLIC与同属的拟穴青蟹亲缘关系较近,与野猪等脊椎动物的亲缘关系较远。验证了亲缘关系近的同源性高,亲缘关系远的同源性低的规律,符合遗传进化规律。

图33 三疣梭子蟹PtCLIC基因cDNA全长及其编码的氨基酸序列
起始密码子用横线标出;*表示终止密码子;加尾信号(AATAAA)用方框标出。
实时荧光RT-PCR证实PtCLIC基因在检测的所有组织中均有表达(图35)。在肝胰腺中的表达量最高,且显著高于其他组织中的表达量。这表明三疣梭子蟹PtCLIC基因的表达具有组织特异性。Liu等的研究表明(Liu et al,2011),肝脏是甲壳动物离子储存和代谢的中心,由此推测三疣梭子蟹的肝胰腺在氯离子转运中起到了重要作用。

图34 三疣梭子蟹PtCLIC氨基酸序列与其他物种的CLIC氨基酸序列比对

图35 利用MEGA4.0软件NJ法构建的系统进化树
分叉处数值表示1 000次重复抽样所得到的置信度;标尺长度代表每个位点发生0.1次置换。各物种CLIC登录号:拟穴青蟹(ACY66426)、埃及伊蚊(ABF18454)、蚤状溞(EFX90323)、捕食螨(XP_003742444)、野猪(NP_001231357)、白眉翁(XP_005044363)。

图36 三疣梭子蟹不同组织中PtCLIC基因的表达
不同字母表示组间差异显著(P , 0.05),相同字母表示组间差异不显著(P . 0.05)。
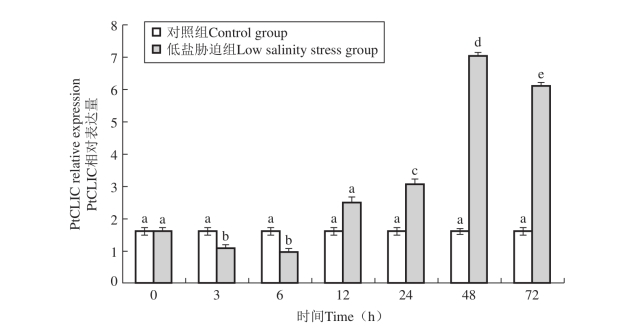
图37 低盐胁迫下三疣梭子蟹PtCLIC基因在鳃中的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)。
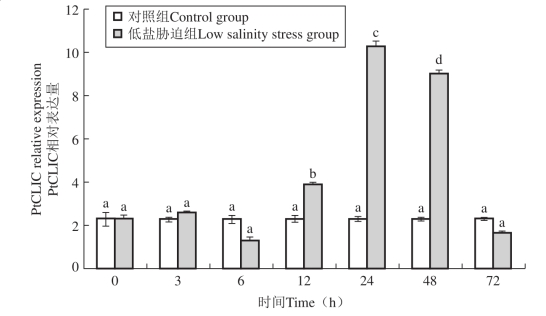
图38 低盐胁迫下三疣梭子蟹PtCLIC基因在肝胰腺中的表达情况
不同字母表示不同时间点之间差异显著(P , 0.05),相同字母表示不同时间点之间差异不显著(P . 0.05)。
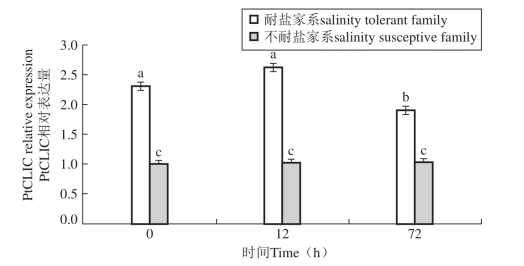
图39 低盐胁迫下低盐耐受家系和低盐敏感家系中PtCLIC基因在鳃中的表达情况
不同字母表示不同家系之间差异极显著(P , 0.05),相同字母表示不同家系之间差异不显著(P . 0.05)。
目前关于甲壳类动物胞内氯离子通道蛋白对盐度胁迫的应答机制还未见报道。鳃是甲壳动物与外界环境进行气体和离子交换的介质,而肝脏又是离子储存和代谢的中心,因此研究低盐胁迫进程中PtCLIC在鳃和肝胰腺中的表达规律十分必要。Freire等(Freire C A et al,2008)研究了甲壳动物中NaCl的吸收和排出过程,证实了Cl2的平衡是甲壳动物渗透压调节的关键。在Cl2的吸收过程中,首先Cl2与HCO32交换通过鳃上皮顶部质膜,继而在基底侧质膜上通过Cl2通道进入血淋巴中。而在Cl2的排出过程中,Cl2首先以Na1 /K1 /2Cl2形式协同转运通过基底侧质膜,继而在鳃上皮顶部质膜上通过Cl2通道排到水环境中。本实验结果显示低盐胁迫下PtCLIC基因在鳃和肝胰腺中的表达总体呈现先上调然后下调的规律(图36、图37)。低盐胁迫下PtCLIC基因的表达量上升,可增强基底侧质膜上Cl2通道蛋白的活性(Valenzuela S M et al,1997),进而增强三疣梭子蟹对Cl2的吸收能力。然而当体内的Cl2水平被调节到正常水平时,PtCLIC基因又基本恢复到初始水平,出现下调表达。
PtCLIC的表达在低盐胁迫下耐低盐家系和低盐敏感家系间差异显著,耐低盐家系中PtCLIC的相对表达量存在上调和下调的过程,表达量最大值为低盐敏感家系的2.53倍,而低盐敏感家系中PtCLIC的相对表达量基本不变且维持在较低水平(图38)。此差异证明在耐低盐家系中PtCLIC存在一个积极的渗透压调节过程,而低盐敏感家系几乎被动接受应激。该研究结果可辅助选育三疣梭子蟹耐低盐品系。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















