第六节 蛋白质及氨基酸
蛋白质的分离纯化是研究蛋白质结构与功能的基础。无论是对蛋白质结构与功能的研究,还是生产人们所需要的蛋白质产品,都涉及蛋白质的分离纯化。蛋白质分离纯化的工艺过程,既要考虑尽可能多地除去杂蛋白,也要考虑提高所需要蛋白质的产量,即提高产品的回收率。通常用比活性来反映蛋白质的纯度。比活性是指单位蛋白质重量中的生物活性。用活性单位/毫克蛋白表示。目前,蛋白质分离与纯化的发展趋势是精细而多样化技术的综合利用,但基本原理均是以蛋白质的性质为依据。实际工作中应按不同的分离要求和可能的条件选择不同的方法。
从物质组织制备蛋白质的方法可概括为提取、分离和纯化。
一、蛋白质的提取
蛋白质的提取是从各种材料中将蛋白质提取出来的过程,包括以下步骤:
(1)材料的选择 蛋白质的提取首先要选择适当的材料,选择的原则是材料应富含所需蛋白质,且来源方便。原料确定后,还应注意管理。
(2)组织细胞的粉 一些蛋白质以可溶形式存在于体液中,可以直接分离。但多数蛋白质存在于细胞内,并结合在一定的细胞器上,故需选择适当的方法,将组织和细胞破碎。一般用超声波、电动搅拌器、匀浆器破碎动物组织和细胞;用加砂研磨、高压挤压、纤维素酶破碎植物组织和细胞匀浆是机体软组织破碎最常用的方法之一。植物组织可用石英砂和适当提取液混合研磨;微生物的细胞壁非常坚韧,可采用超声波、高压挤压、酶解等物理、化学或机械方法加以破碎。
(3)提取 组织和细胞破碎后,根据它们的溶解性,加入适当的溶剂将所需的蛋白质提取出来。清蛋白可用水来提取;球蛋白可用中性盐提取;谷蛋白可用稀酸或稀碱提取。为了有利于提取,可用较低或较高pH值的提取液。必须注意提取时所用的溶剂量要适当,否则将增加回收产品的困难。在提取过程中,通常要保持低温。蛋白质提取的条件很重要,总的要求是要尽量提取所需的蛋白质,又要防止蛋白酶的水解和其他因素对蛋白质特定构象的破坏作用。蛋白质的粗提取液可进一步分离和纯化。
二、蛋白质的分离纯化
从破碎组织或细胞中提取的蛋白质溶液,含有许多不同分子量的蛋白质,为获得其中某一种蛋白质,必须进一步分离纯化,将需要的蛋白质与同时存在的其他蛋白质分开。对蛋白质的分离纯化,是根据蛋白质的性质确定的。分离纯化的方法很多,常用的方法有:
1.根据溶解度不同的分离方法
(1)等电点沉淀 蛋白质在等电点时的溶解度最小。当蛋白质混合物的pH值被调到其中一种成分的等电点时,该蛋白质将大部分或全部沉降下来,其他蛋白质的等电点高于或低于该蛋白质,为此仍保留在溶液中。这样沉淀出来的蛋白质保持着天然构象,能再溶解。
(2)盐析 利用盐析法分离和纯化蛋白质已有100多年的历史。不同性质的蛋白质可通过加入不同浓度的中性盐而分别从溶液中沉淀出来,此法为分级沉淀法。常用饱和硫酸铵溶液来沉淀蛋白质,调整不同饱和度的硫酸铵溶液,可将不同的蛋白质分开。此法为最常用的方法之一。
(3)有机溶剂沉淀法 利用有机溶剂能降低蛋白质在水中的溶解度,使蛋白质沉淀,对蛋白质进行分离纯化。常用的有机溶剂有乙醇、甲醇、丙酮等。在低温条件下缓慢向蛋白质溶液中加入冷的有机溶剂,在一定的pH值和离子强度下,蛋白质会发生沉淀,控制有机溶剂的浓度,可以达到分离不同蛋白质的目的。由于在室温下有机溶剂能使多数蛋白质失活,因此,整个分离纯化的过程必须保持低温。
2.根据电离性质不同的分离方法
蛋白质是两性电解质,在一定的pH值条件下,不同的蛋白质所带电荷的质和量各异,可用电泳法或离子交换色谱法进行分离纯化。
(1)电泳法 带电质点在电场中向与本身所带电荷相反的电极移动,这种性质称为电泳。蛋白质除在等电点外都具有电泳性质。
电泳的方法很多,已经成为鉴定生物大分子并分析它们纯度的基本方法。由于电泳装置、电泳支持物的不断改进和发展以及电泳的目的不同,它已经构成形式多样、方法各异但本质相同的系列技术。将蛋白质溶于缓冲液中通电进行的电泳称为自由界面电泳;将蛋白质溶液点在浸了缓冲液的支持物E进行的电泳称为区带电泳;用滤纸作支持物的称纸上电泳;用凝胶(如淀粉、琼脂、聚丙烯胺等)作支持物的称凝胶电泳。在玻璃管中进行的凝胶电泳,蛋白质的不同组分形成环状,称为圆盘电泳。在铺有凝胶的玻璃板上进行的电泳称为平板电泳。纸上电泳和凝胶电泳比较简便,实验室用得较多。
(2)离子交换色谱法 离子交换色谱法是一种常用的分离纯化的方法。离子交换色谱作用是指一个溶液中的某种离子与一个固体中的另一种具有相同电荷的离子相互调换位置,即溶液中的离子跑到固体上去,把固体上的离子替换下来。最常用的是使用各种类型的离子交换剂的柱色谱法。离子交换剂是通过化学反应将带电基团引入到惰性支持物上形成的。如果带电基团带负电,则能结合阳离子,称为阳离子交换剂;如果带电基团带正电,则能结合阴离子,称为阴离子交换剂。
分离蛋白质是根据在一定pH值条件下蛋白质所带电荷不同而进行的分离方法。常用于蛋白质分离的离子交换剂有弱酸型的羧甲基纤维素(CM纤维素)和弱碱型的二乙基氨基乙基纤维素(DEAE纤维素),前者为阳离子交换剂,后者为阴离子交换剂。还有改进型CMSephadex(葡聚糖凝胶)、DEAE-Sephadex等。
蛋白质与离子交换剂的结合是靠相反电荷间的静电吸引,吸引力的大小与溶液的pH值有关。常通过改变溶液中盐类离子强度和pH值来完成蛋白质混合物的分离,结合力小的蛋白质先被洗脱出来。
(3)凝胶过滤法 凝胶过滤即凝胶过滤色谱,又称为分子筛色谱,是一种柱色谱。它是20世纪60年代发展起来的一种快速简便的生物化学分离分析方法,目前已经在生物化学、分子生物学以及医药学等领域中得到了广泛的应用。
凝胶过滤是指某混合物随流动相经固定相(凝胶)的凝胶柱时混合物中各组分按其分子大小不同而被分离的技术。固定相是一种不带电荷的具有三维空间的多孔网状结构物质,凝胶的每个颗粒的细微结构如同一个筛子,小的分子可以进入凝胶网孔,而大的分子则被阻于凝胶颗粒之外,因而具有分子筛的性质。
凝胶过滤是根据分子大小来分离蛋白质混合物的最有效的方法之一,常用的凝胶有交联葡聚糖凝胶(商品名为Sephadex)、聚丙烯酰胺凝胶(商品名为Bio-gelP)和琼脂糖凝胶(商品名为Sepharose)。当含有不同分子大小的蛋白质混合液通过装填有高度水化的惰性多聚体(常用葡聚糖凝胶和琼脂糖凝胶)的色谱柱时,这些物质随洗脱液的流动而移动。分子量不同的蛋白质分子流速不同,分子量大的蛋白质因不能进入凝胶粒内网状结构,便直接沿着凝胶粒间空袭随洗脱液移动,流程短,移动速度快,故先流出来;而分子量小的蛋白质因能进入容纳它的空穴进入凝胶颗粒内部,然后再扩散出来,故流程长,移动速度慢,最后流出,从而达到将不同分子量大小的蛋白质相互分离的目的。凝胶过滤色谱的原理(见图2-8)。
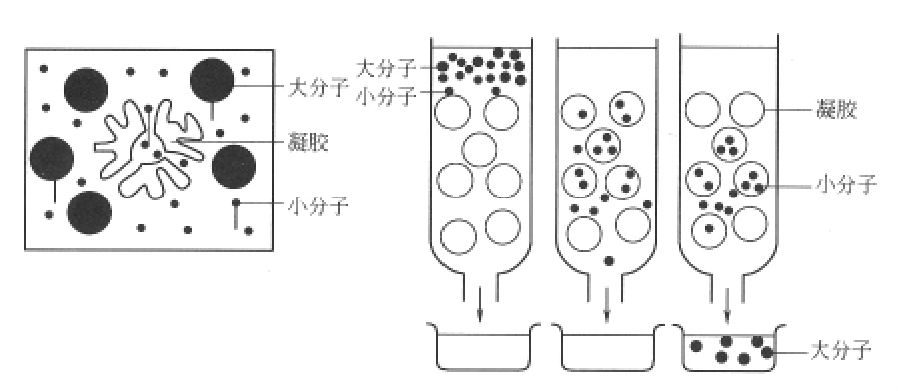
图2-8 凝胶过滤色谱的原理
关于蛋白质的分离纯化的方法本节只介绍了其概况,具体操作方法需参考有关书籍。
三、蛋白质的分析检测
1.蛋白质含量测定
蛋白质含量测定最常用的方法有凯氏定氮法、紫外吸收法、双缩脲法、酚试剂法。
(1)凯氏定氮法(Kjeldbal法) 这是测定蛋白质含量的经典方法。其原理是蛋白质具有恒定的含氮量,平均为16%,因此测定蛋白质的含氮量即可计算出其含量。含氮量的测定是将样品与浓硫酸共热,含氮的样品即分解产生氨,氨又与硫酸作用,生成硫酸铵,此过程称为“消化”。然后经强碱碱化使硫酸铵分解释放出氨,借蒸汽将氨蒸馏出来,用硼酸吸收,根据此酸液被中和的程度,计算出含氮量。从总含氮量换算成粗蛋白质的含量。
(2)紫外吸收法 含有酪氨酸和色氨酸的蛋白质在280nm处有特征性的最大吸收峰,可用于蛋白质的定量。此法简单、快速、不损失样品,测定蛋白质的浓度范围是0.1~0.5mg/mL。
2.蛋白质纯度鉴定
蛋白质纯度是指在一定条件下的相对均一性。蛋白质纯度鉴定的方法很多,如结晶法、超速离心沉淀法、等电聚焦电泳法、溶解度分析法、生物活性测定及免疫学分析法等。
因为蛋白质的纯度标准主要取决于测定方法的检测极限,用低灵敏度的方法证明是纯的样品,改用高灵敏度的方法则证明是不纯的。所以在确定蛋白质的纯度时,应根据要求选用多种不同的方法从不同的角度测定其均一性,综合分析判断才能得出比较切合实际的结论。
四、蛋白质的分类
蛋白质种类繁多,化学结构复杂,故无适当的分类方法。目前多根据其组成、分子形状或功能分类。
(1)按组成分类 蛋白质根据分子组成成分不同,可分为单纯蛋白质和结合蛋白质两大类。
①单纯蛋白质 只由氨基酸组成的蛋白质称为单纯蛋白质。根据其来源及理化性质,特别是溶解度、热凝固、盐析等差别,又可分为清蛋白、球蛋白、谷蛋白、醇溶蛋白、精蛋白、组蛋白和硬蛋白等7类。
②结合蛋白质 结合蛋白质由单纯蛋白质和非蛋白成分组成。根据其非蛋白成分的不同,又可分为核蛋白、糖蛋白、蛋白聚糖、脂蛋白、色蛋白、磷蛋白和金属蛋白等7类。
(2)按分子形状分类 根据分子形状不同,可将蛋白质分为球状蛋白质和纤维状蛋白质两大类。
①球状蛋白质 此类蛋白质形状近似球状或椭圆形,多数溶于水或盐溶液,许多是具有生理活性的蛋白质。如血红蛋白、肌红蛋白、酶、免疫球蛋白等。
②纤维状蛋白质 此类蛋白质多呈细棒或纤维状,一般不溶于水,多数为结构蛋白,主要起支持和保护作用。如结缔组织、骨中的胶原蛋白和弹性蛋白,毛发、指甲中的角蛋白等。
(3)按蛋白质的功能分类 根据蛋白质在生物体生命活动中所起的作用不同,可将蛋白质分为活性蛋白质和非活性蛋白质两大类。酶、蛋白类激素、血红蛋白等属于活性蛋白质,胶原蛋白质、角蛋白、弹性蛋白等属于非活性蛋白质。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















