晋明芬 高年发
(天津市工业微生物重点实验室天津科技大学生物工程学院 天津 300222)
摘要:利用细菌进行L-乳酸的发酵,该细菌为兼性厌氧菌,通过几种发酵方式的比较,得出适合该菌种的发酵方式为先摇床振荡培养24h后再转入静置培养;同时对玉米糖化液的初糖浓度进行比较,确定初糖浓度应控制在120~140 g/L;利用响应面法,通过中心组合实验及响应面分析优化了发酵培养基中的3个因素,即蛋白胨、豆粕水解液和玉米浆的量,建立了影响因素与响应值L-乳酸产量之间的函数关系,得到一个回归方程,根据回归方程寻优得出,豆粕水解液为34.07 g/L,蛋白胨为24.40g/L,玉米浆为10 g/L。在此培养方式及培养基的基础上进行摇瓶发酵,乳酸产量为117.03g/L,转化率为97.53%,纯度为97.94047%,而且转化率比优化前的78.95%提高了18.58%。
关键词:细菌TL-2; L-乳酸;发酵方式;响应面分析法
乳酸是一种常见的结构简单的羟基羧酸,广泛存在于人体、动物体、植物和微生物中,乳酸按其旋光性可分为D (-) -乳酸,L (+) -乳酸和DL-乳酸三种[1]。人体只能代谢利用其中的L-乳酸,因此,世界卫生组织提倡使用L-乳酸作为食品添加剂和内服药,取代目前普遍使用的DL-乳酸。此外,L-乳酸、L-乳酸盐及其聚合物还广泛应用于医药、农业和化学工业。尤其近几年,人们利用L-乳酸聚合生成的聚L-乳酸(PLA)制造生物降解塑料、绿色包装材料及家用薄膜,用以解决日益严重的环境污染问题,引起了世界的广泛关注,应用前景非常广阔[2]。乳酸的发展潜力巨大,被称为化工产品中沉睡的巨人[3]。
提高L-乳酸产量、纯度及转化率,降低生产成本,是乳酸迅速发展的基本前提。而要提高产量,降低成本,就需要对生产菌种的发酵培养方式及发酵培养基进行优化,为后续的工业化生产提供一定的理论依据。
1 材料与方法
1.1 菌种
细菌TL-2(Lactobacillus casei,乳酸乳杆菌干酪亚种) ,由本研究室保藏。
1.2 培养基(g/L)
种子培养基葡萄糖40 (玉米糖化液) ,小肽(由黑龙江乐能生物公司提供) 30,玉米浆5,豆粕水解液10,KH2PO41,(NH4)2SO45,碳酸钙50,pH 6.0~6.5。灭菌条件: 115℃,15min。
发酵培养基葡萄糖120~140 (玉米糖化液) ,豆粕水解液30,蛋白胨20,玉米浆10,碳酸钙量为糖量的45%,pH 6.0~6.5。灭菌条件: 115℃,15min。
1.3 分析方法
乳酸和葡萄糖的测定:采用生物传感分析仪(SBA-40C ,山东省科学院生物研究所研制)测量。
菌体浓度的测定:比浊法(A600) 。
L-乳酸的纯度的测定:高效液相色谱法测定发酵液中的乳酸总量,用SBA-40C生物传感分析仪测L-乳酸含量,两者之比即得发酵液中L-乳酸的纯度。
2 结果与讨论
2.1 静置发酵和摇床发酵的比较
从图1可以看出,同样培养基,同样接种量的条件下,摇床发酵比静置发酵产酸快,产量高且残糖少,发酵周期短。这说明在发酵时增加一定的溶氧能够促进乳酸菌TL-2的生长并使之多产乳酸。
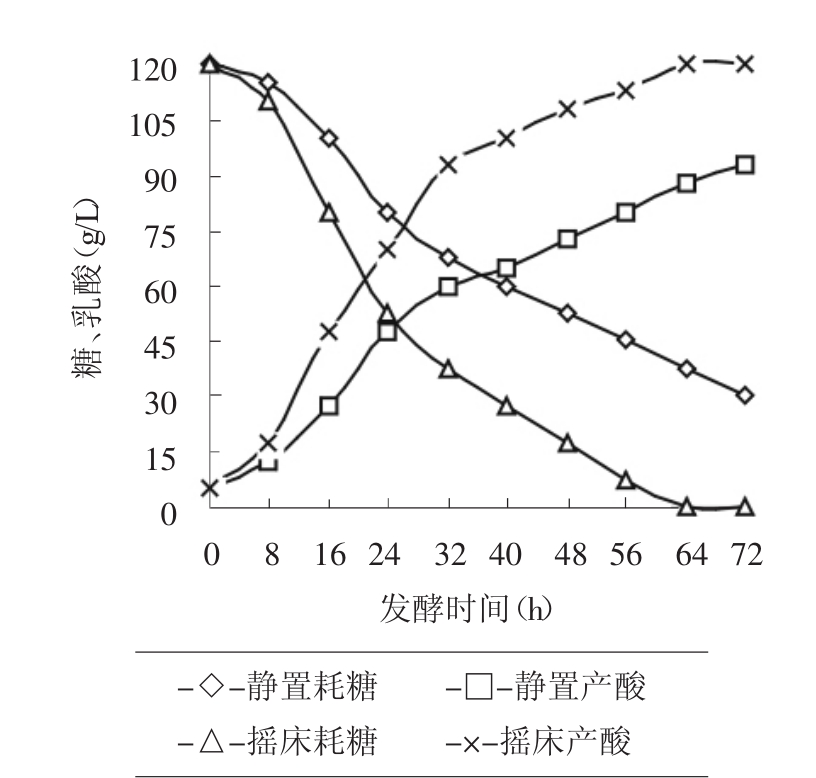
图1 摇床和静置发酵时产酸和耗糖曲线
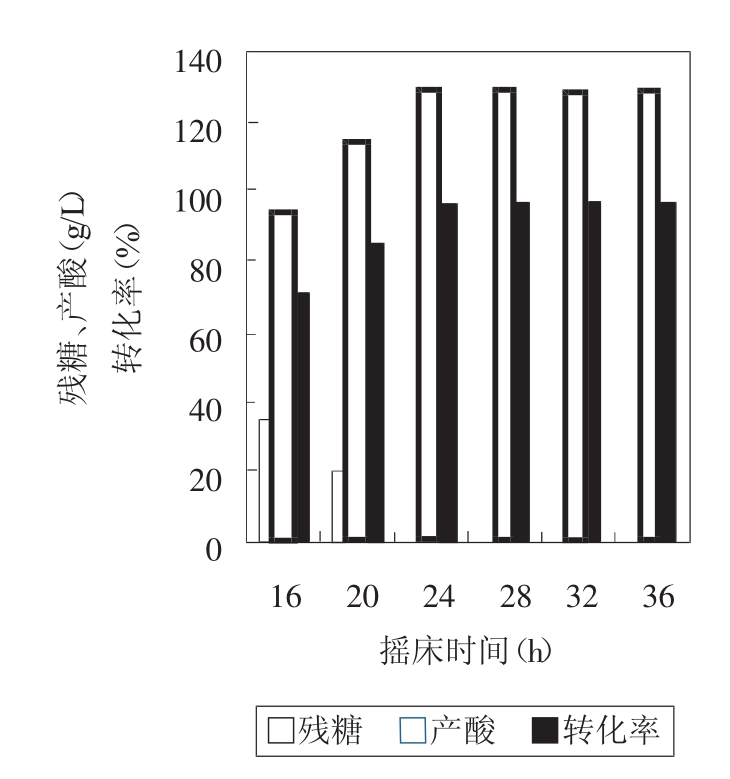
图2 不同摇床培养时间乳酸发酵的比较
兼性厌氧发酵要经过有氧呼吸和厌氧发酵这两个代谢过程,因而它介于这两者之间[8]。根据同型乳酸发酵机理,乳酸菌在在厌氧条件下利用葡萄糖经过EMP途径生成丙酮酸,丙酮酸在乳酸脱氢酶作用下接受氢被还原成乳酸。EMP途径必须是厌氧条件,但是丙酮酸存在时,即使有氧存在,大量乳酸也可积累[7]。
2.2 摇床培养时间对于乳酸发酵的影响[4]
从图2可以看出,摇床培养24h、28h、32h、36h后再静置培养,葡萄糖都可以消耗完全,而且产酸与转化率都差不多,从工业角度,应选用摇床培养24h后再转为静置培养,可减少动力消耗,节省成本,提高乳酸产量。
2.3 先摇床再静置培养乳酸发酵过程中的降糖、产酸及菌体生长曲线
图3为摇床培养24h后再转入静置培养的乳酸整个发酵过程中的糖、酸及菌体生长变化的趋势图。从图中可以看出菌体16h后进入稳定期,葡萄糖含量16h后也迅速下降,进入快速产酸阶段。本条件基本符合乳酸菌的发酵机理,能够实现高产酸,并实现较高的转化率,相对的缩短了发酵周期,减少了能量损耗,降低了生产成本。
2.4 初糖浓度对于乳酸发酵的影响[9,10]
从图4可以看出,随着初糖浓度的增加,乳酸产量提高了,但是转化率却并非如此,所以发酵时,初糖浓度应控制在120~140 g/L。
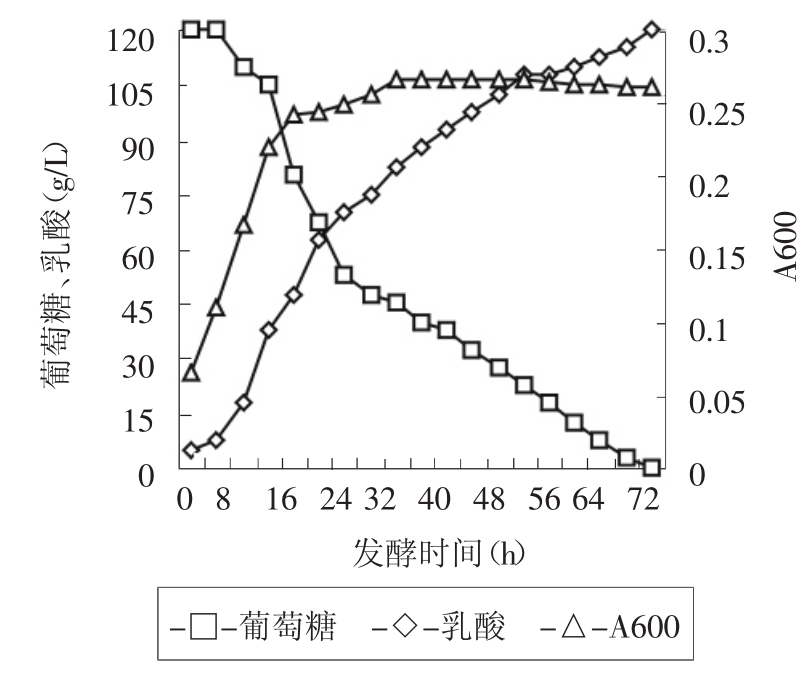
图3 乳酸发酵降糖、产酸及菌体生长曲线
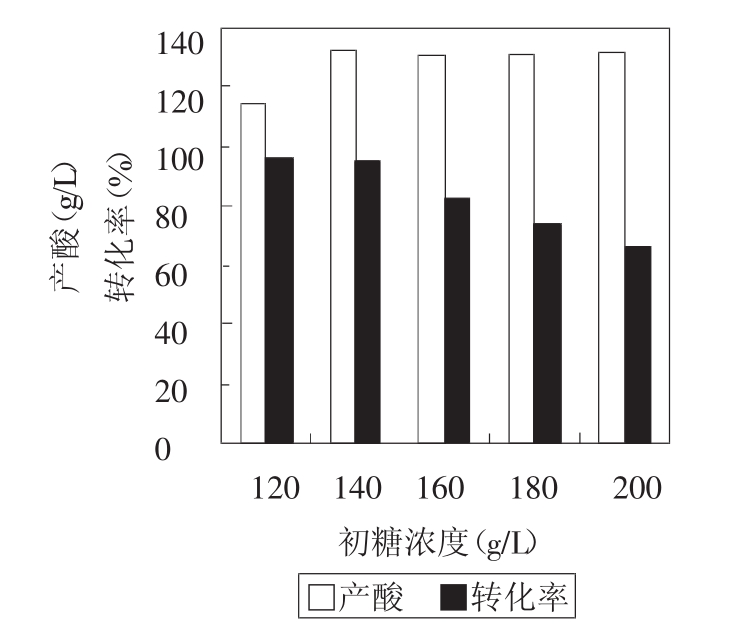
图4 不同初糖浓度乳酸发酵的比较
2.5 响应面分析法优化发酵培养基[4,5,6]
在上述条件下,利用SAS8.01软件对发酵培养基中的三种成分进行优化。通过二次回归的旋转中心结合设计[11,12],对这3个因素进行寻优,以乳酸的产量为响应值,对应于因变量Y。各自变量水平见表1,实验设计及结果见表2。
表1 发酵培养基因素水平编码

表2 实验方案与结果
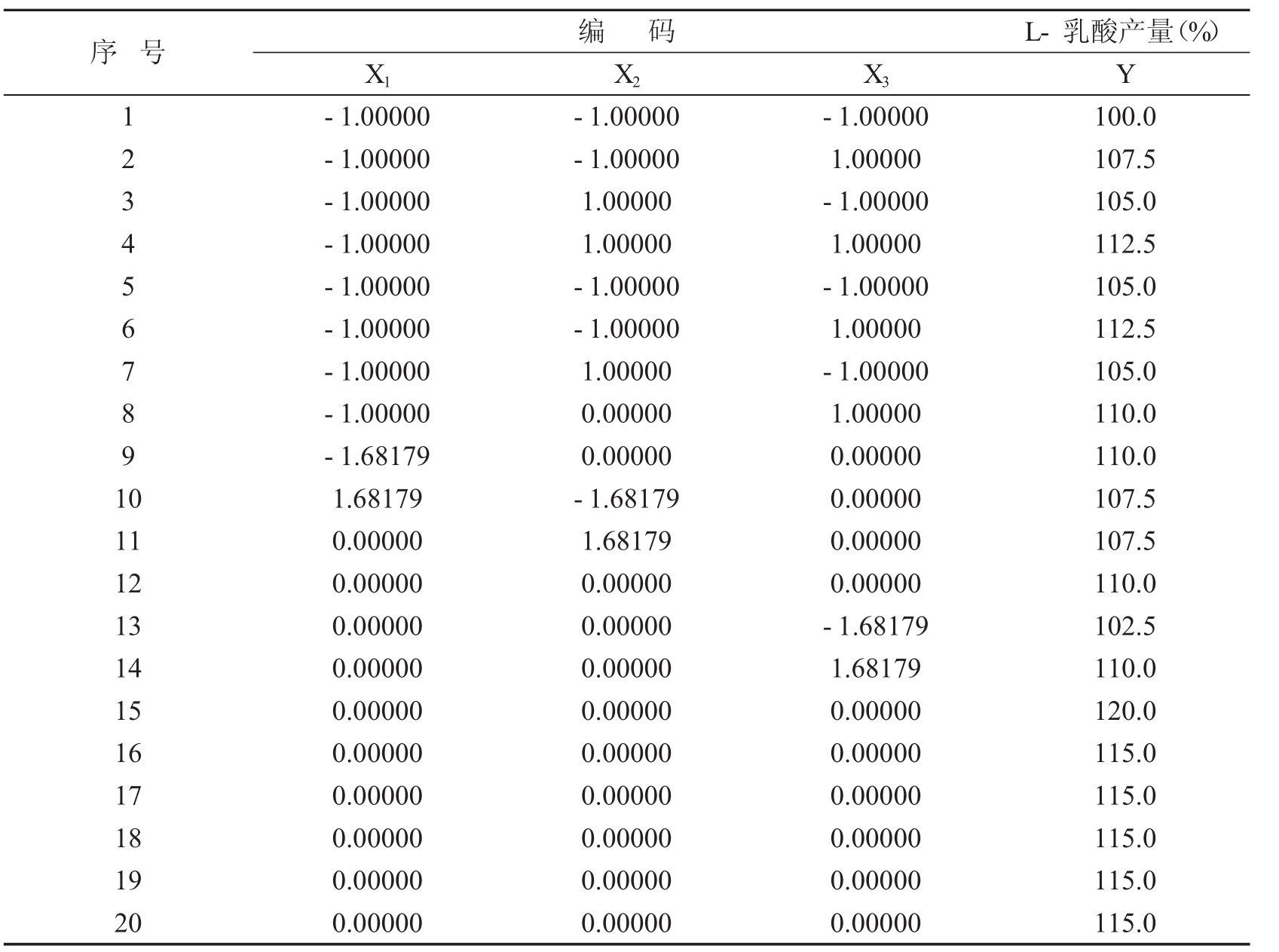
X1= (x1-20) /10; X2= (x2-10) /5; X3= (x3-30) /10;
通过SAS 8.01软件对表2实验数据进行二次多项回归拟合,获得乳酸浓度对蛋白胨、玉米浆和豆粕水解液的二次多项式回归方程为:
Y=115.8414+0.24131X1+0.85704X2+2.93724X3-2.55687X12-1.5625X1X2-0.3125X1X3
-2.55687X22-0.315X2X3-3.44076X32
式中Y为乳酸浓度的预测值,X1、X2、X3分别为蛋白胨、玉米浆和豆粕水解液的编码值。该二次回归方程的方差分析结果见表3。
表3 二次回归方程的方差分析表
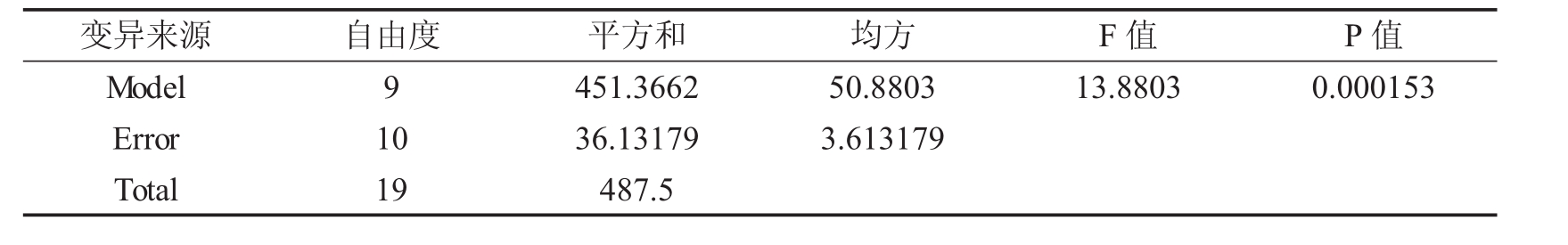
由该方程的方差分析可见,该模型极显著(F=13.8803 > F0.01(9,10) =4.94) ,而且经分析计算,该模型的确定系数R2=92.59% ,表明模型与实际情况拟合很好,能解释92.59%乳酸浓度的变化,因此该模型可用于分析和预测发酵过程中乳酸的产量。
图5至图7为响应面分析的立体图,从图中可直观地看出,各因子对响应值的影响变化趋势。而且回归模型确实存在最大值,求解方程3组成的方程组,可得模型极值点坐标(X1,X2,X3)的代码值为(0.4402 ,0.0020 ,0.4068) ,对应的实际值为:蛋白胨(X1) =24.40;玉米浆(X2) = 10.00;豆粕水解液(X3) = 34.07。此时,模型预测的最大估计值为116.98g/L。为了检验模型预测的准确性,在最佳发酵条件进行发酵实验,所得实际乳酸产量为117.03g/L,可见该模型能较好地预测实际发酵情况。
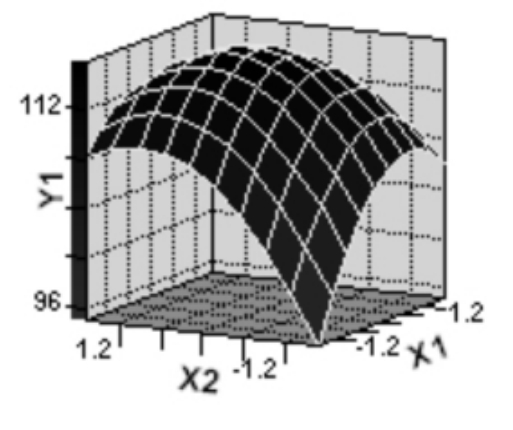
图5 响应面

图6 响应面
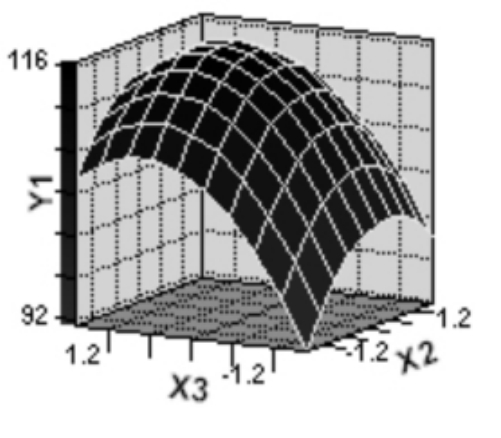
图7 响应面
3 结论
通过对乳酸发酵培养方式及培养基优化得出:先摇床培养24h后转入静置培养,初糖浓度为120~140 g/L时适合TL-2菌的发酵。并在初糖浓度为120g/L时,响应面分析法得到最优的发酵培养基为:豆粕水解液为34.07 g/L,蛋白胨为24.40g/L,玉米浆为10 g/L。在此培养方式及培养基的基础上进行摇瓶发酵,乳酸产量为117.03g/L,转化率为97.53%,液相测得纯度为97.94047%,,而且转化率比优化前的78.95%提高了18.58%。
参考文献:
[1]曹本昌,徐建林,匡群.L-乳酸研究综述[J].食品与发酵工业,1993,3: 56~61
[2]赵鑫,赵良启,谢红.发酵生产L-乳酸的现状与展望.[J].山西化工,2005,25 (1):15~19
[3]乔长晟,汤凤霞,朱晓红.L-乳酸的生产及研究现状.[J].宁夏农学院学报,2001,22 (3):75~79
[4]刘勇军,王昌禄,等.细菌L-乳酸发酵的研究—响应面分析法(RSA)优化培养基及控氧研究[J].食品工业科技,2003,24 (2):41~47
[5]徐子钧,李剑,等.利用SAS软件优化L-乳酸发酵培养基[J].微生物学通报,2004,31 (3):85~87
[6]乐晓洁,王昌禄,等.细菌发酵生产L-乳酸培养基的优化[J].无锡轻工大学学报,2003,22 (6):55~58
[7] [澳]H.W.多伊尔.郭杰炎,汪训明,陈永青,等译.细菌的新陈代谢[M].北京:科学出版社,1983.617~629
[8]李艳,张志民,张永志,等.发酵工业概论[M].北京:中国轻工业出版社,1999.96~99
[9] Hujanen M,Linko S,et al. Optimisation of media and cultivation conditions for L-lactic acid production by Lactobacillus casei NRRL B-441.[J].App-lied Microbiol Biotechnol,2001,56: 126~130
[10] Chang Dong Eun. Homofermentative production of D-orL-lactic acid in metabolically engineered E.coli RR1 [J]. Applied and Environmental Microbiology,1999,65(4):1384~1389
[11] Adinarayana,K. & Ellaiah,P. Response surface optimization of the critical medium components for this production of alkaline protease by a newly isolated Bacillus sp. Journal of Pharmacy an Pharmaceutical Science,2002,5: 272~227
[12] Chakravarti,R. & Sahai,V. Optimization of compactinproduction in chemically defined production medium by Penicilliumcitrinum using statistical methods. Process Biochemistry,2002,38: 481~486
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















