(一)影响灰质和白质的代谢性疾病——线粒体脑病
1. Leigh病 亚急性坏死性脑脊髓病(subacute necrotizing encephalomyelopathy)又称Leigh病,是一种罕见的常染色体隐性遗传性疾病, 与硫胺素先天性代谢紊乱有关,常见于婴幼儿,此病于1951年由Leigh首先报道,故又称Leigh综合征。其主要病理变化为双侧壳核、尾状核、苍白球坏死,小脑、脑干、延髓、脊髓均可累及。临床表现为不明原因的营养不良及肝、胃肠疾病症状,进行性智力衰退及听力障碍,开始可有肢体无力、视力减退(视神经萎缩或皮质盲)、眼球运动障碍、眼震及抽搐等,病情恶化后呈木僵状态,肌强直阵挛,可因球麻痹及呼吸困难而死亡。由于基底节核团是神经细胞代谢活跃的区域, 容易受到能量代谢障碍的影响,所以更容易出现病变。Leigh综合征双侧基底节 (苍白球、尾状核、壳核)、丘脑、中脑被盖,特别是导水管周围出现异常改变,同时可出现脑白质异常和脑萎缩。累及部位以深部灰质核团最多,脑白质次之,而累及深部灰质核团的病灶中,以苍白球、中脑被盖及丘脑多见。

图4-2-5 ALS患者定位于脑干及谱线图NAA降低,Glx升高
[引自:Chan S, Shungu DC, Douglas-Akinwande A, Lange DJ,et al.Motor neuron diseases: comparison of single-voxel proton MR spectroscopy of the motor cortex with MR imaging of the brain. Radiology. 1999, 212(3):763-769]
人脑主要通过有氧代谢提供所需能量,如出现氧化磷酸化异常,则会产生一系列神经系统异常表现。此时无氧代谢增加,使Lac在脑内堆积,同时还可以出现神经元功能障碍而导致NAA减低。线粒体脑病是一种能量代谢异常疾病,1H-MRS能提供重要的诊断信息。 Lac升高是Leigh病最特征的表现, 研究发现1H-MRS发现Lac峰(图4-2-6),提示颅内有氧代谢异常,表明对于线粒体脑病的早期诊断,MRS较为敏感。 同时还发现NAA/Cr减低和 Lac/Cr增高,提示 Leigh综合征患者在苍白球、丘脑存在神经元的减少和胶质细胞增生的病理变化。在苍白球区,Leigh综合征 MRI阴性组与正常对照组之间的Cho/Cr差异有统计学意义。在MRS可以检测到苍白球的Cho/ Cr升高和丘脑的NAA/Cr下降,提示代谢有异常,可以对线粒体脑病进行早期诊断。
2. MELAS(mitochondrial encephalomyopathy with lactic acidosis and stroke)综合征 MELAS综合征由于线粒体结构和功能异常导致呼吸链甚至整个能量代谢发生紊乱的多系统受累性疾病,是家族性疾病,是以线粒体肌病、脑病、乳酸性酸中毒和卒中样发作为特征的。
1H-MRS发现病变部位NAA峰下降和Lac峰升高(图4-2-7),说明存在脑神经元细胞发育不良和Lac堆积。定量分析显示NAA/Cr比值降低,Lac/Cr比值升高。有研究结果认为高大的Lac峰对 MELAS的诊断具有重要参考价值。 MELAS患者Lac升高的机制可能在于线粒体功能障碍导致呼吸链缺陷,病灶区低代谢和继发性低灌注,导致Lac水平持续增加;另外细胞产生的Lac产物和(或)许多异常线粒体经无氧糖酵解, 造成Lac清除率缓慢;ME患者氧化磷酸化功能不足,无氧代谢产生大量Lac;再者,毛细血管和动脉内皮细胞中线粒体异常引起血管损害。因此,1H-MRS谱线出现Lac峰可以作为MELAS的一个特征性表现。尽管1H-MRS谱线出现Lac峰可以作为 MELAS的一个特征性的表现,但是Lac峰亦可出现在其他病理状态下,如早期脑梗死、脑脓肿、脑肿瘤等。通常来说脱髓鞘病和脑肿瘤Cho峰明显升高,而MELAS一般不会出现Cho峰的升高。脑梗死急性期也可发现一过性高大的Lac峰,与MELAS类似,但慢性期Lac峰则完全消失。因此,在临床实际应用中仍需密切结合患者的临床资料、疾病的严重程度以及疾病进展的不同时期进行综合分析。此外,1H-MRS中Lac峰的检出还与采集技术、感兴趣区位置、谱线稳定性等多种因素有关。

图4-2-6 Leigh病患者谱线可见Lac峰
[引自:Sijens PE, Smit GP, Rödiger LA, et al. MR spectroscopy of the brain in Leigh syndrome. Brain Dev. 2008, 30(9):579-583]

图4-2-7 MELAS综合征患者左顶叶NAA明显减低,可见高大的Lac峰
[引自:贺丹,刘怀军,杨丽,等. 扩散成像和磁共振波谱对MELAS诊断价值的初步研究. 放射诊断学, 2011, 19(1): 37-42]
(二)影响基底节的代谢病
1.亨廷顿病 亨廷顿病(Huntington's disease,HD) 是由于基底节神经元大量缺失和胶质增生引起。研究发现HD的1H-MRS中,NAA水平降低,Cho升高。也发现有症状的HD患者枕叶乳酸升高,并随着病程而逐渐增加,并认为与HD患者的氧化磷酸化缺陷有关。超微结构和生化研究发现HD患者有线粒体异常和线粒体酶活性降低,也支持上述观点。所以有研究提出应用1H-MRS测量患者枕叶乳酸水平可监测HD的病情进展和治疗结果。
2. 肝豆状核变性(Wilson病) 肝豆状核变性(hepatolenticular degeneration,HLD)又称威尔逊病,为常染色体隐性遗传的铜代谢障碍疾病。是一种遗传性铜代谢障碍所致的肝硬化和以基底节为主的脑部变性疾病。临床上表现为进行性加重的锥体外系症状、肝硬化、精神症状、肾功能损害及角膜色素环K-F环。本病铜代谢障碍中血清总铜量和铜蓝蛋白减少而疏松结合部分的铜量增多,肝脏排泄铜到胆汁的量减少,尿铜排泄量增加,许多器官和组织中有过量的铜沉积,尤以肝、脑、角膜、肾等处为明显。过度沉积的铜可损害这些器官的组织结构和功能而致病。
HLD的MRS表现为脑部的NAA降低(图4-2-8),NAA减少可能是由于神经损害和线粒体功能失调以及细胞膜的破坏,NAA水解增加而导致NAA减少。关于HLD的MRS表现部分研究报道结果不一,发现病变的基底节 NAA/Cr和 Cho/ Cr与对照正常儿童无差异。也有研究分析HLD组的NAA/Cho和NAA/Cr的均值较对照组低,基底节NAA/Cho和NAA/Cr较对照组降低,认为未经治疗或致死性的HLD患儿较治疗后患儿的NAA/ Cr和Cho/Cr明显降低,同时NAA/Cho比值在双侧基底节差异显著,NAA/Cr和Cho/Cr降低反映神经细胞、细胞膜的破坏、消失,病变基底节区与丘脑区 NAA/Cr和Cho/Cr改变无统计学差异。因此,需要更进一步的研究。
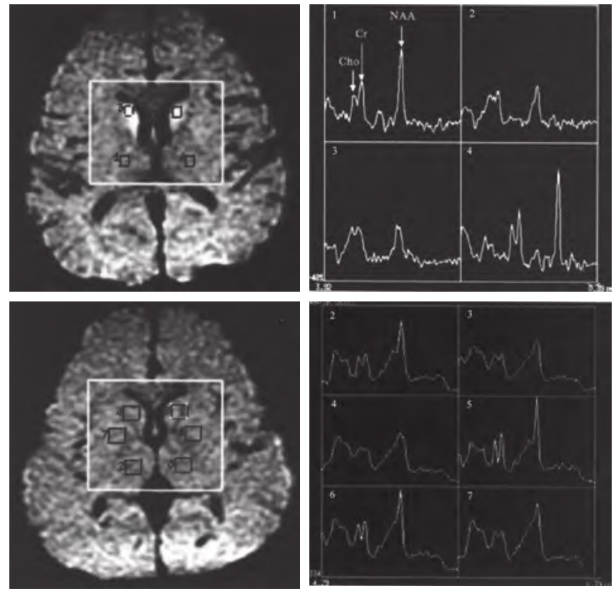
图4-2-8 肝豆状核变性患者谱线,双尾核头和右豆核NAA峰降低
[引自:楼海燕, 漆剑频, 王承缘, 等. MR扩散加权成像和波谱联合应用诊断肝豆状核变性. 中华放射学杂志,2005, 39(2): 136-139]
3. 钴胺素C缺乏症 钴胺素即维生素B12,自然界中的钴胺素都是微生物合成的,钴胺素是惟一的一种需要一种肠道分泌物(内源因子)帮助才能被吸收的维生素。有的人由于肠胃异常,缺乏这种内源因子,即使膳食中来源充足也会患恶性贫血。钴胺素的主要生理功能是参与制造骨髓红细胞,防止恶性贫血;防止大脑神经受到破坏。对此类患者研究较少,1H-MRS仅发现脑部纹状体的NAA和Cr的浓度降低。
4.溶血性尿毒症综合征 溶血性尿毒症综合征的病因未明,该病多见于婴幼儿,部分儿童发病前有发热或病毒性疾病,因此,可能与感染或免疫复合物介导有关。临床表现有发热、血小板减少、微血管性溶血性贫血、高血压和急性肾衰竭,神经系统症状则不常见。但微血管病性溶血和毛细血管损害主要局限在肾脏。在MRI上显示T1WI及T2WI图像上为高信号,病理学研究显示基底节、丘脑和大脑皮质的水肿、缺血及出血,1H-MRS在纹状体显示NAA和MI的浓度下降,MI的浓度下降更为明显。
5. Galloway-Mowat病 Galloway-Mowat病为小头-横膈裂孔疝-肾病症候群(microcephaly,hiatus hernia, and nephrotic syndrome)是一种相当罕见、合并多重器官障碍的常染色体遗传性疾病,患者在外观上有小下巴等特征,合并有脑神经及肠胃道系统功能异常。肾脏方面,因肾小球或肾小管的硬化,造成肾功能的恶化,并可能因此导致肾衰竭而死亡。
常规cMRI可显示脑积水,沿着脑回和移行部的异常表现,大脑内纹状体可显示MRS异常,表现为NAA和Cho的减低,Cho的降低很明显。
6.溶酶体贮积症 溶酶体贮积症(lysosomal storage disorders,LSDs)是一组遗传性代谢性疾病,是由于溶酶体内的酶 (主要是酸性水解酶)、激活蛋白、转运蛋白及溶酶体蛋白加工校正酶的缺乏,引起溶酶体功能缺陷,致使代谢物在组织器官贮积所导致的疾病。可分为三类。
(1)黏多糖贮积症 (mucopolysaccharidosis,MPS):MPS发病主要是不能完全降解的黏多糖在溶酶体中贮积并大量从尿中排出。各型患者大多有面容粗陋、程度不同的骨骼异常及关节活动受限, 多伴角膜浑浊、肝脾大、智力低下、心血管受累。患儿出生时表现正常,病程为慢性进行性。在这组疾病中即使同一种酶的缺陷,其临床表现变异也很大。C型是该病的慢性神经元病类型,是由于外源性胆固醇的细胞内转换缺陷造成的,其在溶酶体中沉积。常规MRI可显示脱髓鞘和角质增生的部位,以及胼胝体发育不良。在1H-MRS中,Lip峰是其特征,也可以检测到NAA的进行性降低。
(2)Gaucher病:是由于溶酶体内β-葡糖苷酶缺乏导致葡糖苷脂代谢障碍引起的临床病症。正常情况下,红细胞、白细胞膜上的降解产物红细胞糖苷脂、红细胞兰糖苷脂、乳糖基酰基鞘氨醇等被巨噬细胞吞噬后,在溶酶体内β-葡糖苷酶催化下转变为葡萄糖及神经酰胺。由于缺乏葡糖苷酶,巨噬细胞摄取过量的葡糖酰鞘氨醇不被代谢而堆集在体内,导致溶酶体酶释放白介素及多种细胞因子,从而改变巨噬细胞的功能,造成局部及邻近组织细胞的损害。这些富含葡糖苷脂的巨噬细胞称为Gaucher细胞,当它们成堆聚集时可造成局部浸润部位血流障碍,多发生在肝、脾、骨骼、中枢神经系统。Gaucher病是常染色体遗传的等位基因性疾病,已发现Gaucher病有至少40多个基因的突变,基因突变型与表现型的关系还不清楚。在1H-MRS中,可显示大脑中MI和Glx水平增高。
(3)黏多糖病:是一组少见的先天性遗传疾病,主要因降解黏多糖(现称糖氨聚糖)所需的溶酶体水解酶的缺陷,致使组织内有大量黏多糖蓄积,造成骨骼发育障碍、肝脾大、智力迟钝和尿中黏多糖类排出增多。因蛋白聚糖降解酶先天性缺陷所引起的蛋白聚糖分解代谢障碍。其特征是过多的寡聚糖堆积与排泄。在MRI未显示明显异常时,1H-MRS可显示患者大脑内的白质NAA/ Cho的下降,MI、Glx及Lip的升高。
7.半乳糖血症 半乳糖血症是人类的一种基因型遗传代谢缺陷,是由于缺乏磷酸半乳糖尿苷酰转移酶,导致婴儿不能代谢奶汁中乳糖分解生成的半乳糖。这是血和尿中半乳糖增多的一种遗传性疾病。主要症状是营养障碍、白内障、智力低下和肝脾大等。该症发生于先天性缺乏半乳糖-1-磷酸尿苷转移酶的人。在1H-MRS表现在新生儿的基底节区可见半乳糖峰,位于MI的左侧,呈双峰状。
8.苯丙酮尿症 苯丙酮尿症(phenylketonuria,PKU)是由于肝脏苯丙氨酸羟化酶(phenylalaninehydroxylase,PAH)缺乏或活性减低而导致苯丙氨酸代谢障碍的一种遗传性疾病。在遗传性氨基酸代谢缺陷疾病中比较常见,本病遗传方式为常染色体隐性遗传。临床表现不一,主要临床特征为智力低下、精神神经症状、湿疹皮肤抓痕征、色素脱失和鼠气味等。1H-MRS表现为在利用短TE时,可以发现代谢峰位于7.36ppm处。
9.丙甲基酸血症 丙甲基酸血症是影响线粒体代谢的氨基酸病,丙甲基辅酶A向琥珀酰辅酶A的转换障碍,导致血及尿中丙甲基酸过量,伴高氨酸血症和酮症酸中毒。患者可表现为呕吐、癫 发作、呼吸急促、代谢性酸中毒、昏迷,甚至死亡。在常规MRI典型表现在苍白球为T1WI及T2WI的异常信号影,1H-MRS表现苍白球可见Lac峰的升高。
发作、呼吸急促、代谢性酸中毒、昏迷,甚至死亡。在常规MRI典型表现在苍白球为T1WI及T2WI的异常信号影,1H-MRS表现苍白球可见Lac峰的升高。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















