任务3 病毒的鉴定技术
一、病毒蚀斑技术
(一)概述
病毒蚀斑(又称为空斑)如同噬菌体的噬斑,一个蚀斑为一个病毒体的繁殖后代品系。在细胞培养中,蚀斑技术是一种较精确地测定病毒感染力的方法,将各稀释度病毒接种入单层细胞瓶,吸附1h后,在单层细胞上覆以营养琼脂培养基,病毒在细胞中繁殖使细胞死亡。但由于琼脂的限制,只能感染邻近的细胞,形成“蚀斑”的退化细胞区,经中性红染料着色后,活细胞显红色,而蚀斑区细胞已退化不着色,形成不染色区域。凡是能在细胞培养物中产生细胞死亡现象的病毒都可采用蚀斑技术来分离和测定。病毒蚀斑如图2-7所示。
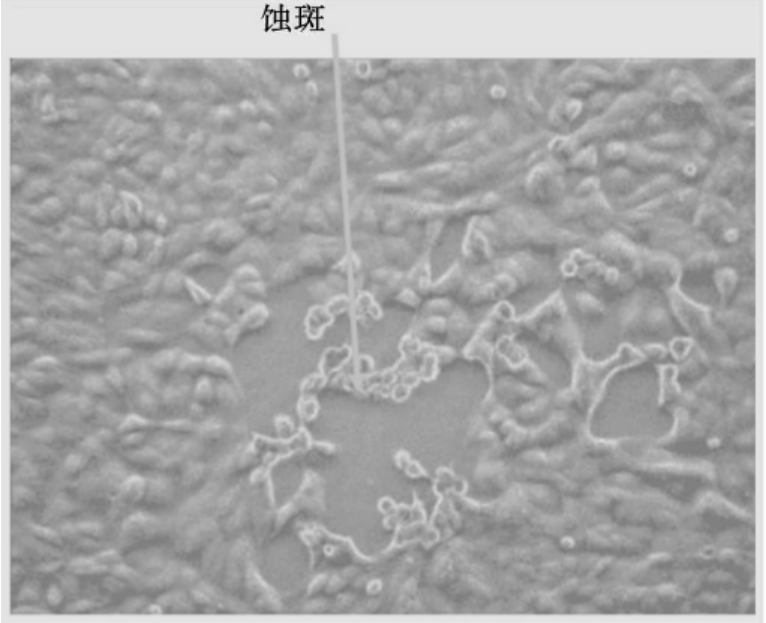
图2-7 病毒蚀斑
蚀斑技术在测定病毒感染时是很好的定量方法,也是测定干扰素和抗体中和病毒繁殖能力的一种非常敏感的方法。此外,还可以用来纯化病毒,纯化时挑选合适的蚀斑进行传代即可。若目的是要提高病毒毒力,应选大蚀斑;若是为了减毒以制备疫苗,应挑选小蚀斑,但每瓶蚀斑数目以不超过40个为宜。
试验时,应翻转培养瓶进行培养,以免水滴在琼脂面流动导致各个蚀斑交叉融合,应在蚀斑出现前加入中性红,在暗处培养,以防止染料抑制病毒和破坏细胞。对那些生长较慢的病毒蚀斑,中性红则不是加在最初的覆盖层里,而是加在经过几天培养后的最后一层覆盖层上,可使培养物维持更久,甚至有的中间还得补加营养琼脂覆盖层1~2次。
蚀斑使用的琼脂往往含有少量抑制物而影响蚀斑的产生,应将琼脂用单蒸水浸泡过夜,再用单蒸水冲洗2~3次,然后用去离子水冲洗1~2次,用Hank′s液配制成3%浓度,煮沸1h除菌备用。
有人在试验时补加25mmol/L的MgCl2或CaCl2及1mmol/L半胱氨酸,可加强肠道病毒形成蚀斑的能力,而MgCl2的加强作用最明显。
(二)蚀斑技术举例
1.虫媒病毒在鸡胚纤维母细胞中的蚀斑
(1)选择经24~48h培养的4×109个/L鸡胚细胞若干瓶。
(2)将细胞培养瓶按病毒稀释度分组,每个稀释度为2~3瓶,对照组为2~3瓶。
(3)配制含2%~5%小牛血清的0.5%水解乳蛋白的Hank′s(LH)稀释液(维持液)100mL:
0.2%或0.5%LH 97mL(也可用Eagle MEM或199、RPMI1640培养基)
灭活小牛血清 2mL
双抗(指青霉素和链霉素,2万单位/mL) 1mL,调pH值至7.4~7.6
(4)在冰浴盘内用上述稀释液将病毒作一系列稀释,如图2-8所示。
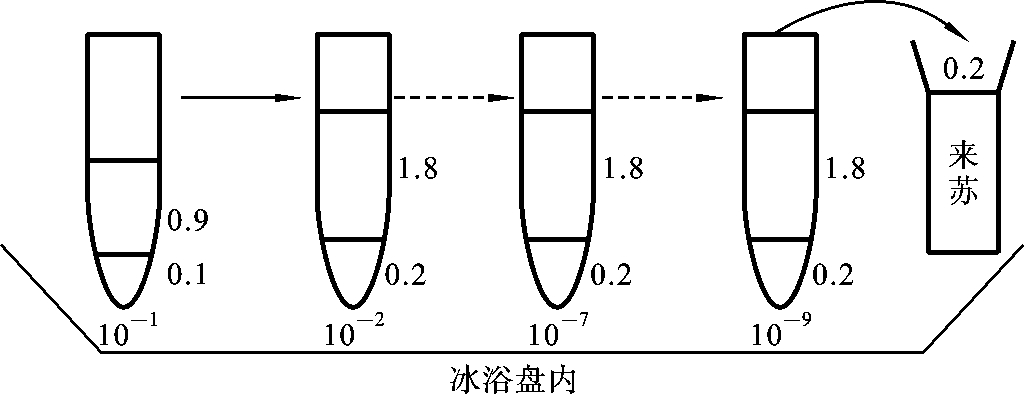
图2-8 稀释示意图
(5)用Hank′s液(pH值约7.8)洗涤细胞层约3min(轻洗,勿使细胞脱落)。
(6)将各稀释度病毒接种于两瓶细胞,每瓶接种0.5mL(小方瓶)或1mL(大方瓶)病毒,轻轻摇匀。
(7)置于37℃培养箱吸附1h(中间摇动一次),切勿倒置。
(8)加含培养基的熔化琼脂,每小瓶加5mL,每大瓶加10mL,控制温度在45~50℃时加入,以防凝固。
培养基琼脂配制法:
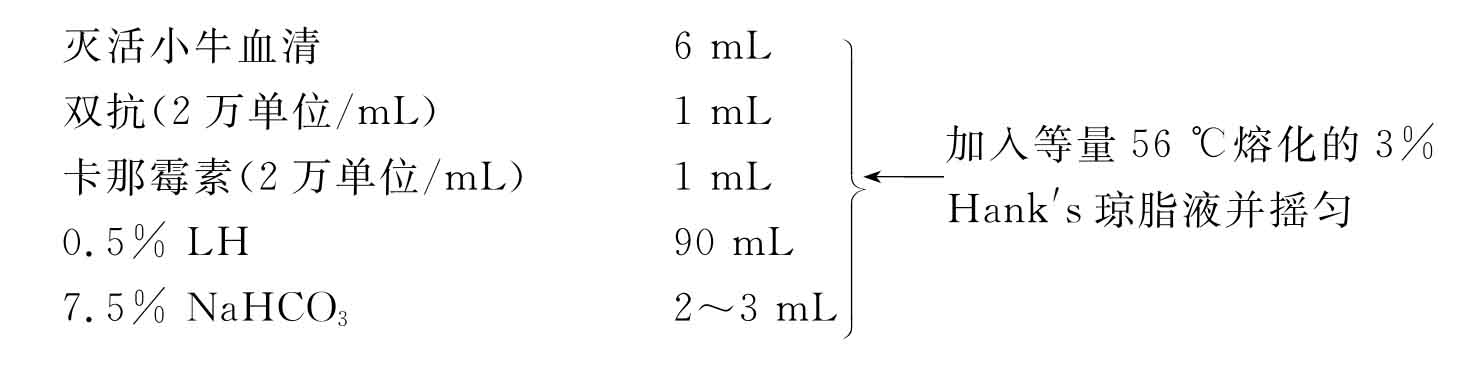
(9)冷凝后将各瓶琼脂层朝上,37℃下培养24h(注意勿倒置)。
(10)于每瓶中加入0.2%中性红,小瓶加入0.25mL,大瓶加入0.5mL,摇匀,37℃下培养4h后将培养物朝上继续培养。
注:①若需保存蚀斑,可于每瓶中加入3%氯化汞溶液0.5mL并摄影记录。
②A组虫媒病毒培养24h,B组虫媒病毒培养72h,观察结果。
③病毒蚀斑形成单位(pfu)计算法。
蚀斑出现时,作第一次观察,记录蚀斑数,于次日进行第二次观察,蚀斑数以每瓶10~50个为宜。

计算方法举例:如果10-7病毒液的蚀斑数一瓶为31,另一瓶为27,每瓶中各加病毒液的量是0.5mL,因此两瓶共有蚀斑数为58,代入公式即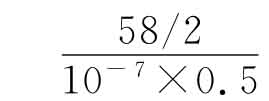 =58×107=5.8×108,查对数表为8.77(即效价为8.77Lg pfu/mL)
=58×107=5.8×108,查对数表为8.77(即效价为8.77Lg pfu/mL)
注:①稀释时每个稀释度均应换取新吸管将病毒来回吹打三次(或轻轻振摇,混匀),当加至各细胞培养瓶时应加至无细胞层的瓶壁侧底角,然后倾斜并来回摇动,使病毒与细胞均匀接种。
②加中性红时也应倾斜,轻摇,使中性红均匀覆盖染色整个琼脂表面,然后将瓶子翻转培养。培养液可用Eagle或RPMI1640替代0.5%HL。
2.用传代细胞系培养皿法检查蚀斑
(1)将单层细胞(2×109个/L,6mL)置于60mL培养皿中培养,生长液为10%小牛血清加89%水解乳蛋白-酵母浸液培养液,加双抗并调pH值至7.2。
(2)将培养物置于潮湿的5%CO2培养箱中,于36~37℃培养成单层,除去生长液,用Hank′s液洗一次。
(3)每皿加各稀释度病毒0.1mL或0.2mL,轻轻摇匀,使之均匀分布于整个细胞层,CO2培养箱中吸附90min后,加营养覆盖琼脂。
(4)将双倍营养覆盖层溶液与等量的1%琼脂的水溶液(已熔化)混合,维持在45~50℃下防凝,每皿8mL。
双倍营养覆盖层溶液配制法:
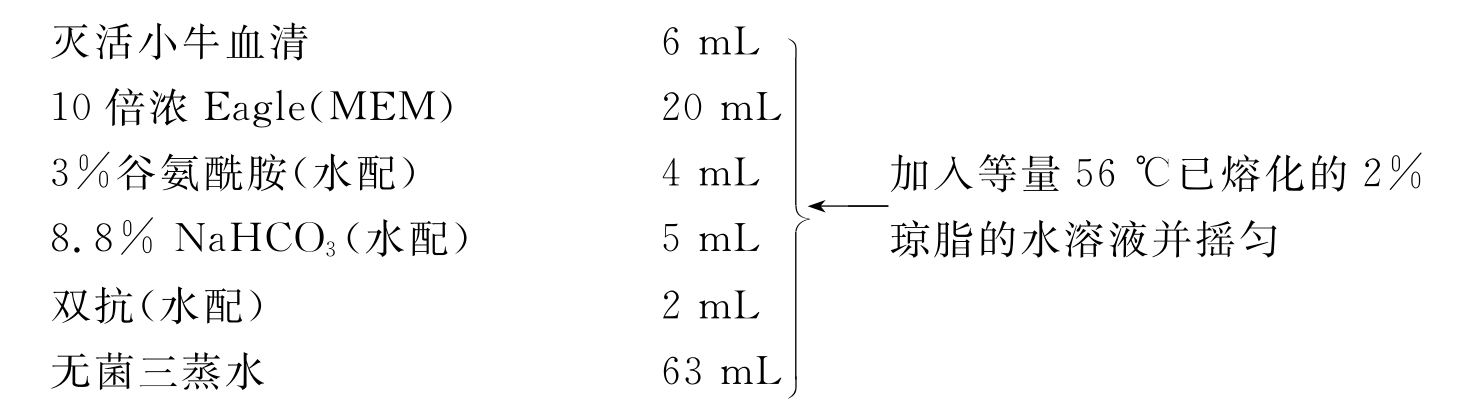
(5)冷凝后翻转培养皿,CO2培养箱中培养4~5d后再加入1mL营养琼脂覆盖层溶液。
(6)继续培养,于第5~8天(依病毒而定)加入0.01%过滤中性红,检查蚀斑情况。
3.在塑料板孔内做病毒蚀斑
(1)备好塑料板(96孔或24孔),若用旧板,洗净后浸于95%酒精中5min,再用紫外线照射2~4h备用,新板可直接使用。
(2)将传代细胞系经胰蛋白酶消化分散后,用含5%小牛血清的95%的199(或Eagle)培养液将细胞配成2.4×109个/L。
(3)按96孔板中每孔0.1mL细胞量,24孔板中每孔0.5mL细胞量,在CO2培养箱中培养24~48h,直至形成单层。
(4)除去生长液,每孔加入0.05mL不同稀释度病毒,然后将此板于33℃吸附1h。
(5)按下述方法制备双倍营养覆盖层溶液,与等量已熔化的2%琼脂的水溶液混匀,并维持在45~50℃防凝。
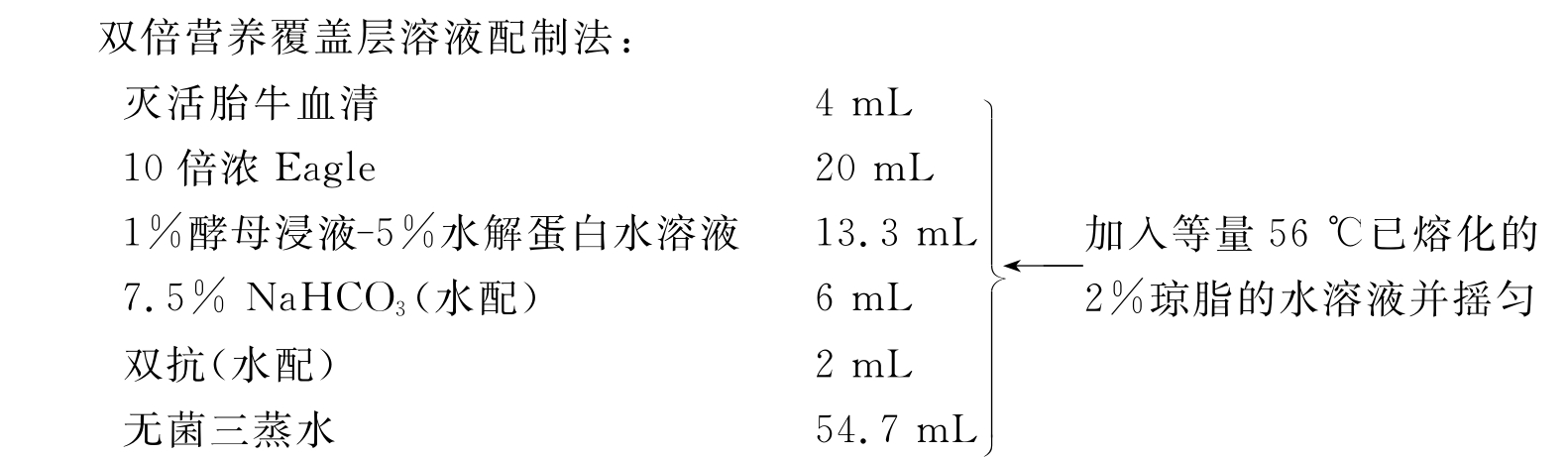
(6)在45~50℃下每孔加0.1mL熔化的营养琼脂覆盖层溶液,待冷凝后于CO2培养箱内培养。1~5d后再加第二层染色覆盖层(依病毒种类而定),其中含有1∶25000的中性红,继续于暗处培养,定期检查蚀斑情况。
二、病毒蚀斑抑制试验
一般来说,凡是抵抗力强、容易控制蚀斑效价的病毒(如少数虫媒病毒和肠道病毒等)皆可用“固定病毒,稀释血清”的方法进行,反之,凡是抵抗力弱、不易控制蚀斑效价的病毒(如大多数虫媒病毒等)皆可改用“固定血清,稀释病毒”的方法进行。
1.固定病毒稀释血清法
(1)选择每瓶能出50~100个蚀斑量的病毒*。
(2)按2、4或10倍稀释法分别将正常血清和免疫血清作一系列稀释**。
(3)将病毒分别与不同稀释度的正常血清和免疫血清等量混合,并于37℃水浴作用1h。
(4)分别取两组混合物0.5mL,接种于生长良好的单层细胞,每个稀释度接种2~3瓶,37℃吸附1h后,覆盖营养琼脂。
注:*取正常血清将病毒稀释至所需蚀斑单位。
**血清可用维持液稀释,并经56℃灭活30min。
(5)培养适当时间后(培养时间视不同病毒而定),加中性红染液,继续在37℃培养4 min,每天观察结果,直至蚀斑出齐。
(6)判定结果:与对照组相比,凡能抑制蚀斑形成数80%以上的抗血清稀释度为最高效价,一般认为抑制蚀斑数80%~100%者为阳性,70%~79%者为可疑,69%以下者为阴性。
2.固定血清稀释病毒法
(1)分别将正常血清与免疫血清用维持液稀释成1∶5(不灭活),按10倍稀释法将病毒作一系列稀释(冰浴内进行)。
(2)先将血清按每管1mL分装于一系列无菌试管中,再分别取不同稀释度的病毒液5mL与血清混合,并于室温下作用1h。
(3)分别将两组混合物按每瓶0.5mL感染生长良好的单层细胞,每个稀释度2~3瓶,37℃吸附1h后,覆盖营养琼脂,培养24h后加中性红染色,继续培养4h后观察结果,以后每天观察结果,直至蚀斑数稳定为止。
对照组蚀斑效价减去实验组蚀斑效价即为抗血清中和指数。
三、细胞培养系统中的中和试验
(一)概述
在细胞培养中进行中和试验可用于病毒实验室诊断。首先,从患者中分离的病毒可用已知特异免疫血清来中和,抑制细胞培养上的CPE或蚀斑形成等能力,有助于鉴定病毒;其次,患者的急性和恢复期血清中抗该病毒的抗体明显升高,可作为此病毒患者的诊断依据。
在细胞培养中测定中和抗体含量,一般是将血清作一系列稀释,然而加入定量(通常是100TCID50)病毒,即病毒定量-血清变量法,相反用定量稀释的血清来中和各个不同稀释度病毒的方法,即在血清定量-病毒变量法中,抗体的效价以能中和上述剂量病毒的最高稀释倍数来表示。中和试验也可用于干扰素抗病毒效应和效价测定。
(二)中和试验举例
1.试管单层细胞中和抗体的测定
(1)已知免疫血清与未知血清经56℃灭活30min,破坏不耐热的非特异性病毒抑制物。
(2)用维持液将血清作一系列稀释,用100TCID50的病毒稀释液分别与各稀释度血清等量混合,其量依接种培养物的管数而定。同时也应将病毒液与等量的稀释液混合,作为病毒对照,均放在相同条件下培养(依病毒而定)。
(3)培养后的血清-病毒混合物及病毒对照均按照每管0.2mL,每个稀释度2管进行接种。
(4)接种的培养物应培养于该病毒的最适生长条件中,定期检查CPE或血吸附的情况等,以测定血清对病毒的抑制能力。
2.单层细胞微量中和试验
微量中和试验已用于多种病毒,采用微量96孔板。有的是先在各孔内培养细胞,然后接种病毒-血清混合物。为方便起见,细胞、病毒、血清可同时接种,这样未经中和的病毒使细胞退化,最后不形成单层;相反,若孔中无病毒或病毒已被中和,则经过一段时间培养后可形成单层,此板需在37℃5%CO2培养箱中培养,检查时用倒置显微镜观察。
(1)试验血清需经56℃灭活30min,使用微量加样器作递倍稀释,稀释液与维持液相同,即98%Eagle(MEM)、2%小牛血清,再加双抗1mL,pH值为7.2~7.4。每孔0.025mL。
(2)将病毒稀释至100TCID50的浓度,取0.05mL病毒加入血清各稀释度孔内,血清-病毒混合物于室温下结合30min。
(3)同时将Hep-2细胞或相应敏感细胞稀释成3×109个/L~5×109个/L,其稀释液用90%Eagle(MEM)、10%小牛血清配制,各孔加0.025mL,细胞对照各孔加0.025mL稀释液和0.025mL细胞悬液,另外设血清对照和病毒对照。
(4)置于35℃CO2培养箱内培养。
(5)经48h培养后,无病毒或病毒被中和的各孔细胞可形成单层,而病毒未被中和的各孔和病毒对照孔的细胞则退化,用倒置显微镜观察结果。
注:若测定黏液病毒中和作用,则采用血吸附抑制试验,方法基本同上,只是细胞、病毒、血清混合培养4~6d后用23号针头吸去各孔上清液,并小心地用0.25mL生理盐水洗涤后,在每孔中加入0.05mL 0.5%的鼠红细胞(用生理盐水稀释),用胶带封盖,于4℃作用30min,检查板孔,确认所有孔均已封牢,然后将微量板翻转,使未被吸附的红细胞从细胞层上流下,而吸附于病毒感染的细胞上的红细胞仍附着于其上,用光学显微镜查血吸附结果,若发生血吸附抑制,则表明血清有中和作用。
3.代谢抑制(色变)中和试验
代谢抑制试验近年来逐渐趋向采用微量法,以节约材料和时间。下述两方法可作为代谢抑制试验的例子,第一法适用于迅速产生CPE的病毒,第二法即“两段法(two phase system)”,则适用于使细胞发生缓慢退化的病毒(如Reo病毒)。
(1)测定肠道病毒。
一般来说,肠道病毒在灵长类上皮样细胞上生长最好。测定时采用微量滴定板,具体方法如下。
①先灭活血清,然后用代谢培养基以0.05mL微量加样器作倍比稀释,从1∶8到1∶1024,每组测试一种病毒。同时取1∶8~1∶32各稀释度血清(不加病毒)作血清对照,以测定血清对细胞有无毒性。
②各稀释度血清内加入用代谢培养液稀释至100~300TCID50的病毒悬液0.05mL。
③将细胞配成1×109个/L细胞悬液,各血清-病毒混合物、血清对照及病毒对照孔内都接种0.05mL细胞悬液(含5000个细胞)。
④细胞对照:四个孔内各加0.05mL培养液及0.1mL细胞悬液(其中含10000个细胞),另四个孔内各加0.1mL培养液、0.05mL 1∶2稀释的细胞悬液(其中含2500个细胞),另四个孔内各加0.1mL培养液及0.05mL 1∶4稀释的细胞悬液(其中含1250个细胞),对照组含细胞量分别为试验组的2倍、1倍、1/2、1/4。
观察结果时含10000个及5000个细胞的各孔培养液pH值应为6.8~7.0,含有2500个细胞的孔中培养液pH值应为7.2~7.6,含1250个细胞的孔中培养液pH值应为8.0。相应各孔内pH值高于上述值,则说明所用细胞数过少或细胞代谢过慢;若pH值低于上述值,则说明加入细胞过多。
⑤各孔内加入0.1mL无菌矿物油,用胶带封盖并确保封紧,于36~37℃培养6~8d。
⑥培养到期后,观察其颜色,pH值为7.4或高于7.4说明有病毒繁殖,而pH值为7.2或低于7.2则表明没有病毒繁殖(病毒滴定时),或已发生病毒的特异性中和作用(测定抗体时)。细胞对照的pH值应同上述。
(2)测定Reo病毒。
此法即“两段法”代谢抑制试验,在细胞代谢引起pH值改变不大的情况下可使用本法,通常用于测定生长缓慢的病毒,该病毒不能在宿主细胞本身改变pH值前表现其代谢抑制作用,为此应分两段进行。第一段方法同上,第二段是在第一段的基础上,各孔再加入0.05mL培养液以维持宿主细胞本身的pH值,使病毒仍能继续生长繁殖,直至产生代谢抑制现象,判定方法与上述相同。
用于病毒中和试验的抗原不需很纯,但是其感染性病毒与非感染性病毒的比值应高。因后者可结合抗体,感染效价高,这样经稀释后,即可除去大多数宿主材料及非感染性病毒。所以用于中和试验的病毒,其最适培养条件应能获得最大量感染性病毒。处理和保存中也应注意,使其不致失去感染性。
血凝抗原应具有足够高的效价,使在稀释后,尚有4或8个抗原单位。重要的问题在于维持液中的血清不得含有病毒血凝的非特异性抑制物。此外,该血清中也不得含有试验血凝系统中红血球的血凝素。维持液血清经白陶土处理或用不含血清的维持液,则可解决非特异性抑制物的问题,有时感染的组织培养液用氟碳化合物处理,可使其中的血凝素“暴露”出来,有些病毒抗原的血凝效价也可通过反复冻熔,超声波或Tween-80、乙醚处理而提高。
一般认为,补体结合抗原应有适当效价,不含宿主物质(因中和试验血清一起结合补体),不得有抗补体作用。
用于沉淀反应的病毒抗原应为高度浓缩者,这样才能与特异抗体形成可见沉淀线。通常使用物理和化学方法进行浓缩,但其原始材料应具有高效价。
在浓缩提纯病毒抗原时,应避免采用可使蛋白质变性的理化方法处理,否则将改变其抗原特性,此点甚为重要。
知识拓展
通过细胞培养分离得到的病毒,必须通过全面了解其特性才能得到鉴定。
(1)根据临床特点、流行病学资料、标本来源,可大致了解病毒的一些特性,有助于确认病毒的种类;
(2)注意观察动物感染范围及特点,病毒感染动物的范围、发病的潜伏期有差异,影响因素较大,应具体分析;
(3)注意观察细胞培养的特点,如细胞变化、中和试验、蚀斑形成试验等。
思考题
1.病毒的鉴定方法有哪些?
2.什么叫病毒蚀斑?简述病毒蚀斑技术的操作过程。
3.简述病毒中和试验的原理。
4.简述病毒蚀斑技术的原理。蚀斑技术的应用及试验时的注意事项有哪些?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














