1 胎盘的解剖
胎盘由两部分组成,大部分为胎儿部分(亦称绒毛小叶),小部分为母体部分(亦称底蜕膜)。
1.1 胎盘的胎儿部分
受精卵在受精后3~4天发育形成一个固体桑葚样的细胞球,称为桑葚胚。桑葚胚中卵裂球之间的液体逐渐积累形成囊胚。第6~7天囊胚着床,囊胚一极的实体细胞球——即内细胞群最终形成胚胎,外层细胞群形成滋养层。受精后第2周的后两天出现原始绒毛干。随着种植部位的原始绒毛干的发育、增殖,细胞滋养细胞扩展到达子宫内膜,绒毛外滋养层最终形成锚定于底蜕膜的细胞滋养细胞。到第3周时,进入绒毛阶段,胚胎3胚层形成,母体静脉窦在着床早期打开,但到受精后14天或15天,母体动脉血才进入绒毛间隙,到17天左右,胎儿血管开始有功能,胎盘循环建立。胎儿胎盘循环在胚胎血管与绒毛血管连接后完成,并形成动脉毛细血管静脉网,母儿间物质交换开始发生。第4周到第16周胎盘形成。干绒毛进一步呈网状生长,与底蜕膜相关联的绒毛数量迅速增加,分支增殖形成胎盘结构的胎儿部分。绒毛表面积持续增加至足月,但34~36周后增长率逐渐下降。妊娠足月胎盘的绒毛表面积达12~14m2,相当于成人肠道总面积。总之,在妊娠进展中,胎盘经历了以下改变:①细胞滋养细胞在约12周时停止形成。②绒毛间结缔组织逐渐减少。③胎儿毛细血管数量增加,直径减小。④部分胎儿毛细血管与合体滋养层“融合”形成血管合体膜(VSM),有利于气体及物质交换。
1.1.1 绒毛形态
人类胎盘中有3种形态的绒毛。从绒毛膜板伸出的绒毛干逐渐分支,形成初级绒毛干、次级绒毛干和三级绒毛干,向绒毛间隙伸展形成终末绒毛网。绒毛末端悬浮于充满母血的绒毛间隙中称游离绒毛,长入底蜕膜中的称固定绒毛。一个初级绒毛干及其分支形成一个胎儿叶,一个次级绒毛干及其分支形成一个胎儿小叶。一个胎儿叶包括几个胎儿小叶,每个胎盘有60~80个胎儿叶,200个胎儿小叶。初级绒毛干机械性支持绒毛树,含有血管,可在光镜下识别。它高度分支向边缘发育产生小的干绒毛,称中间绒毛或次级绒毛。次级绒毛位于干绒毛与终末绒毛之间,分两类:①成熟绒毛:在成熟胎盘中,逐渐变细并产生大量终末绒毛。②不成熟绒毛:绒毛较粗大,分化出较少的终末绒毛,这也是终末绒毛发育不完全的原因。终末绒毛也称三级绒毛,绒毛树的终末分支,三级绒毛小叶出现的同时,胚胎也开始血管化,此部位也是母儿气体及物质交换的场所,见图2-1。
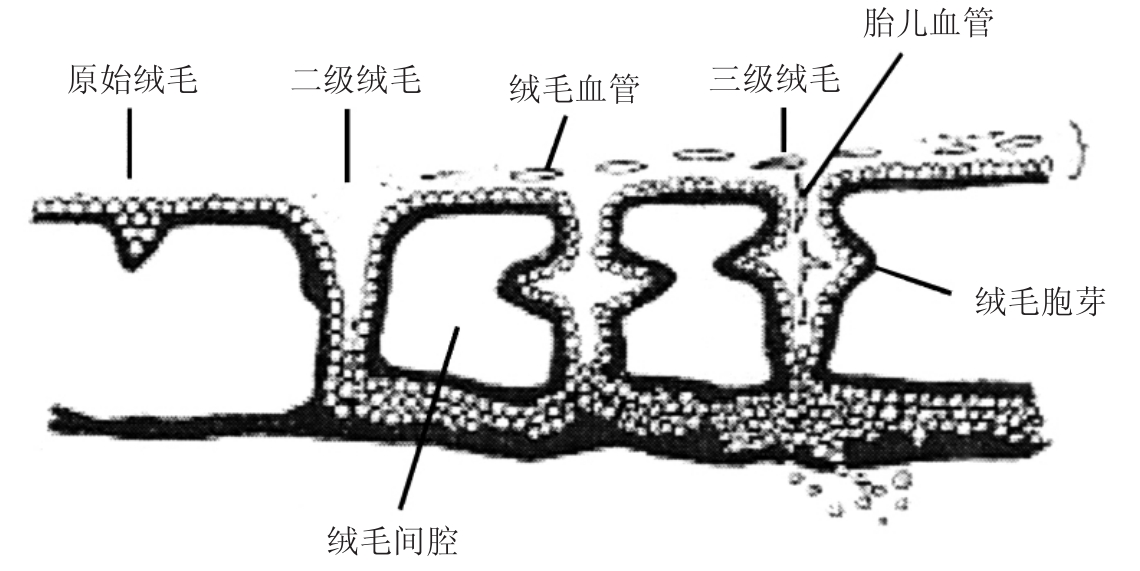
图2-1 胎盘早期发育
1.1.2 绒毛发育过程
绒毛发育分三个阶段。妊娠早期:此阶段的绒毛数量少,形态大(直径约170μm)。它含有疏松基质及两层规则的滋养细胞。外层为合体细胞,它来自内层的郎罕氏细胞滋养细胞层。细胞滋养细胞呈立方、多角或卵圆形。细胞界限清楚,胞浆透明,呈颗粒状,微嗜碱。核圆浅染,核分裂活跃,核分裂可延续到足月妊娠前。合体滋养细胞核小而深染,嗜酸性,胞核之间无细胞界限而呈多核合体状。在合体细胞内,从未见过有丝分裂象。DNA合成也只见于细胞滋养细胞核内,这些都表明,合体滋养细胞是从它的前身——细胞滋养细胞经过中间性细胞过渡而来。合体滋养细胞是由细胞滋养细胞分裂后的子细胞融合而成。细胞滋养细胞是合体滋养细胞的干细胞。妊娠初期绒毛内无血管。绒毛内血管出现的时间变异较大,到妊娠第二个月末,绒毛间质中央可见小血管。在这个阶段绒毛内的毛细血管细小,且位于中心。随着妊娠进展及胎盘的发育过程,新的终末绒毛形成。它来自滋养细胞、胞芽(SP)形成、基质及胎儿毛细血管的入侵。终末绒毛数量越来越多,直径越来越小。妊娠中期:绒毛数目增多,体积变小,孕中期时绒毛直径70μm,细胞滋养细胞不如早期明显。合体滋养细胞层变薄,不规则。绒毛血管明显,轻度扩张,内皮细胞已成熟呈扁平状,有的血管位于绒毛中央。妊娠晚期:成熟胎盘的绒毛直径大约40μm,滋养层厚薄不均。许多绒毛仍可见细胞滋养细胞,但它们数目减少,渐呈扁平形,位于合体细胞及基底膜之间。妊娠足月时,只有20%的合体滋养层下区域存在细胞滋养层细胞。当细胞滋养细胞的融合超过合体滋养细胞的生长需要时,老化部分的合体滋养层细胞核便会聚集,并突出合体滋养层细胞,形成合体结节结构。在病理情况下,合体结节明显增加,认为与缺氧有关。合体滋养细胞层覆盖在绒毛小叶表面和绒毛膜板的内侧面,直接与母体血液相接触,为母体血液与胎儿血液物质交换的前沿。整个合体滋养层是一个多核、没有细胞界限的合胞体,表面几乎完全被微绒毛所覆盖,大大增加了与母体血液接触面积。微绒毛含有多种多糖成分和表面酶,如碱性磷酸酶、半乳糖转移酶、α-淀粉酶、Ca2+-ATP酶、环核苷酸磷脂酶和5-核苷酸酶等。表面酶可能与合体滋养细胞的转运功能有关。此外,微绒毛膜还存在许多激素和生长因子的受体,如胰岛素、胰岛素样生长因子等。由外向内,合体滋养层可分为3个功能不同的亚区:①吸收区:面向绒毛小叶间隙,此区含有大量与囊泡摄取有关的细胞器和细胞骨架蛋白。②分泌区:位于吸收区与基底区之间,含有大量的线粒体、内质网、高尔基复合体、溶菌酶,合体滋养层细胞的细胞核位于此区。此区与合体滋养层的分泌功能有关。③基底区:位于合体滋养层的底部,与细胞滋养层相邻,此区所含的细胞器与细胞滋养层类似[3]。在有些部位,胎儿毛细血管与周围的合体细胞无核区融合形成窦状扩张构成血管合体膜(VSM)。在光镜下,看起来似乎血管壁与合体细胞融合,但在电镜下,两者并不融合。
1.1.3 胎儿血液循环
胚胎15天初级绒毛形成,20天形成动脉、毛细血管、静脉网,23天开始血液循环。至受精后5周,完整的胎儿-胎盘血液循环系统完全建立。胎盘绒毛干血管:随着妊娠进展,绒毛分支,胎儿绒毛干血管发育,干动脉进入绒毛中间。第10周脐血管进入二级绒毛,第14~20周时,脐血管随三级绒毛继续分支发育,形成终末绒毛及终末绒毛内的毛细血管。在已有的文献中,对正常妊娠胎盘中三级绒毛干动脉数量的研究没有统一的记载。Giles等[4]首先研究了胎儿Um A FVW与胎盘血管床阻力之间的病理联系。并对胎盘取样镜检,计算胎盘中的三级绒毛干数以及三级绒毛干内的小动脉数。结果显示,胎盘中的三级绒毛干数在正常妊娠及病理性妊娠中没有差异,胎盘三级绒毛干中的肌性小动脉数正常妊娠时平均7~8个/低倍(×100),而在病理性妊娠伴有胎儿Um A FVW阻力增高时胎盘三级绒毛干中的肌性小动脉数只有1~2个/低倍视野。因此提出三级绒毛干肌性小动脉数量减少是胎盘血管病变的一个特征,与Um A FVW关系密切。另一组研究[5]通过对正常妊娠胎盘三级绒毛干动脉形态及数量的分类计量观察结果表明,正常妊娠时,三级绒毛干动脉总数形态计量结果为:三级绒毛干动脉总数为2.75个/低倍视野,结构正常动脉2.2个/低倍视野(图2-2),其他为厚壁动脉及闭锁动脉。绒毛毛细血管及血管合体膜:每个绒毛干中均有2根脐动脉和1根脐静脉。随着妊娠的进行,绒毛干一再分支,绒毛内脐血管逐渐变细小,最终在绒毛末端形成毛细血管。胎儿毛细血管在绒毛切面中占据的比例逐渐增加,并从绒毛中心位置逐渐向绒毛周边移动。在孕中期至孕足月时,终末绒毛直径为40~60μm,形态规则,横切面多呈圆形或椭圆形,分布均匀。每个绒毛含1~6个毛细血管,每个血管内含不足10个红细胞。毛细血管从绒毛中心位置移向极接近合体细胞层,在有些部位,胎儿毛细血管与周围的合体细胞无核区融合形成窦状扩张构成血管合体膜(VSM)(图2-3)。绒毛小叶变窄,使得胎儿血管与小叶表面的合体滋养层的距离变小。至足月时,母体血至胎儿血之间的扩散距离已由妊娠中期的50~100μm缩减为4~5μm,更有利于母儿间的物质交换[3]。

图2-2 此图为正常妊娠胎盘中的三级绒毛横切面(10×,HE)
在1个绒毛内可见2根脐动脉和1根脐静脉,其中脐动脉中层平滑肌<4层管腔规则,较为明显。
正常妊娠胎盘中含VSM绒毛占35.12%[5],而VSM面积决定母儿间气体及物质交换能力。这一直被认为是母儿气体及物质交换的重要部位。足月时,绒毛含有大量窦状扩张的胎儿毛细血管。从结构上来讲,母儿血并不混合,母儿循环间经过5层间隔进行气体及物质交换。它们是:①合体滋养细胞层。②细胞滋养细胞层。③绒毛内结缔组织。④胎儿毛细血管基底膜。⑤胎儿毛细血管内皮细胞。胎儿血液经脐动脉直至绒毛毛细血管,经由5层间隔与绒毛间隙中的母血进行物质交换后经脐静脉返回胎儿体内(图2-4)。

图2-3 正常妊娠胎盘,血管合体膜(VSM)(40×,HE)
1.胎儿血管(V)扩张,占据了大部分绒毛横截面。
2.成熟绒毛中的血管合体膜(VSM)。

图2-4 胎盘绒毛结构与血液循环的模式图
血流方向:↑富含营养与O2的血;↓含代谢废物与CO2的血。
1.1.4 其他结构及意义
在正常妊娠中,胎盘绒毛除了有VSM绒毛(10%~30%[6],35.12%[5]),还有合体结节绒毛(7.15%~7.87%[6],17.37%[5]),纤维素样绒毛,绒毛间腔容积(38.02%[6]~30.45%[5])等。它们不论在形态上的变化或数量上的变化都会对妊娠结局产生影响。
1.2 胎盘的母体部分
胎盘的母体部分为底蜕膜,占胎盘很小部分。底蜕膜表面覆盖来自固定绒毛的滋养层细胞与底蜕膜共同形成绒毛间隙的底,称为蜕膜板。从此,板向绒毛膜伸出蜕膜间隔,不超过胎盘厚度的2/3,将胎盘母体面分成肉眼可见的20个左右母体叶。
1.2.1 子宫胎盘循环
在子宫胎盘附着位置,母体血液经由100~200根螺旋动脉注入绒毛间腔。相当于每2cm2胎盘有1条螺旋动脉。母体螺旋动脉入口处压力25mm Hg(3.3kPa),绒毛间腔压力15~20mm Hg(2.00~2.67kPa)。血液直接流向绒毛板或间绒毛根部,减弱的压力导致血液缓慢流动,使血液能围绕终末绒毛表面进行充分的气体与物质交换。然后母体血液经蜕膜板进入蜕膜静脉网,此时,压力>8mm Hg,通过内膜静脉回流入母体内(图2-4)[7]。
成熟胎盘绒毛间腔可容大约150m l血液,每分钟交换3~4次。胎盘血流量在孕10周时,为50m l/m in,孕足月时,大约为500~600m l/m in[6]。为获得如此大量的血液供应,非孕时的子宫螺旋动脉要演变成子宫胎盘动脉。
1.2.2 子宫螺旋动脉生理性改变
(1)子宫螺旋动脉解剖特点。子宫螺旋动脉是来自髂内动脉经子宫动脉、子宫动脉上行分支、弓形动脉向心支(放射动脉)到达子宫内膜的血管。子宫内膜存在着两个功能不同的动脉系统:螺旋动脉和基底动脉。子宫内膜螺旋动脉和体内其他动脉不同,它具有独特性能,在激素影响下,有周期性改变。基底动脉管壁内缺少弹力纤维,不受激素影响发生周期性改变。妊娠期子宫螺旋动脉受激素影响,为了能供应胎盘足够的血流量而发生广泛的适应性变化。子宫螺旋动脉分布在子宫内膜和子宫肌层,子宫内膜螺旋动脉又称螺旋动脉内膜段,子宫肌层螺旋动脉又称螺旋动脉肌层段[6]。
(2)子宫螺旋动脉到子宫胎盘动脉的形态改变。妊娠初期的改变:受精后6周在螺旋动脉的管腔中即可见到滋养细胞。孕早期的滋养细胞增殖来自受精卵的滋养层壳。一种为间质或称基质滋养细胞,它侵入子宫蜕膜层及肌层,产生胎盘床巨细胞。另一种为血管内皮样滋养细胞,它逆血流方向沿血管壁生长,游走侵入螺旋动脉,修饰它们成为子宫胎盘动脉。这两种滋养层细胞功能是相对的,在螺旋动脉结构变化过程中,两者缺一不可。自细胞滋养细胞侵入螺旋动脉壁并嵌入其中,细胞滋养细胞穿破动脉壁,以纤维组织替代了动脉壁中的肌层和弹力成分,使螺旋动脉逐渐扩张,最终成漏斗形。此过程分两个阶段,亦称二次迁移。第一次迁移在10孕周时完成,使蜕膜层血管发生“失弹性”变化,亦称妊娠期子宫螺旋动脉内膜段的生理改变。这一改变的主要功能是明显地减少胎盘床末梢血管阻力,使较多的血液无阻碍地流入胎盘绒毛间隙,以保证胎儿和胎盘的生长。上述改变仅见于与滋养细胞接触的底蜕膜内的螺旋动脉,而不发生于没有滋养细胞浸润的壁蜕膜、包蜕膜的螺旋动脉和基底动脉。妊娠中期改变:经过一段静止期,第二次迁移从14~16孕周开始,持续4~6周。此次迁移滋养细胞第二次逆流到螺旋动脉,并达到子宫肌层螺旋动脉,有的甚至波及子宫放射动脉末端,使子宫肌层段的螺旋动脉发生生理适应性变化,即子宫螺旋动脉肌层段“失弹性”化。妊娠晚期的改变:妊娠晚期胎盘床螺旋动脉的电镜观察可见血管壁的肌肉弹力组织或多或少地被纤维和颗粒性物质代替,其中可见滋养细胞。高倍放大证明,纤维和颗粒性物质为有间隔18~20nm明暗带的典型纤维素。变性的血管壁内有存活的滋养细胞,表明这些细胞浸润是血管变性的原因而不是结果。在此过程中,螺旋动脉直径从妊娠早期的200~300μm,逐渐扩张到1000μm。这种变化有两种意义:①增加受精卵发育所需要的血液供应。②肌层弹性组织的丧失意味着子宫胎盘动脉对循环加压因子或神经自动调节不再发生应答。因此,对子宫螺旋动脉的调控,只能在接近螺旋动脉的放射动脉水平完成(图2-5)[6]。

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















