垂体瘤(pituitary tumor)是常见的颅内肿瘤。起源于腺垂体的垂体腺瘤(pituitary adenoma)是最常见的垂体瘤,其次为起源于胚胎残留组织的颅咽管瘤,其他如颅颊囊囊肿、表皮样囊肿、垂体癌及转移性垂体肿瘤均很少见。在原发性鞍内肿瘤中,垂体腺瘤的患病率位列第三(胶质瘤和脑膜瘤位列第一和第二)。
尸检资料显示,垂体瘤发生率达3%~27%。人群MRI普查资料显示,垂体瘤的发生率达10%。总之,垂体瘤的发病率比我们想象的要高很多。不过,绝大多数垂体瘤直径在5mm以下且无症状。
【分类】 垂体腺瘤可按大小分为微腺瘤(microadenoma)和大腺瘤(macroadenoma),前者直径<10mm,后者直径>10mm。也可根据垂体腺瘤的侵袭性分为封闭性腺瘤(enclosed adenoma)和侵袭性腺瘤(invasive adenoma)2种,前者肿瘤局限于鞍内,后者肿瘤已侵蚀鞍底骨质或向鞍上、鞍旁扩展。
在病理学上,过去常根据瘤细胞的染色特性将垂体腺瘤分为嫌色性腺瘤、嗜酸性腺瘤和嗜碱性腺瘤3类。目前一般按细胞来源及分泌功能将垂体腺瘤分为以下6类:①生长激素瘤(somatotropic adenoma),即GH瘤(growth hormone adenoma,GH-oma);②催乳素瘤(prolactinoma),即PRL瘤(PRL-oma);③促肾上腺皮质激素腺瘤(corticotropic adenama),即ACTH瘤(ACTH-oma);④促甲状腺激素瘤(thyrotropic adenama),即TSH瘤(TSH-oma);⑤促性腺激素瘤(gonadotropic adenoma),即LH/FSH瘤(LH/FSH-oma);⑥无免疫反应性激素腺瘤(hormone nonimmunoreactive adenoma)。应该指出的是,临床上经常使用的“无功能腺瘤(non-functioning adenoma)”一词与无免疫反应性激素腺瘤有一定的不同,无功能垂体腺瘤指的是临床上无激素高分泌表现的垂体腺瘤,实际上绝大多数无功能垂体腺瘤也具有分泌功能,只是其分泌功能较低,不产生激素过多症状;无免疫反应性激素腺瘤指的是在免疫酶染色上对各种垂体激素抗体呈现阴性反应的垂体腺瘤,它们可能是真正不具有分泌功能的垂体腺瘤。显然,无功能垂体腺瘤定义的外延较无免疫反应性激素腺瘤要广。
TSH,LH和FSH这3种糖蛋白激素均由α及β两个亚单位组成,各激素的β亚单位不同但其α亚单位(α-subunit,α-SU)在同一物种是相同的。分泌这些糖蛋白激素的垂体腺瘤的分泌物中既有完整的激素,也有游离的激素亚单位。有的肿瘤甚至以分泌α亚单位为主,称为α亚单位瘤。
大多数垂体腺瘤只分泌一种激素,称为单激素型腺瘤;有些垂体腺瘤(约18%)分泌的激素不止一种,称为多激素型腺瘤(plurihormone adenoma),这在GH瘤和PRL瘤较为多见。多激素型垂体腺瘤既可由几种各具不同分泌功能的细胞组成,也可以仅有一种细胞但此细胞能分泌多种激素。多激素型垂体腺瘤分泌的激素有多种不同的组合,以GH-PRL及GH-α亚单位及LH-FSH这几种组合较为常见。
1996年,WHO将垂体腺瘤的分类分为5个层次。第1个层次是按功能分类,分为内分泌功能亢进、临床无功能、功能状态不确定和异位性内分泌功能亢进4大类,其中内分泌功能亢进又按激素的种类不同而分为肢端肥大症/巨人症(生长激素过多)、高催乳素血症、库欣病、甲状腺功能亢进(TSH过多)、LH/FSH/α亚单位过多、多种激素产生过多6种,异位性内分泌功能亢进有2种:异位GHRH产生过多引起的肢端肥大症(增生/腺瘤)和异位CRH产生过多引起的库欣病(增生/腺瘤)。第2个层次是按影像学和手术信息分类,又有3种分类方法:根据部位分为鞍内、鞍外扩展(鞍上、蝶窦、鼻咽部、海绵窦等)和异位(罕见)3种;根据大小分为微腺瘤(直径≤10mm)和大腺瘤(直径>10mm)2种;根据生长类型分为扩张型、局部侵犯(硬脑膜、骨、神经和脑)和转移(脑脊髓或全身)3种。第3个层次是普通病理(光学显微镜)分类,分为腺瘤、癌和非腺瘤3类,其中腺瘤又分为典型和不典型2种,非腺瘤又分为原发或继发于腺垂体以外的肿瘤和类似腺瘤的垂体增生2种。第4个层次亦是病理学分类,但它依据的是免疫细胞化学检查,分为GH瘤、PRL瘤等。第5个层次是按电镜所见瘤细胞的超微结构分类。上述5个层次的分类方法从不同侧面反映垂体腺瘤的特征,各有其应用价值。
各型垂体腺瘤的发病情况如表1-1和表1-2所示。
表1-1 不同类型垂体腺瘤的发病率和患病率

引自Davies JRE,et al.2001
表1-2 不同类型垂体腺瘤占总垂体腺瘤的百分比
引自Davies JRE,et al.2001
【病因与发病机制】 关于垂体腺瘤的病因有两种不同的学说,一种认为垂体腺瘤的基本病因在下丘脑:下丘脑功能紊乱使下丘脑促垂体释放激素产生过多,导致垂体细胞受到持续的、过度的刺激,引起相应的垂体细胞慢性增生,久之则形成腺瘤;另一种学说则认为垂体腺瘤的原发病因在垂体本身:由于垂体细胞的内在异常(如体细胞突变)使其发生异常的克隆增殖,最后形成肿瘤。这两种学说都有一些支持的证据,但都不能解释全部现象。目前认为,垂体细胞的内在缺陷和调节异常在垂体腺瘤的发生发展中都有一定的作用。
随机尸检和用高分辨率MRI所作的人群普查结果表明,微小的无症状垂体腺瘤是相当常见的(超过10%),但临床显性垂体腺瘤的患病率则很低(1/500~1/1 000),这说明垂体内在异常作为垂体腺瘤发生的始发事件是相当常见的,但必须同时合并存在其他的促进垂体细胞增生的因素方可进一步形成显性垂体腺瘤。影响垂体细胞增生的因素可能也不限于下丘脑激素或因子,垂体局部的自分泌/旁分泌因子及某些性腺肽类也起着重要的作用,它们可能也参与垂体腺瘤的发生发展。
【临床表现】 垂体腺瘤瘤细胞的倍增时间为100~700d,故肿瘤生长缓慢,这种生物学特征决定了垂体腺瘤一般起病潜隐,早期可无症状。有的肿瘤甚至自始至终没有症状,死后尸检始被发现。显性垂体腺瘤的临床表现主要有以下两大症群:
1.内分泌异常症群 垂体腺瘤的内分泌异常既可因肿瘤的直接分泌而引起,也可因肿瘤的占位效应而引起。绝大多数临床显性垂体腺瘤都有分泌功能,这些肿瘤分泌一种或几种激素,产生相应的激素过多症群,称为高分泌综合征(hypersecretory syndrome)。随着瘤细胞的增殖,肿瘤的体积不断增大,于是压迫正常垂体组织和(或)邻近脑组织而产生相应的症状,称为占位效应。较大的垂体腺瘤压迫正常垂体组织可引起垂体功能减退。GH瘤、PRL瘤、ACTH瘤和TSH瘤在占位效应出现之前因肿瘤自身的分泌已可产生明显的临床症状,故继发于占位效应的内分泌异常往往不甚明显或被掩盖。分泌功能不强的促性腺激素瘤和无功能垂体腺瘤常因占位效应而引起内分泌异常,并可作为病人的突出表现。肿瘤占位效应引起的垂体功能减退以促性腺激素不足引起的继发性性腺功能减退症状出现最早,也最常见;其次为TSH不足引起的继发性甲状腺功能减退;ACTH不足引起的继发性肾上腺皮质功能减退症状一般较轻,且较少见。
如肿瘤压迫垂体柄而影响垂体门脉循环,随门脉血流进入垂体的下丘脑催乳素抑制因子(即多巴胺)减少,血PRL水平可升高,称为垂体柄效应(stalk effect)。此时影像学上有垂体肿瘤的证据,加之血PRL升高,有人将这种情况称为假性PRL瘤(pseudoprolactinoma)。假性PRL瘤血PRL水平一般不超过200ng/ml,借此可与真正的PRL瘤鉴别。手术标本的免疫细胞化学检查可明确诊断。
2.肿瘤压迫、侵蚀垂体周围组织引起的症群
(1)头痛和颅压增高症状:头痛是垂体腺瘤的常见症状,多为持续性头痛,可间歇性加重,一般呈胀痛。头痛部位多在两颞部、额部、眶后或鼻根部。头痛主要由于肿瘤在鞍内生长使鞍膈张力增高及周围硬脑膜因肿瘤生长受到牵拉所致,一般不伴高颅压。当肿瘤穿破鞍膈后,鞍内压力降低,头痛遂减轻甚至消失。如鞍膈孔较大,肿瘤易于生长到鞍膈以上,则头痛可不显著。肿瘤向上生长侵入下丘脑、第三脑室时可引起颅内压升高,此时病者常有剧烈头痛并伴呕吐,眼底检查可见视神经盘水肿。
(2)神经眼科表现:视交叉位于蝶鞍的上方,垂体腺瘤向鞍上发展可压迫、侵蚀视交叉而产生视觉异常;肿瘤压迫动眼神经可出现眼运动功能障碍,统称神经眼科表现。
①视力改变:两颞侧偏盲为垂体腺瘤最常见的视野改变,乃鼻侧视网膜的神经纤维受损所致。大多数病人开始时仅两侧外上象限视觉障碍,以后右眼的视野缺损呈顺钟向发展,左眼则呈逆钟向发展,故视野缺损一般起于颞侧上部1/4,依次向颞侧下部1/4,鼻侧下部1/4及鼻侧上部1/4发展。当发展到颞侧下部1/4而鼻侧尚未受累时则形成两颞侧偏盲;当最后累及鼻侧上部1/4时则成为全盲(很少见)。未受累视野部分的视力可正常,但如合并视神经萎缩则视力亦下降。视野缺损的发展一般是对称的,但也可不对称:有时一眼已全盲,另一眼的视野缺损尚不严重。两颞侧偏盲的表现是不能完成近距离的精细动作如穿针、剪指甲等,原因是双鼻侧视网膜的神经纤维损伤后在双眼之间形成一个盲区。
此外,病人还可出现暗点型视野缺损及同向偏盲。
②眼运动功能障碍:眼运动功能障碍较视力改变少见,发生率1%~4.6%,乃垂体腺瘤侧向生长侵犯海绵窦所致。动眼神经最易受累,引起动眼神经麻痹。麻痹一般是单侧的、不完全的,重者可累及瞳孔,使受累侧瞳孔缩小、光反射减退。滑车神经和外展神经受累较少见。有时三叉神经也可受累,产生三叉神经痛或引起三叉神经支配区域的感觉缺失。少数病人嗅神经亦受累而出现嗅觉减退甚至丧失。
(3)其他表现:垂体腺瘤向鞍上生长可影响下丘脑的功能,产生下丘脑综合征,出现精神异常、睡眠异常、体温调节紊乱、肥胖、尿崩症等;肿瘤压迫第三脑室可引起脑积水和颅内压升高;肿瘤侵及额叶可引起癫 ;肿瘤侵入蝶窦可引起脑脊液鼻漏和鼻出血;肿瘤生长迅速者可因瘤内出血而引起垂体卒中。
;肿瘤侵入蝶窦可引起脑脊液鼻漏和鼻出血;肿瘤生长迅速者可因瘤内出血而引起垂体卒中。
值得注意的是,有些病人在作影像学检查(高分辨CT和MRI)时偶然发现垂体有占位,而病人临床无任何症状,此种垂体瘤称为垂体意外瘤(pituitary ncidentalomas)。有些垂体意外瘤也存在内分泌紊乱,惟程度较轻,不产生病人可察觉的症状。有些垂体意外瘤经长期随访并无内分泌异常表现,可能属于无功能垂体瘤。
【实验室检查与影像学检查】
1.实验室检查 垂体腺瘤的常规实验室检查多无异常。对垂体腺瘤来说,重要的是各种内分泌功能检查。由于病变及病程的不同,垂体腺瘤的内分泌功能检查可有4种结果:
(1)完全正常:肿瘤的分泌功能较低,而其占位效应又不显著。
(2)功能亢进:肿瘤的分泌功能较强,使某种垂体激素分泌过多并产生相应的靶腺功能亢进症状。
(3)功能减退:肿瘤的分泌功能不强,不足以产生功能亢进,但因占位效应引起垂体功能减退及相应的靶腺功能减退。
(4)功能亢进伴功能减退:肿瘤分泌功能较强,产生某种激素过多症状;同时由于占位效应而产生另一些垂体激素缺乏的表现。
对垂体腺瘤患者应进行全面的内分泌功能检查,包括各种垂体激素及相应的靶腺激素。由于垂体激素的分泌具有节律性,因此仅根据单次测定的结果常难以作出结论,而需作某些动态试验以助诊断。动态试验一般分兴奋性和抑制性两种。兴奋试验(或称激发试验、刺激试验)是利用某些刺激因素(下丘脑促垂体激素、药物等)刺激垂体激素的分泌,用以判断该垂体激素的储备情况,常用于疑有功能不足但测定结果正常者。疑有功能亢进者亦可作兴奋试验,此时垂体对兴奋试验的反应常超过正常。抑制试验是利用某些抑制因素抑制激素的分泌,常用于疑有功能亢进但测定结果正常者。关于各种垂体腺瘤具体的内分泌功能检查参见各有关章节。
2.影像学检查 垂体腺瘤的影像学检查包括X线检查、磁共振检查(MRI)和正电子发射断层摄影(positron emission tomography,PET)等。
(1)X线检查
①普通X线检查:头颅正侧位片可显示蝶鞍形态,但不能显示垂体,因此,如果垂体腺瘤仅在鞍内生长而未影响蝶鞍形态,则头颅正侧位片可无异常。如肿瘤侵及蝶鞍则可在头颅正侧位片上形成一系列表现,如蝶鞍扩大;鞍壁脱钙、变薄;前、后床突变细甚至缺如;鞍底变阔、下陷;如肿瘤偏于一侧则可使另一侧鞍底下陷明显,侧位片上呈现出双鞍底。
分层摄影、气脑造影、脑室造影和血管造影对垂体腺瘤的诊断也有一定意义,但由于这些检查多较复杂且有一定的危险性,加之CT和MRI的普及,现已很少使用。
②CT:CT对垂体腺瘤的诊断具有重要价值。大腺瘤多侵及鞍上池,CT平扫即可有阳性发现。平扫时可见鞍上池前部充盈缺损乃至闭塞,充盈缺损的后界常显示清楚,前界因与脑组织相连而不甚清楚。瘤体密度一般较脑组织略高且较均匀,如瘤内有坏死、囊性变则密度可不均匀。一般来说,肿瘤越大则发生密度不均匀的机会也越多。偶尔瘤体内可见钙化灶。用骨窗显示蝶鞍骨质结构可发现蝶鞍扩大、鞍底下陷。增强后扫描,除坏死、出血、囊变和钙化灶外整个肿瘤均有强化,使肿瘤显示更为清楚。肿瘤较大者除上述表现外,还常伴有占位效应的表现,如第三脑室前部因受压而闭塞、侧脑室扩大、侧脑室前角内缘受压等,偶尔肿瘤可将颈内动脉包裹于其内。
垂体微腺瘤于水平面扫描可无阳性发现,需作冠状面增强后的薄层扫描。增强后早期微腺瘤的密度一般较正常垂体组织为低,故表现为局限性低密度影,边界一般较清楚。后期(55min后)可表现为高密度灶,中期则为等密度灶。除上述直接征象外,微腺瘤还可有一些间接征象,如鞍底局限性下陷或局限性骨质吸收、垂体高度增加、垂体柄移位等。由于正常蝶鞍和垂体的大小形态颇多变异,故单根据这些间接征象常难以作出诊断。总之,CT对垂体微腺瘤的诊断有一定限度,CT无阳性发现时不能完全排除微腺瘤。
(2)MRI:对于垂体大腺瘤来说,CT已能提供足够的诊疗信息,不一定要做MRI。有时为了进一步了解垂体邻近结构受累情况或为了与其他病变相鉴别,则需作MRI。不过,MRI亦有其缺点,它不能很好地显示骨质破坏及钙化灶。
在T1和T2加权图像(即T1WI,T2WI)上,垂体大腺瘤表现为等或低信号灶,且大都形态规则,轮廓清楚(图1-1,图1-2,图1-3)。坏死和囊变区域在T1加权图像上表现为低信号,在T2加权图像上则为高信号。注射钆造影剂后,坏死和囊变区域不能被增强。肿瘤向鞍上生长时受鞍膈限制可形成略对称的切迹,称为“腰身”。肿瘤上缘在鞍上池可与脑脊液形成鲜明的对比,使肿瘤的境界清晰地显示出来。在T1加权图像上,视交叉的信号强度高于肿瘤,故肿瘤向上生长使视交叉受压、上移等变化能得到很好的显示。肿瘤向鞍旁生长可侵及海绵窦,并可将海绵窦内的颈内动脉向外推移,甚至将颈内动脉包裹在内(图1-3)。
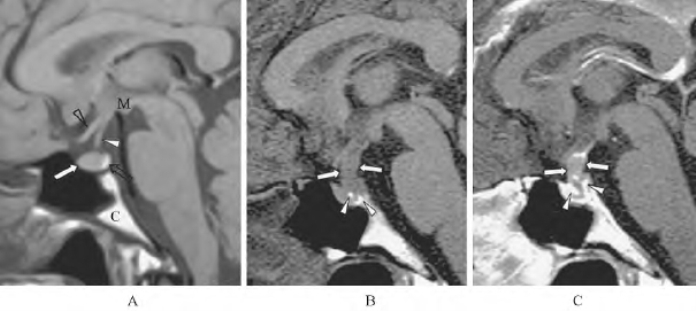
图1-1 垂体腺瘤MRI所见(引自Shin JH,et al.2001)
A.正常垂体矢状面T1加权像(白箭示垂体前叶,空心箭示垂体后叶,白色三角形示垂体柄,空心三角形示视交叉);B.垂体腺瘤T1加权像(白箭示增粗的垂体柄,白色三角形示残存的垂体后叶);C.注射造影剂后的T1加权像(白箭示轻度增强的垂体柄,白色三角形示显著增强的正常垂体前叶)
垂体微腺瘤一般采用冠状面和矢状面薄层成像。在T1加权图像上,微腺瘤表现为低信号,常偏于垂体的一侧。在T2加权图像上则常为高信号或等信号。微腺瘤MRI增强后的表现同CT相似,即增强早期微腺瘤信号强度较正常垂体为低,后期(55min以后)瘤体信号强度则高于正常垂体,介于两者之间时肿瘤表现为等信号灶。微腺瘤MRI上也可有一系列间接征象,如垂体上缘上凸、垂体柄移位等。
(3)PET:PET作为一种功能显像技术,自20世纪80年代应用于临床以来已取得很大的成功。PET可提供有关肿瘤生化特征、代谢特性、受体分布及酶学特点等方面的信息,在肿瘤的诊断、治疗等方面均有重要的意义。
PRL瘤及某些无功能腺瘤常有代谢增强,因此,用11 C标记的左旋蛋氨酸和18 F标记的氟脱氧葡萄糖(18 F-fluorodeoxyglucose,18 F-FDG)可使其显像。用多巴胺受体激动药治疗后,瘤细胞的代谢降低,其摄取11 C-左旋蛋氨酸和18 F-FDG的能力也下降。11 C标记的多巴胺D2受体拮抗药甲基螺哌隆(methylspiperone)和雷氯必利(raclopride)可使PRL瘤显像,且可预测多巴胺受体激动药的疗效。一般来说,11 C标记的甲基螺哌隆和雷氯必利显像者对多巴胺受体激动药的反应良好。
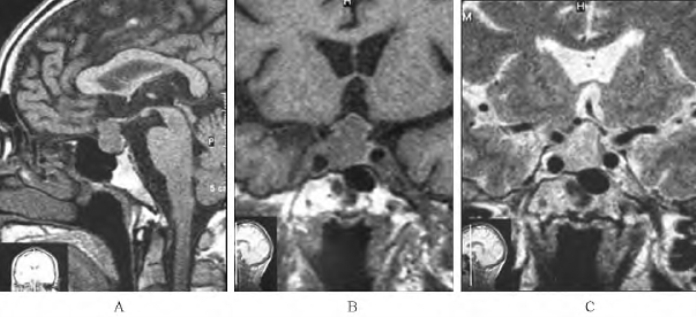
图1-2 垂体大腺瘤MRI所见(图片系上海新华医院李玉华教授惠赠)
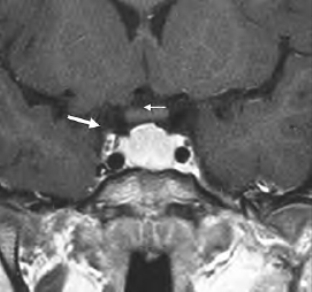
图1-3 垂体大腺瘤增强后的T1加权像(图片系上海新华医院李玉华教授惠赠)
瘤体被增强,但程度不及正常垂体前叶(粗箭头),左颈内动脉被肿瘤包裹,细箭头示视交叉
【诊断与鉴别诊断】 根据临床表现、内分泌检查及影像学检查,大多数垂体腺瘤可获确诊。垂体腺瘤需与其他鞍区病变如淋巴细胞性垂体炎、肉芽肿性垂体炎、垂体脓肿、颅咽管瘤、Rathke裂囊肿(Rathke cleft cyst)、空泡蝶鞍等相鉴别。临床表现、内分泌检查是鞍区病变鉴别的基础,影像学检查对鞍区病变的鉴别亦很重要。
Rathke裂囊肿的MRI表现与囊液蛋白质浓度有关。如果蛋白质浓度高,在T1加权像上表现为高信号,在T2加权像上表现为信号强度与灰质相等或略低(图1-4)。如果蛋白质浓度低,在T1加权像则表现为低信号(图1-5)。
多数情况下通过临床表现、内分泌检查和影像学检查鞍区病变可得鉴别,但有时需通过手术标本的病理检查、免疫细胞化学检查及电镜观察始能确诊。
【治疗】 内科药物、垂体手术及放射线照射是目前垂体腺瘤3种主要的治疗方法。
1.内科治疗 垂体瘤的高分泌是导致临床表现的重要原因,因此,采用所谓抗分泌药物(antisecretory medications)是治疗垂体瘤的重要手段。多巴胺激动药(dopamine agonist)是目前最常用的抗分泌药物,对多种垂体腺瘤都有效果,但以PRL瘤效果最佳。多巴胺激动药不仅能显著降低血PRL水平,还能使瘤体明显缩小甚至消失,因此,它们不光有抗分泌的作用,还有抗生长的作用。生长抑素类似物对GH瘤具有较好的疗效,对TSH瘤和某些促性腺激素瘤也有作用。此外,促性腺激素释放激素类似物对促性腺激素瘤有一定的效果;血清素抑制剂赛庚啶可用于治疗ACTH瘤和某些GH瘤;生长激素受体拮抗药对GH瘤有较好的疗效。近年国外有人开发出生长抑素-多巴胺能嵌合配体(somatostatin/dopaminergic chimeric ligand),既有生长抑素的作用,又有多巴胺激动药的作用,是一类很有前途的药物。维甲酸受体激动药和过氧化物酶体增殖物激活的受体γ(peroxisome-proliferator-activated receptorγ,PPARγ)激动药对某些垂体腺瘤可能也有潜在的治疗作用。垂体瘤转化基因(pituitary tumor transforming gene,PTTG)也是潜在的治疗靶点,近年有人试图开发针对该基因的药物。
垂体腺瘤的内科治疗还包括由于腺瘤的占位效应而引起的腺垂体功能减退的治疗,措施是补充适量的靶腺激素。
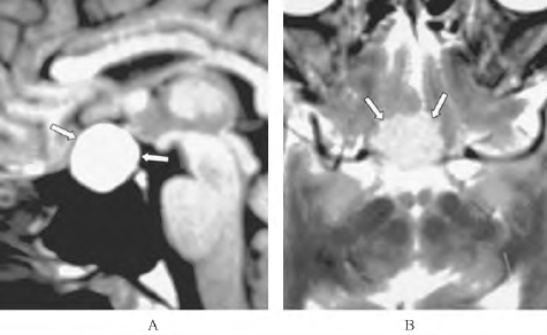
图1-4 垂体Rathke裂囊肿MRI所见(引自Shin JH,et al.2001)
T1加权像上表现为境界清楚、均质的鞍区高信号占位(A);T2加权像上表现为与脑灰质信号强度相等的鞍区占位(B)
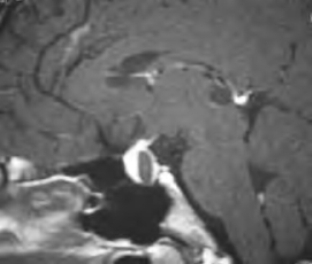
图1-5 垂体Rathke裂囊肿T1加权像(图片系上海新华医院李玉华教授惠赠)
T1加权像上表现为低信号
2.手术治疗
(1)手术治疗的目的:手术治疗的目的是纠正垂体腺瘤的高分泌状态,解除肿瘤对视交叉的压迫,消除肿瘤侵犯海绵窦而引起的脑神经麻痹症状,改善因肿瘤占位效应而引起的垂体功能减退及高催乳素血症,并保存正常垂体功能以及减少复发。此外,手术标本可用作病理检查、免疫细胞化学检查和电镜检查。
(2)手术进路:Caton和Paul于1893年首次尝试手术切除垂体瘤,他们采用颞侧进路,但未能达到目的,而且病人在3个月后死亡。1904-1906年Horsely以额下进路和侧中窝进路施行10例垂体瘤手术,死亡率达20%。经颅进路垂体手术的高死亡率使得外科医生探索新的安全的颅外进路,以施行鞍区手术。
Giordano(1864-1954)可能是第一个探索颅外进路垂体手术的学者,他于1897年基于实验研究提出切除额窦和鼻的前壁、经眉-鼻进路(transglabellernasal approach)施行垂体手术的可能。Schloffer将Giordano的经面进路(transfacial approach)思路应用于临床,他于1907年报道了第1例通过鼻上经蝶进路(superior nasal transsphenoidal approach)成功切除的垂体瘤病例。该手术进路的缺点是术后脑膜炎的发生率很高以及破坏面部结构影响美容,因此,不少外科医生尝试对其进行改进。1910年,奥地利耳鼻咽喉科医生Hirsch(1877-1965)描述了局麻下鼻内经蝶进路。同年,Halstead采用唇下龈切开的方法暴露蝶窦,扩大了手术野,并且避免了手术对美容的破坏。加拿大学者Hardy对经蝶术式做了进一步改进,他于1967年将他发明设计的手术显微镜用于手术中,使得这一术式更加成熟。采用手术显微镜的前50例经蝶手术,无一例死亡,充分说明手术显微镜的巨大意义。
经Guiot和Hardy的改进和推广,经蝶进路成为垂体手术最主要的手术进路,对于微腺瘤尤其如此。经蝶进路的优点是不需进颅,创伤小,在手术显微镜的帮助下可选择性切除肿瘤而对正常垂体组织损伤极小。该法的另一优点是,如术后复发,肿瘤一般不向鞍上和鞍旁扩展而向鞍底生长(因手术可造成鞍底的破坏)。经蝶手术的不足是操作较精细,对术者的手术技巧和经验要求较高,使其难以广泛开展。
近年有学者将内镜引入经蝶垂体手术中,发展出内镜辅助的经蝶进路(endoscope-assisted transsphenoidal approach)。早在1978年,Bushe和Halves首次在垂体手术中使用内镜。但是,此后的一段时间里内镜辅助垂体手术并没有被广泛接受。直到20世纪90年代中期,随着内镜鼻窦手术被耳鼻咽喉科医生广泛开展,神经外科医生开始尝试将内镜技术运用到经蝶垂体手术中。较之手术显微镜,内镜垂体手术的手术野暴露更好,也更清晰。不过,内镜辅助的经蝶手术也存在一些问题,其确切价值尚待检验。
如果垂体大腺瘤向上、向侧扩展,经蝶进路常不能有效切除。如果病人合并有蝶窦炎,也不能采用经蝶进路。在这些情况下,一般采用经颅进路。最常用的经颅进路有两种:额下前进路(anterior subfrontal approach)和翼点进路(pterional approach),后者又称额颞进路(frontotemporal approach)。经颅进路的优点是清除肿瘤较为安全、彻底(特别是对于有鞍上扩展的肿瘤),缺点是手术创伤较大,有可能损伤视交叉。
(3)术前准备:垂体手术的病人除进行常规术前准备外还应做MRI,以了解肿瘤的大小及与周边结构的关系。如果肿瘤靠近颈动脉,应慎行经蝶手术。术前还应做详细的内分泌功能检查,特别是垂体-肾上腺轴和垂体-甲状腺轴的检查,因为这两个轴功能障碍可引起严重的围手术期并发症。如果存在肾上腺或甲状腺功能减退(甲减),应及时给予相应的替代治疗。
(4)手术指征:手术治疗的指征有①肿瘤较大并累及视交叉和海绵窦,手术可迅速解除压迫症状;②肿瘤的分泌功能旺盛,产生明显的激素过多症状,手术可快速控制肿瘤的高分泌状态;③内科治疗和放射治疗失败者;④垂体卒中。
不同类型的垂体腺瘤的手术指征也不一样。
Cushing是垂体外科最主要的创始人之一,他对垂体瘤的外科治疗有很大的贡献。Cushing早年采用经颅进路(transcranial approach)治疗垂体瘤,但手术效果不能令人满意,这使他转而尝试经蝶进路。1909年,他第一次采用经Hirsch和Halstead等改进的Schloffer术式治疗肢端肥大症。随后Cushing又对术式作了改进,使治疗效果有了较大的提高。从1910-1925年,Cushing施行231例经蝶进路垂体手术,死亡率仅为5.6%,主要并发症为感染、脑脊液鼻漏、出血及术后水肿。Cushing虽然在经蝶进路治疗垂体瘤方面达到那一时代的最高成就,但他仍对经颅进路垂体手术怀有浓厚的兴趣,而且进行了许多探索。经过努力,他将经颅进路的死亡率降低到4.6%,这与经蝶进路的死亡率相当。因此,在一段时间里Cushing对两种手术进路都采用,具体根据病人的情况而定。20世纪20年代末,Cushing遇到许多患有鞍上肿瘤(尤其是脑膜瘤和颅咽管瘤)的病人,在术前无法与那些从下部无法接近的大垂体瘤鉴别。于这些病人,采用经额进路(transfrontal approach)可以在术中确诊鞍上肿瘤,并更完全地切除肿瘤,还更有效地解除视交叉和视神经受压,而且可以避免经蝶进路常有的感染。由于这些原因,到了1929-1931年Cushing基本上放弃了经蝶进路。由于Cushing在神经外科界的崇高威望,这使得在此后的30多年里经蝶进路几乎销声匿迹。不过,还有少数学者(如英国的Dott)仍然坚持使用经蝶进路。Dott于1923年在Cushing那里学得经蝶术式,他回爱丁堡后仍坚持使用这一术式,并发明一种反射镜以改善手术野的照明。此外,Hirsch和Hamlin也坚持使用经蝶术式。但是,同流行的经颅进路相比,经蝶术式不过是“荒野中微弱的声音(obscure voice in the wilderness)”。
1956年,Dott将经蝶术式传授给具有创新精神的法国神经外科医生Guiot。有感于经蝶术式的简便及Dott运用这一术式所取得的良好效果,Guiot成为这一术式坚定的支持者。Guiot在术中引入放射荧光屏检查(radiofluoroscopy)以增加鼻道解剖的清晰度,增加了手术的效果。他还在术后采用放射治疗,进一步提高手术效果。此后,曾在Guiot处进修过的Laws曾对其所在的Virginia大学神经外科1972-2000年施行的3 093例垂体瘤手术进行分析,其中PRL瘤占手术总数的30%,GH瘤占20%,ACTH瘤占15%,无功能瘤占30%。显然,PRL瘤手术治疗的比例较低(与其发生率相比),而且近年这一趋势还在继续。为什么PRL瘤手术治疗的比例较低呢?这是因为PRL瘤药物治疗的效果相当好,即使是较大的肿瘤药物治疗有时也可奏效,从而使得手术指征相对其他垂体腺瘤要严一些。
(5)手术并发症:经蝶手术的并发症有些是一过性的,有些则是永久性的。一过性并发症的发生率为6%~20%,永久性并发症的发生率5%~10%。一过性并发症有:尿崩症、脑脊液鼻漏、不适当的抗利尿激素分泌(SIADH)、脑膜炎、血肿、血管损伤、肺栓塞、发作性睡病、癫 、胃肠道出血、脓肿。永久性并发症有:视力减退、尿崩症、垂体功能减退(完全性或部分性)、SIADH及偏瘫、脑病。经蝶手术的死亡率约1%,死亡原因有:下丘脑损伤、血管损伤、心脏疾病、脑膜炎、颅脑积气、肺栓塞、麻醉意外等。
、胃肠道出血、脓肿。永久性并发症有:视力减退、尿崩症、垂体功能减退(完全性或部分性)、SIADH及偏瘫、脑病。经蝶手术的死亡率约1%,死亡原因有:下丘脑损伤、血管损伤、心脏疾病、脑膜炎、颅脑积气、肺栓塞、麻醉意外等。
(6)手术效果和术后复发:一般来说,垂体瘤手术治疗效果良好。但是,同其他治疗方法一样,手术治疗也存在复发这一缺点。据报道,经蝶手术的长期控制率为50%~80%。手术效果和术后复发率不仅与肿瘤大小有关,还与肿瘤的病理类型有关。晚近Espositol分析了125例经蝶手术资料(PRL瘤42例,GH瘤67例,ACTH瘤16例),结果显示,大腺瘤的生化缓解率为47%,微腺瘤的生化缓解率为78%,平均缓解率为56%。其中PRL瘤的缓解率为50%,GH瘤缓解率为57%,ACTH瘤的缓解率为68%。这些病人平均随访31个月(7~78个月),平均复发率为8.5%,其中PRL瘤的复发率最高,达24%。
3.放射治疗 在经蝶显微手术和多巴胺激动药问世以前,放射治疗是垂体腺瘤的首选治疗方法。放射治疗可损伤瘤细胞,阻止其生长(甚至可使肿瘤缩小),并降低其分泌功能。目前,虽然放射治疗的水平较以前有了很大提高,但由于经蝶手术和多巴胺激动药的发展,放射治疗在垂体腺瘤治疗中的地位已有所下降。多数情况下,放射治疗已不作为首选。
(1)放射治疗的指征:①术后复发者;②术后辅助治疗(术后放疗可破坏残存的肿瘤组织从而防止肿瘤复发);③经内科治疗或手术治疗后仍有持续性激素高分泌表现者;④有手术禁忌证或不能耐受抗分泌药物者;⑤Nelson综合征;⑥PRL瘤于内科治疗后高PRL血症得到控制但瘤体缩小不明显者。
(2)放射治疗的反指征:①肿瘤引起的激素过多症状明显(因放射治疗起效慢);②肿瘤较大并有鞍上和鞍旁生长;③有神经眼科症状(因放射治疗可引起局部组织水肿而加重症状);④肿瘤有囊变或出血(此时放射治疗往往无效)。
(3)放射治疗的方法:放射治疗主要分为两大类:外照射和内照射。
①外照射:外照射的方法有多种,常用的有:深部X线照射,一般每周照射5次,共4~5周,总剂量为40~50Gy;重粒子束(如α粒子束、质子束等);立体定向放射治疗(stereotactic radiotherapy)。在立体定向放射治疗中,如放射剂量一次性给予,也称为立体定向放射手术(stereotactic radiosurgery)治疗。一次给予高剂量对瘤细胞的杀伤作用强于将该剂量分次给予,因此,放射手术较常规放疗的效果要好。常见的放射手术治疗包括直线加速器(linear accelerator)、重带电粒子束(heavy charged-particle beam)、伽马刀(gama knife)和X刀。立体定向放射治疗不仅效果优于普通放射治疗,其放射损伤也较小,可惜设备昂贵,难以普及。
1968年,Leksell首次用伽马刀治疗垂体腺瘤。此后经过改进推广,伽马刀目前已成为常用的放射治疗方法之一。伽马刀使用201个钴源,这些钴源排列成半球形,它们发出的伽马射线聚焦于病灶。每个钴源发出的伽马射线剂量并不大,所造成的放射损伤很小,但焦点处的放射剂量则很大。因此,病灶所承受的照射量较大,而正常组织所承受的照射量则很小。在伽马刀治疗时,病人的头部固定于特制的塑料头具(head mask)中,这样可起到制动的作用,有助于提高疗效及减少放射损伤。
近年国外学者还开展强化调制放射治疗(intensity modulation radiation therapy)和塞博刀(cyberknife)。塞博刀是一种很有前途的治疗工具,它利用特殊的技术使放射线始终跟踪着病灶,这样即使病人头部有轻微的移动射线仍然指向病灶,既提高了治疗效果,又降低了放射损伤。
②内照射:内照射指的是将放射性物质引入体内进行治疗的方法。既往曾将198 Au,90 Y等置入蝶鞍中心以治疗垂体腺瘤,不过这些方法目前已极少采用。
(4)抗分泌药物对放疗效果的影响:2000年,Landolt第1次报道肢端肥大症病人在使用奥曲肽的同时如接受立体定向放射治疗,则放疗的效果较差。Landolt等据此推断奥曲肽具有放射保护作用。以后的观察显示,其他抗分泌药物也有相似的放射保护作用,即病人在使用这类药物的时候放疗效果较差。目前对抗分泌药物放射保护作用的机制尚不清楚,Landolt认为这类药物降低肿瘤细胞的代谢,从而使瘤细胞对放射线的敏感性下降。由于抗分泌药物的放射保护作用,所以在放疗前应停用抗分泌药物。不同抗分泌药物的停药时间不一样,多巴胺受体激动药一般停药2个月。如果是长效生长抑素类似物,先要改成短效制剂,4个月后停药,再过2周才可进行放射治疗。
(5)放射治疗的并发症:腺垂体功能减退是垂体放射治疗最常见的并发症。据报道,采用普通放射治疗的病人近半数于治疗后的2~3年出现腺垂体功能减退,而且随着随访时间的延长腺垂体功能减退的发生率继续增加。不过,近年广泛采用的立体定向放射治疗较少引起腺垂体功能减退。此外,垂体放射治疗还可引起视交叉和视神经的损伤从而导致视野缺损、血管损伤、垂体卒中、脑组织放射性损伤及诱发恶性肿瘤等。
4.其他治疗方法 除了传统的外科手术、放疗及抗分泌药物外,近年有人探讨其他的治疗方法,如基因治疗,但仍处于实验阶段。
5.垂体意外瘤的处理 对垂体意外瘤应做详细的内分泌检查(包括垂体激素和靶腺激素),以决定治疗方案,必要时应定期随访。
晚近,Oyama等在日本进行了一项多中心研究。他们对1999年3月至2002年5月发现的550例垂体意外瘤进行了分析,结果显示男性占231例,女性为319例,似乎女性的发病率略高于男性。在这550例垂体意外瘤中,261例做了手术治疗,其中经蝶手术256例,经颅手术5例。手术的主要原因是肿瘤向鞍上扩展(127例),其次为肿瘤体积较大(44例)。手术标本的病理学检查结果显示,211例(80.8%)为无功能腺瘤,42例(16.1%)为Rathke囊肿(Rathke cyst),5例(1.9%)为蛛网膜囊肿(arachnoid cyst),3例(1.2%)为颅咽管瘤。而在非手术组中,无功能腺瘤126例(43.6%)为,Rathke囊肿115例(39.8%),蛛网膜囊肿2例(0.7%),垂体增生8例(2.8%)。
Molitch曾提出如图1-6的垂体意外瘤处理方案,可供参考:
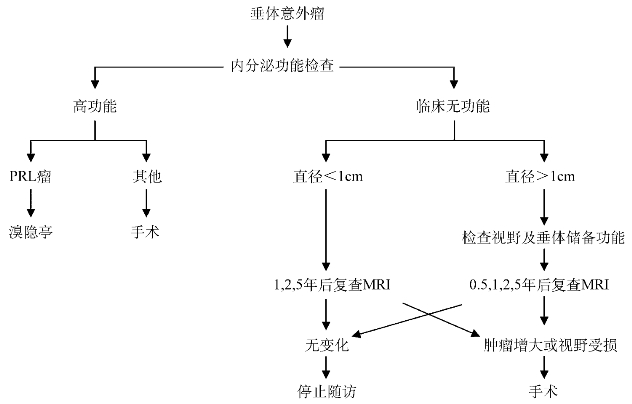
图1-6 Molitch垂体意外瘤处理方案
参 考 文 献
[1]张达青,苏青.垂体腺瘤[M]//刘新民主编.实用内分泌学.第3版.北京:人民军医出版社,2004:60-71
[2]Arafah BM &Nasrallah MP.Pituitary tumors:pathophysiology,clinical manifestations and management[J].Endocr Relat Cancer,2001,8:287
[3]Brada M,Ajithkumar TV &Minniti G.Radio-surgery of pituitary adenomas[J].Clin Endocrinol,2004,61:531
[4]Chanson P &Salenave S.Diagnosis and treatment of pituitary adenomas[J].Minerva Endocrinol,2004,29:241
[5]Connor SEJ &Penney CC.MRI in the differential diagnosis of a sellar mass[J].Clin Radiol,2003,58:20
[6]Couldwell WT.Transsphenoidal and transcranial surgery for pituitary adenomas[J].J Neuro-Oncol,2004,69:237
[7]Davies JRE,Farrell WE &Clayton RN.Pituitary tumors[J].Reproduction,2001,121:363
[8]Davies JRE &McNeilly AS.Is pituitary gene therapy realistic[J]?Clin Endocrinol,2001,55:427
[9]Espositol V,Santoro A,Minniti G,et al.Transsphenoidal adenomectomy for GH-,PRL-and ACTH-secreting pituitary tumors:outcome analysis in a series of 125patients[J].Neurol Sci,2004,25:251
[10]Ezzat S,Asa SL,Couldwell WT,et al.The prevalence of pituitary adenomas[J].Cancer,2004,101:613
[11]Halbauer DJ,Meszaros I,Doczi T,et al.Rare sellar region tumors[J].Pathol Oncol Res,2003,9:134
[12]Heaney AP &Melmed S.Molecular targets in pituitary tumors[J].Nat Rev,2004,4:285
[13]Hurley DM &Ho KKY.Pituitary disease in adults[J].MJA,2004,180:419
[14]Ironside JW.Pituitary gland pathology[J].J Clin Pathol,2003,56:561
[15]Jane JA &Laws Jr ER.Surgical management of pituitary adenoma[J].Singapore Med J,2002,43:318
[16]Kovacs K,Scheithauer BW,Horvath E,et al.The World Health Organization classification of adenohypophysial neoplasms.A proposed fivetier scheme[J].Cancer,1996,78:502
[17]Laws Jr ER,Sheehan JP,Sheehan JM,et al.Stereotactic radiosurgery for pituitary adenomas:a review of the literature[J].J Neuro-Oncol,2004,69:257
[18]Melmed S.Mechanisms for pituitary tumorigenesis:the plastic pituitary[J].J Clin Invest,2003,112:1603
[19]Molitch ME.Pituitary incidentalomas[J].Endocrinol Metab Clin North Am,1997,26:725
[20]Monson JP.The epidemiology of endocrine tumours[J].Endocr Relat Cancer,2000,7:29
[21]Oyama K,Sanno N,Tahara S,et al.Management of pituitary incidentalomas:according to a survey of pituitary incidentalomas in Japan[J].Semin Ultrasound CT MRI,2004,26:47
[22]Ren SG,Kim S,Taylor J,et al.Suppression of rat and human growth hormone and prolactin secretion by a novel somatostatin/dopaminergic chimeric ligand[J].J Clin Endocrinol Metab,2003,88:5414
[23]Shin JH,Lee HK,Choi CG,et al.MR imaging of central diabetes insipidus:apictorial essay[J].Korean J Radiol,2001,2:222
[24]Shin M.Gamma knife radiosurgery for pituitary adenoma[J].Biomed Pharmacother,2002,56:178s
[25]Vieira JO Jr,Cukiert A &Liberman B.Magnetic resonance imaging of cavernous sinus invasion by pituitary adenoma diagnostic criteria and surgical findings[J].Arq Neuropsiquiatr,2004,62:437
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















