神经母细胞瘤(neuroblastoma,NB)是最常见的儿童实体肿瘤之一。其预后差异很大,年龄小和(或)早期NB预后良好,但至今大年龄Ⅳ期患者预后仍很差,不幸的是大多数>1岁的患儿诊断时已存在远程转移病灶,为Ⅳ期患者,预后不良。这种临床异质性通过分子遗传学和生物学研究得到了部分解释。
一、流行病学
NB是最常见的儿童颅外实体肿瘤,占儿童肿瘤的8%~10%。每7 000个活体婴儿就有1例患神经母细胞瘤,有证据显示,在发达国家中NB发病率基本一致。男女发病比例约为1.1∶1。美国儿童肿瘤协作组(COG)大样本资料提示诊断时中位年龄为19个月,其中36%为<1岁婴儿,89%年龄<5岁,98%<10岁。NB的病因及发病机制还不明确,至今没有资料支持环境起重要作用。
二、病 理 学
NB是儿童“小圆细胞”肿瘤之一,其他“小圆细胞”肿瘤主要包括尤因肉瘤、淋巴瘤、外周原发性神经外胚层瘤还包括横纹肌肉瘤的软组织肉瘤。NB起源于神经嵴细胞,这种神经嵴来源细胞会发育为交感肾上腺能神经细胞。NB的常见原发部位与正常交感神经的分布有关,最常见部位包括脊柱二侧的交感神经节和肾上腺。
神经母细胞瘤、神经节母细胞瘤和神经节细胞瘤三种经典的组织病理学模式呈现了其成熟和分化的过程。典型的NB由大小一致的小细胞组成,这些细胞核致密、深染,而胞质少,绝大多数NB呈现特征性的神经纤维网。
神经节细胞瘤是完全分化的良性肿瘤,它由成熟的神经节细胞、神经纤维网和神经膜细胞组成。神经节母细胞瘤是一组异质性的肿瘤,同时存在神经母细胞瘤和神经节细胞瘤特征,而两者的比例可有很大差别,有些几乎完全是神经母细胞,很少见成熟细胞,但也有大部分是神经节细胞,偶尔可见神经母细胞。
三、生物遗传学变异
在NB中已证实多种遗传学特性和临床预后有关。亚三倍体患儿临床预后相对好,而NMYC癌基因扩增、17q扩增失衡,1p或11q等位基因丢失均与肿瘤进展和预后不良有关。特定的基因改变对预测治疗反应和预后很有帮助,因而已经成为完整诊断的重要组成部分。
(一)N-MYC扩增
已明确N-MYC扩增与预后密切相关,它位于2号染色体短臂的远端(2p24)。N-MYC扩增可以通过多种分子技术检测,多数实验室采用分裂间期荧光原位杂交技术(FISH,图15-1),FISH既能从形态学上证实N-MYC扩增状态,又能提供良好的客观质量控制,而且能识别低水平扩增和(或)瘤内的异质性。多少个拷贝数才能定义为“扩增”一直存在争议,大多数协作组将每二倍体基因组(分裂间期)≥10个N-MYC拷贝(FISH方法)定义为“扩增”。N-MYC扩增总发生率为18%~20%。扩增与肿瘤快速进展及不良预后相关,在预后良好的婴儿及早期NB的患儿中如存在N-MYC扩增也同样提示预后不良。已有明确证据提示N-MYC可以作为独立的预后因素,因此应将其列为NB的常规检测项目。

图15-1 N-MYC扩增FISH检测图像
A.FISH检测人NB骨髓转移标本的N-MYC扩增。图为NB细胞N-MYC荧光探针杂交,细胞核经DAPI染色。细胞内密集红色光点为N-MYC扩增,1个红色光点1个N-MYC拷贝。有2个红色光点的细胞为正常造血细胞。B.FISH检测人NB肿瘤标本的N-MYC扩增。图为肿瘤组织中NB细胞N-MYC荧光探针杂交,细胞核经DAPI染色。肿瘤组织中肿瘤细胞密集,细胞内红色光点为N-MYC扩增,1个红色光点为1个N-MYC拷贝,图中光点密集,提示大量N-MYC拷贝,无法准确计数(见书末彩图)
(二)17q的非平衡扩增
17号染色体的长臂(17q)的非平衡扩增发生率为50%。17q的扩增可以独立发生,但也可是1号和17号染色体不平衡易位的结果。17q的断裂点不恒定,但17q22-qter区域扩增更常见,17q的非平衡扩增与NB的进展有关,但其确切的预后价值尚有待于大量前瞻性实验和多因素分析研究。
(三)1p缺失、11q缺失
诊断时25%~35%原发NB可见1号染色体的短臂(1p)缺失。更常见于NB晚期患者,1p的等位缺失与N-MYC的扩增高度相关。其独立预后意义仍有争议,有数据表明当局灶性NB存在1p36等位缺失时复发风险的增加。
11q等位缺失占新诊断的原发肿瘤的35%~45%,虽然不和N-MYC扩增共同出现,但却与其他高危因素如分期高、年龄大、病理类型不良等高度相关。因此,在缺乏N-MYC扩增和(或)1p缺失的肿瘤中,可以考虑将11q缺失作为预后指标。
(四)神经营养因子受体表达异常
目前,对调控交感神经母细胞向神经母细胞瘤细胞恶性转变的因子还不清楚,可能涉及与细胞分化有关的神经营养因子受体通路。TrkA、TrkB和TrkC是3个酪氨酸激酶受体(Trk)同源家族。TrkA、TrkB和TrkC受体的主要配体分别是神经生长因子、脑源性神经营养因子、神经营养因子-3(NGF,BDNF,和NT-3)。激活TrkA会引导细胞生存和分化,相反抑制TrkA的激活会导致细胞的程序性死亡。高水平TrkA的表达与小年龄、低分期及不伴有NMYC扩增有关。也即TrkA的表达与预后良好高度相关。相反,TrkB却与NB进展及NMYC扩增强烈相关。因为这些肿瘤表达TrkB配体BDNF,所以会呈现一种自分泌或者旁分泌作用的途径,这种途径能给细胞提供生长优势。TrkC表达在同样也表达TrkA的部分肿瘤中,这两个受体/通路共同与周围环境中的配体作用驱使细胞向终端分化或者凋亡。
四、常规诊断治疗流程
对怀疑为NB的患者,其诊断过程包括疾病的确诊和分期、预后风险因素评估。应首先进行分期诊断所要求的各项检查,包括全身选择性的CT和(或)MR检查,NB容易发生骨和骨髓转移,因此在手术等治疗前应进行骨髓涂片和骨扫描检查。
经以上评估可明确判断肿瘤有否完全切除的可能,如不能完全切除,一般不提倡大部分肿瘤切除术,而是先进行病理活检以明确诊断,诊断后先进行化疗,待转移灶消失和(或)原发灶可切除时再做延迟性的肿瘤根治手术。
已证实多种细胞、基因遗传学变异和NB的预后相关,因此,应尽可能获得足够标本进行相关的分析(包括肿瘤组织和骨髓肿瘤细胞),如N-MYC、1P缺失、肿瘤细胞倍体等。临床医师必须认识到获取足够的标本来建立诊断并分析所有预后因素对决定治疗方案的重要性。
五、诊断与鉴别诊断
通过对临床表现的了解、合理选择影像学和相关实验室检查,可做出明确的诊断、分期和临床危险度分组。
(一)临床表现和扩散方式
NB多数起源于沿交感神经链分布的任意位置,大部分肿瘤原发在腹部(65%),肾上腺原发的发生率在儿童中(40%)较婴儿(25%)高。婴儿原发于胸部和颈部较大年龄儿多。约1%患者在原发灶很小时即发生广泛布散而不能确定原发肿瘤位置。随着年龄增长发病率降低,10岁以后发病少。
NB的症状和体征因原发肿瘤的位置、占位效应、是否转移及转移部位不同而异。腹部肿块表现为腹胀、不适,但很少合并肠梗阻、肠套叠、肠穿孔等急腹症。查体时会发现一个固定、坚硬的团块。如果原发肿块压迫泌尿系统、肠道、淋巴管或下腔静脉,会出现响应的压迫症状,如排尿、排便困难、腹水、下肢阴囊水肿等。肝脏转移主要见于婴儿(如4S期),巨大肝的占位效应可能引起呼吸困难。肾血管受牵拉或压迫可引起肾素介导的高血压,但比较少见。
高位胸部和颈部肿块可引起Horner综合征,表现为单侧上睑下垂、瞳孔缩小和无汗。当脊柱旁肿瘤扩展到椎间孔、椎管内时,引起与神经根和脊髓压迫相关的症状,主要为神经根痛,亚急性或急性的截瘫及膀胱、肠道功能异常。
NB主要通过淋巴和血流方式转移。局部淋巴结转移占35%,血源性扩散主要发生在骨髓、骨、肝、皮肤皮下组织、眼眶及周围软组织。一些经典的症状和体征与NB的转移有关。如眼球突出及眼眶周围的瘀斑很常见,由肿瘤浸润眶部骨骼和眶周软组织所致。广泛的骨骼扩散和骨髓浸润引起骨痛并致跛行。骨髓转移时常见有贫血、血小板减少。发热也是远处转移的一个常见的表现。
阵挛-肌阵挛综合征(OMS)是一种NB伴瘤综合征,表现为快速眼运动、共济失调和肌阵挛,发生在2%~4%的新诊断的NB患者,预后相对良好,这可能与免疫介导的宿主抗肿瘤反应有关。这些患者中70%~80%会有慢性的神经缺陷表现,包括认知和运动延迟、语言缺陷和行为异常。这些表现可能由于非特异的肿瘤抗体与神经系统的某些成分发生交叉反应而致。OMS的治疗仍然有争议,切除肿瘤会缓解神经症状。
另一伴随症是NB释放血管活性肠肽(VIP)引起的顽固性水样泻,常伴有低钾和低钙。多数释放VIP的NB为成熟的组织类型(神经节母细胞瘤或神经节瘤),肿瘤本身预后往往较好,手术切除肿瘤能完全消除症状。
(二)影像学检查
CT检查是腹部、骨盆及后纵隔原发肿瘤首选的方法,特征性表现为身体中轴二侧的肿块,常有钙化,依次为肾上腺、后腹膜和后纵隔为多见。后腹膜肿块常包绕血管生长(图15-2)。MRI对于检查脊柱旁病变效果更佳,特别是当评估肿瘤是否向神经孔内扩散,并有压迫脊髓的可能时,MRI检查必不可少。同时也应该进行转移病灶的检查,包括全身性99锝骨扫描或间碘苯甲胍(MIBG)、选择性的脊柱和中枢神经系统MRI检查。
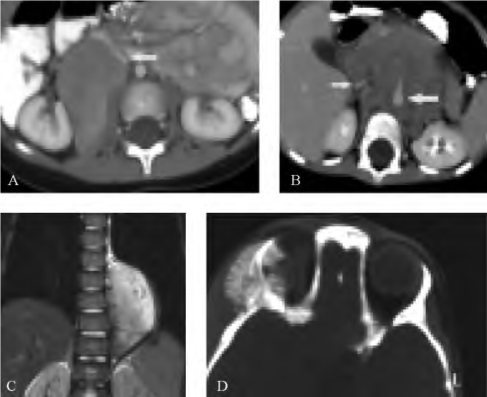
图15-2 NB影像学特征
A.2岁女孩,后腹膜右侧局限性的NB的增强CT扫描;B.3岁男孩,绕主动脉Ⅳ期NB的增强CT扫描;C.6岁女孩,左侧脊柱旁冠状神经节母细胞瘤MRI的T2相;D.眼眶CT的骨窗,NB转移病灶骨膜反应所致的“直发样”现象(图片来自Meyer and Pollock,Children′s Hospital of Philadelphia Department of Radiology)
(三)其他实验室检查
NB分泌儿茶酚胺合成和代谢通路中的多种成分,代谢产物高香草酸和香草扁桃酸(HVA和VMA)检测对NB有很高的特异性和敏感性,约85%患者可阳性,其水平变化为评估治疗反应和随访肿瘤是否复发提供了一种相对可靠的方法。
NB细胞表达神经节苷酯酶(GD2),其免疫表型特征为CD45-/56+81+,前者可采用PCR方法检测,后者可采用流式细胞术检测。两者在NB中有较高的特异性。
血清乳酸脱氢酶(LDH)水平常和身体内肿瘤负荷一致,因此应常规检查,并将其作为随访指标。
骨髓涂片可发现骨髓转移灶,可作为诊断和远程转移的依据,因此治疗前必须完成。当存在远程转移,尤其是骨髓转移时常有贫血和血小板减少。
(四)诊断标准与鉴别
疾病的确诊包括:①影像学有身体中轴二侧钙化性肿块特征。②尿儿茶酚胺代谢产物VMA/HVA增高。③骨髓涂片见有成堆的或称为菊花团样分布的肿瘤细胞(图15-3)。当骨髓涂片见有成堆的或称为菊花团样分布的肿瘤细胞,并有典型的NB影像学表现和VMA/HVA增高时即可明确诊断。组织病理学诊断仍然是最为可靠的诊断手段,尤其在没有骨髓肿瘤浸润(细胞学诊断)情况下,仍然建议组织病理诊断,而不提倡仅通过影像学、VMA和(或)HVA增高来诊断。

图15-3 NB骨髓转移
A.低倍镜下成堆的菊花团样分布的NB细胞;B.高倍镜下成堆的菊花团样分布的NB细胞(见书末彩图)(引自美国血液协会网页)
因NB有许多不同的临床表现,所以容易和其他的肿瘤及非肿瘤疾病相混淆。尤其是5%~15%不分泌儿茶酚胺类代谢产物的患者,或没有找到原发肿瘤的极少数患者,鉴别诊断比较困难。另一方面,NB应该与许多非肿瘤性疾病鉴别,伴有骨弥散病灶的患者应与全身性感染及炎症性疾病相鉴别,比如骨髓炎或类风湿关节炎。VIP综合征易与炎症性肠道疾病混淆,OMS和共济失调综合征类似于原发性的神经系统疾病。肾上腺原发NB也可能被误认为因肾上腺出血所致的肾上腺钙化。肝大的患者必须与多囊肝及代谢性疾病鉴别。病理学上,来自原代或转移的未分化肿瘤组织与其他小圆细胞肿瘤很相似。骨髓转移病灶的鉴别诊断包括横纹肌肉瘤、尤因肉瘤/神经上皮瘤/PNET,淋巴瘤或白血病(特别是小巨核细胞性白血病和淋巴细胞性白血病)。NB细胞表达神经节苷酯酶(GD2),其免疫表型特征为CD45-/56+81+,前者可采用PCR方法检测,后者可采用流式细胞术检测,有助于和其他肿瘤的鉴别诊断。
临床医师必须认识到,获取足够的标本来建立诊断并分析所有预后因素的重要性。当肿瘤不能完全切除时,建议切开活检术,以保证获得足够的标本供病理诊断及相关分子生物学特征评估的需要。细针活检常常不能获得足够的标本。
六、分期和临床分组
早期研究证实,Evans/CCG和POG分期系统对于制订治疗计划和预后评估都很有帮助。但相互间及与其他分期系统之间也存在分歧,尤其是在Ⅱ/Ⅲ期患者中差异较大。国际NB协作组建立了INSS分期标准,用于临床和生物学研究,已得到全世界的广泛认可。INSS分期保留了CCG和POG大多数有用的部分,不同之处主要在POG的C期和INSS的3期。另一方面,部分EvansⅡ期甚至Ⅲ期患者肿瘤可以完全切除,在INSS中可能被分为1期。这些差异对治疗的选择、预后的评估和疗效的比较十分重要。
(一)INSS分期标准(表15-1)
1期外科切除的局灶肿瘤,切除边界上允许有光镜下可见的残留肿瘤细胞。2期局灶肿瘤,肉眼可见残留病灶(2A)或局灶肿瘤伴有同侧淋巴结浸润(2B)。但目前没发现2A和2B的预后有显著差异。单侧肿瘤,同时伴有同侧的胸腔积液的患者也属于2期。3期肿瘤跨过中线浸润,表现为直接的扩展或淋巴结受累。大多数3期肿瘤位于腹部,因为胸腔中跨中线的连续浸润或淋巴结受累更少见。远处淋巴结、骨、骨髓、肝和或其他器官的转移为4期(除外4S期)。4S期(等同于Ⅳ-S或DS)是一个特殊的分期,这类患者往往会有很好的预后,同时最近的生物学证据能把此类患者与4期的婴儿区分开。例如,大多数4S期肿瘤有超二倍体DI和少于10倍的N-MYC扩增,而婴儿4期却不具有这些特征,DI通常为二倍体,N-MYC扩增占1/3。骨髓受累是指肿瘤细胞少于所有骨髓有核细胞的10%。伴有更广泛的骨髓浸润的患者应该归为4期。
表15-1 国际神经母细胞瘤分期系统(INSS)

a.正中线定义为脊柱。起源于一侧的肿瘤“跨越中线”必须浸润到或者超越脊柱对侧边缘;b.4S期的骨髓受累必须是微量的,即肿瘤细胞少于所有有核细胞的10%,更加广泛的骨髓受累应该归为4期,MIBG扫描应为阴性
(二)分组
临床上主要根据与预后相关的危险因素进行分组,COG分组标准见表15-2。主要的危险因素包括以下方面。
1.年龄 一般对于预后的分界点是12个月,并已经证实其临床应用价值。近来CCG和POG的回顾性研究也得到了类似的结论,而且年龄<18个月同时没有N-MYC扩增的患儿预后也明显不同于其他>18个月INSS 4期,据此在今后的临床中应进一步研究减轻这部分患者化疗强度的安全性。
2.分期 INSS分期与患者的预后明确相关,被所有的协作组应用以指导分层治疗。多数INSS 1期的患者仅手术治疗,而多数INSS 4期患者要接受中到高强度的综合性治疗。INSS 2期和3期患者的最合适治疗则取决于包括生物学特征的其他因素。INSS 2A期和2B期预后没有明显的差异。随着遗传学和生物学特点越来越全面,在确定治疗计划时,我们可能更少依赖于肿瘤分期。
3.N-MYC扩增 N-MYC扩增是肿瘤特异性遗传信息临床应用的最好例证。N-MYC扩增状态不同,预后差异大。如对INSS 4期的婴儿的预后影响很大。
4.肿瘤细胞的倍体状态(DI) COG将DI用以指导分层治疗的5个主要因素中,但DI的预后影响最受限制,因为单变量分析中,它对预后的影响最不显著,而多变量分析没有意义。
5.病理学 INPC根据肿瘤组织中基质成分、分化程度、MKI和患者年龄把肿瘤分为“良好”组和“不良”组。该系统更明确地把结节性神经节瘤定义为良好的病理亚型。年龄作为INPC中关键性的协同变量,因此病理亚型本身对预后影响的独立价值仍有争论。分型标准见病理章节。
6.其他 NB细胞中的许多遗传学改变,也可能作为有用的预后指标。其中1p和11q的缺失最可能整合到临床危险度分组中。
表15-2 COG临床危险度分组标准

七、治 疗
NB的主要治疗方法有手术、化疗和放疗。化疗的强度、手术方式与时间、放疗的方式均需在完成每个患者的评估后才能确定,需要同时考虑患者的分期、年龄和肿瘤的病理学及生物学特点。
(一)整体治疗方案
与其他儿童实体瘤相似,儿童NB初诊时如经评估肿瘤可完全切除,则首先手术切除肿瘤,术后根据临床分组接受与临床危险组别相适应的后续治疗。>12个月时如手术不能完全切除或存在远程转移则先进行化疗,在远程转移灶消失、原发灶可切除时进行手术,一般在化疗4个疗程左右进行手术,通常这些患者需要联合放疗、自体造血干细胞移植、化疗结束后全顺维A酸诱导分化治疗,有条件时尚可联合MIBG和单抗(抗神经节苷脂酶2)靶向治疗。
(二)手术
手术在NB的诊断和治疗中都起重要作用。最初的外科操作目的是要建立诊断、为生物学检测提供标本,为肿瘤分期提供有效信息。在条件许可下,考虑完全切除肿瘤而不损伤重要脏器。延迟的手术或二次探查手术则主要是判断治疗反应及切除残留病灶。由于化疗能有效地缩小原发肿瘤和转移性病灶的体积,使延迟手术风险减少而完全切除的可能增加,因此,在诊断时即进行高创伤的部分肿瘤切除的做法已经不提倡,尤其是在小龄儿童中更不提倡。
(三)放疗
NB是一种对放疗敏感的肿瘤,但由于NB经常有临床可检测到和检测不到的转移病灶,局部放疗的疗效受到影响,单纯放疗不能治愈NB。公认的肿瘤细胞致死的射线剂量为15~30Gy,取决于患者的年龄、肿瘤的体积和肿瘤的位置。分次辐射剂量为150~400cGy,同样与肿瘤体积有关。目前放疗主要用于非婴儿Ⅲ、Ⅳ期患者局部病灶的控制。最近,随着联合化疗的进步,放疗在低危组和中危组中应用逐渐减少。
Castleberry等报道对有局灶淋巴结转移(INSS 2B期和3期)的患者是否需要放疗进行随机研究,评估环磷酰胺/多柔比星化疗加局部放疗(24~30Gy)对预后的影响,结果提示接受同样化疗的患者,同时接受放疗CR率(76%vs 46%,P=0.013),EFS(59%vs 32%,P=0.009)和生存率(73%vs41%,P=0.008)均提高。但是如果给予更大剂量的化疗,同时考虑N-MYC的扩增情况,这个结论就不再成立,说明在这组患者中放疗的作用可由更精细的临床危险因素分组和化疗替代。因此,目前大多数协作组织不再对大部分中危组患者进行放疗,但如果手术和化疗后肿瘤仍进展,或在化疗结束时,原发肿瘤还不能切除,同时生物学特征提示预后不良仍可以考虑放疗。对高危组患者,放疗不仅用于原发肿瘤的局部控制,也用于不敏感的转移病灶,一般给予20~30Gy,多数医院分次给予,每天的剂量为180~200cGy。
(四)化疗
化疗是中、高危组NB患者主要的治疗方法之一,同时也用于有重要脏器受累症状的Ⅳs期。烷化剂、蒽环类、铂类、鬼臼药物在本病中有效。最近发现,喜树碱类药物托泊替康对复发病例有效,也是治疗NB的有效药物。
1.危险度分组、不同强度分层化疗 大量的资料支持根据对明确的有预后影响的因素分析把患者分为不同的危险组进行相应的治疗。目前COG根据患者年龄、INSS病理类型、DI和N-MYC扩增状态定义了3个主要危险组等级,根据分组进行分层治疗。随着研究进展,分组也会不断改进更趋合理。
(1)低危组的治疗:根据COG分类系统,低危组定义为:①所有的INSS 1期患者;②INSS 2期,但必须<1岁并无N-MYC扩增、Shimada病理良好类型的患者;③4S期婴儿,肿瘤细胞为超二倍体、Shimada病理类型良好和单拷贝N-MYC。低危组NB的治疗主要是原发肿瘤的手术切除。INSS 1期肿瘤(大体全部切除),无论年龄如何,无复发生存率可达到90%以上。
绝大多数INSS 2期NB初始治疗也选择单纯手术治疗。以前大部分患者接受化疗,预后很好。在前瞻性的CCG研究中,233例EvansⅡ期无N-MYC扩增的患者只进行了手术治疗,4年EFS为81%,大部分复发患者可以挽救,所以4年OS为98%。所以即使是显微镜下有残留病灶,也并不一定提倡INSS 2期患者进行化疗和放疗。
关于如何更合理处理INSS 1期或2期伴有N-MYC扩增的NB仍有争议。绝大部分INSS 4S期患者归为低危组。但如4S期患者伴有不利的生物学特征如N-MYC扩增,往往肿瘤进展迅速或复发,类似于4期肿瘤。对伴有有利的生物学特征的患者要密切关注其因肿瘤扩展带来的症状,特别是<2~3个月的婴儿。如果呼吸困难等症状很明显,可给予适当强度的化疗。
(2)中危组治疗:COG将以下患者归类为此组:①INSS 3期<1岁并无N-MYC扩增;②INSS 3期>1岁没有N-MYC扩增,同时Shimada病理学类型良好;③4期没有N-MYC扩增的婴儿;④4S期非N-MYC扩增,Shimada组织病理类型不利或DI为1(或两者都具备)的患者。由于以前分期及分组系统之间的差异,各协作组之间治疗结果很难对比。
中危组化疗一般采用包括环磷酰胺、多柔比星、顺铂和依托泊苷的化疗,手术后对肉眼残留病灶进行局部放疗。4年EFS可达75%以上。多因素分析的结果显示诊断时年龄和NMYC扩增是该组患者唯有的独立预后因素。绝大多数INSS 4期NB婴儿目前归为中危组。有转移病灶同时N-MYC扩增的婴儿均表现高度恶性的临床进程,所以归为高危组。而无NMYC扩增的婴儿,其恶性程度减弱,并对中危组化疗敏感。最近CCG的研究报道无N-MYC扩增的INSS4期婴儿接受中危组化疗,3年EFS为93%。而伴有N-MYC扩增的这类婴儿在更强的化疗下EFS仅为10%。
总之,所有资料都支持中危组NB的治疗方法主要为适度的化疗,而大部分患者要避免高创伤的根治性手术和放疗。目前COG中危组方案包括卡铂、依托泊苷、环磷酰胺和多柔比星的联合化疗。
(3)高危组的治疗:下列患者划分为高危组。①INSS 4期>1岁的患者;②任何INSS 3期有N-MYC扩增的患者;③INSS 3期年龄>1岁,同时Shimada病理类型不良;④INSS 2期伴N-MYC扩增和不良的Shimada病理类型;⑤INSS 4S期伴N-MYC扩增的患者。
过去高危NB患者长期生存率<15%。随着综合性治疗方法的进步,如加强的化疗、自身造血干细胞支持下清髓性化疗、微小残留病灶的靶向治疗,总的生存率得到改善(表15-3、表15-4),但是仍然不令人满意。高危NB化疗包括诱导和巩固治疗。
①诱导治疗:在肿瘤的初治阶段,治疗的目标是最大限度地杀灭原发和转移肿瘤,使肿瘤负荷和体积缩小,转移病灶消失。诱导化疗后进行肿瘤根治性手术,诱导化疗的有效性通过手术后的缓解率来反映,包括完全缓解(CR)、非常好的部分缓解(VGPR)和部分缓解(PR)(表15-5)。诱导化疗缓解的质量与长期生存率相关,诱导化疗后获得CR或VGPR者获得治愈的机会更大。从美国的经验中可以总结出高总剂量强度的化疗方案使诱导化疗的缓解率增高,特别是含有高剂量的铂类化合物(表15-3),但治疗相关并发症也会增加。
②巩固治疗:诱导治疗后通过巩固治疗清除残留肿瘤,来巩固诱导化疗期间获得的缓解,通常使用自体造血干细胞支持下的清髓性化疗来清除耐药性肿瘤细胞。据于非随机对照、历史对照及随机分组研究,提示自体造血干细胞支持下的超剂量化疗使生存率提高(表15-4)。
表15-3 诱导化疗方案(来自POG和CCG协作组的临床试验)

表15-4 巩固治疗(自身干细胞移植)和3y-EFS(POG和CCG协作组的临床试验)

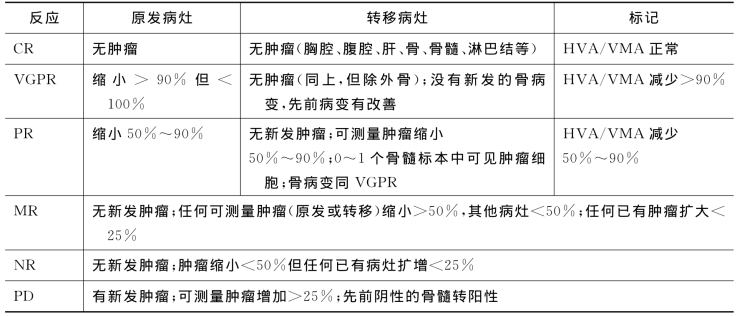
表15-5 治疗反应的判定标准
CR.完全缓解;VGPR.很好的部分缓解;PR.部分缓解;MR.混合缓解;NR.不缓解;PD.肿瘤进展
2.复发性疾病的治疗 对于低、中危组只有局灶复发的患者,通常再次手术,术后适当化疗后仍可获得良好的预后。但是对于高危NB患者,无论是原位复发还是转移性复发,治疗仍然是一个很严峻的挑战,尚没有发现确实有效的手段。
3.新的细胞毒性药物 喜树碱类似物拓扑替康和伊立替康是1型拓扑异构酶毒性药物,并且已经证明其对复发NB有作用。最近随机对照研究显示,拓扑替康与低剂量环磷酰胺联合5d给药比仅用拓扑替康疗效好,缓解率(CR+PR)分别为31%和19%,许多患者病灶稳定。由于患者对此药物组合耐受较好,许多人考虑将其作为高危NB患者第一次复发的一线治疗。
(五)其他治疗方法进展
1.微小残留病灶的治疗 尽管诱导化疗的缓解率有了提高,清髓性巩固治疗后通过传统的方法未能检测到任何病灶,使高危组预后有所改善,但是大部分高危NB患者还会复发,提示清髓性巩固治疗后还存在微小残留病灶。另外复发肿瘤有高度耐药,特异性针对NB生物学特征的药物对清除微小残留病灶有效。顺式维A酸能诱导体内NB细胞分化,同时使肿瘤细胞增殖减低。13-顺维A酸的最大耐受剂量为160mg/(m2·d),分2次口服。COG报道移植后接受13-顺维A酸治疗的患者EFS提高(46%±6%vs.29%±6%;P=0.027)。直接针对NB特异性细胞抗原分子的靶向治疗对微小残留病灶的清除很有应用前景,鼠源性、嵌合体、与人源化抗NB神经节苷酯GD2抗体应用研究目前正在进行中,已提示可能改善临床疗效。
2.放射性核素的靶向传送治疗 一般NB对放疗敏感,但由于病灶通常是全身性的,因此限制了放疗的应用。放射性核素通过对NB细胞的特有亲和力和NB细胞靶向结合,并杀伤靶细胞,其中MIBG在一些已经完成或正在进行中的临床试验中赢得了最大的关注,目前对I-MIBG的临床试验主要研究能否将其整合到初治方案中。
3.免疫治疗 NB的免疫治疗策略最初是基于NB自发消退的现象,提示宿主对NB有免疫排斥或杀伤反应。此外,在NB中也观察到淋巴细胞浸润肿瘤现象,特别是伴有OMS的患者,这些现象推进了免疫治疗的假设。如前所述,针对神经母肿瘤细胞特异细胞表面GD2分子的抗体引起了广泛的关注,并且已经在接受Ⅲ期临床试验检测。
4.血管抑制药 NB是一种血管丰富的肿瘤,血管供应的程度与生物学特征和N-MYC扩增有关,促血管生成因子也会在高危肿瘤中过表达。低危肿瘤基质成分丰富,而基质能产生抗血管生成因子。目前一些中和循环中血管上皮生成因子(VEGF)的抗体正在临床试验中。
5.酪氨酸激酶抑制药 NB的BDNF-TrkB自分泌途径可能是一个好的治疗靶点。Evans等报道当加入针对Trk酪氨酸激酶的小分子抑制物时,人NB细胞株会表现出明显的生长抑制,从而为临床Ⅱ期试验提供理论基础。
(六)NB治疗中的并发症
许多肿瘤治疗中的并发症也可以发生在NB,这些并发症包括化疗、放疗、手术的晚期效应。低危组患者可能仅有手术的并发症,由于这组患者的预后很好,手术的创伤应该减到最小。中危组的患者要接受手术治疗和中强度的化疗。近来对中危组的化疗有逐渐减弱的倾向,以尽量避免中危组治疗相关并发症。
高危组患者发生治疗并发症的可能性最大。幸存者可能合并严重的长期健康问题,如使用含有铂类化合物方案可造成严重的神经性聋,烷化剂和拓扑异构酶Ⅱ抑制药可能导致不孕不育及第二肿瘤发生率的增加,特别是骨髓增生异常综合征和急性非淋巴细胞白血病。
已经有报道NB长期生存者再次肿瘤发生率增高,如甲状腺癌、嗜铬细胞瘤、脑肿瘤、急性白血病、骨肉瘤、乳腺癌和肾细胞肿瘤,没有特异的第二肿瘤危险度的增加。
八、NB筛查对预后影响研究
因为NB伴有儿茶酚胺代谢产物VMA和HVA的增加并通过尿液排出,因此可以通过不高的检测费用进行尿液筛查,从而期望能早期诊断NB。对婴儿NB的筛查工作最早在日本开展,之后加拿大的魁北克、法国和德国也进行了NB的筛查工作。结果显示婴幼儿大规模筛查后,筛查人群相对于非筛查人群NB的诊断率(发病率)明显增加,但是没有证实由于婴儿期NB诊断率的增加而使>1岁儿童中NB的发病率和病死率减少,并因此而停止大规模的筛选工作。
尽管大规模筛选未能降低NB的病死率,但是通过筛查对于NB生物学特征对临床预后的影响有了更好的理解,如在筛查的人群中NB发病率明显增加,而未筛查人群中实际临床发病率远低于筛查人群,证明了部分NB的自发性消退特征。另外,对筛查出的肿瘤进行的生物学研究显示所有经筛查而诊断的NB的生物学特征均良好,DI在超二倍体和亚三倍体之间,N-MYC拷贝数正常。这种现象与临床上较大儿童的NB经常伴有不利的生物学特征形成对比。
(汤静燕)
参考文献
[1]Brodeur GM,Maris JM.Neuroblastoma∥Pizzo PA,Poplack DG.Principles and practice of pediatric oncology.5th ed.Philadelphia:JB Lippincott,2006:933-970
[2]Maris JM,Weiss MJ,Mosse Y,et al.Evidence for a hereditary neuroblastoma predisposition locus at chromosome 16p12-13.Cancer Res,2002,62:6651-6658
[3]Origone P,Defferrari R,Mazzocco K,et al.Homozygous inactivation of NF1gene in a patient with familial NF1and disseminated neuroblastoma.Am J Med Genet,2003,118A:309-313
[4]Weese-Mayer DE,Berry-Kravis EM,Zhou L,et al.Idiopathic congenital central hypoventilation syndrome:analysis of genes pertinent to early autonomic nervous system embryologic development and identification of mutations in PHOX2b.Am J Med Genet,2003,123A:267-278
[5]Satge D,Moore SW,Stiller CA,et al.Abnormal constitutional karyotypes in patients with neuroblastoma:a report of four new cases and review of 47others in the literature.Cancer Genet Cytogenet,2003,147:89-98
[6]White PS,Thompson PM,Seifried BA,et al.Detailed molecular analysis of 1p36in neuroblastoma.Med Pediatr Oncol,2001,36:37-41
[7]Mosse Y,Greshock J,King A,et al.Identification and high-resolution mapping of a constitutional 11q deletion in an infant with multifocal neuroblastoma.Lancet Oncol,2003,4:769-771
[8]Reiter JL,Brodeur GM.MYCN is the only highly expressed gene from the core amplified domain in human neuroblastomas.Genes Chromosomes Cancer,1998,23:134-140
[9]Plantaz D,Mohapatra G,Matthay KK,et al.Gain of chromosome 17is the most frequent abnormality detected in neuroblastoma by comparative genomic hybridization.Am J Pathol,1997,150:81-89
[10]Seeger RC,Brodeur GM,Sather H,et al.Association of multiple copies of the N-myc oncogene with rapid progression of neuroblastomas.N Engl J Med,1985,313:1111-1116
[11]Nakagawara A,Azar CG,Scavarda NJ,et al.Expression and function of TRK-B and BDNF in human neuroblastomas.Mol Cell Biol,1994,14:759-767
[12]George RE,London WB,Cohn SL,et al.Hyperdiploidy plus nonamplified MYCN confers a favorable prognosis in children 12to 24months of age with disseminated neuroblastoma:a Pediatric Oncology Group Study.J Clin Oncol,2005,23(27):6466-6473
[13]Joshi VV,Cantor AB,Altshuler G,et al.Age-linked prognostic categorization based on a new histologic grading system of neuroblastomas.A clinicopathologic study of 211cases from the Pediatric Oncology Group.Cancer,1992,69:2197-2211
[14]Haas-Kogan DA,Swift PS,Selch M,et al.Impact of radiotherapy for high-risk neuroblastoma:a Children’s Cancer Group study.Int J Radiat Oncol Biol Phys,2003,56:28-39
[15]Castleberry RP,Cantor AB,Green AA,et al.Phase II investigational window using carboplatin,iproplatin,ifosfamide,and epirubicin in children with untreated disseminated neuroblastoma:a Pediatric Oncology Group Study.J Clin Oncol,1994,12:1616-1620
[16]Ladenstein R,Philip T,Lasset C,et al.Multivariate analysis of risk factors in stage 4neuroblastoma patients over the age of one year treated with megatherapy and stem-cell transplantation:a report from the European Bone Marrow Transplantation Solid Tumor Registry.J Clin Oncol,1998,16:953-965
[17]Evans AE,August CS,Kamani N,et al.Bone marrow transplantation for high risk neuroblastoma at the Children’s Hospital of Philadelphia:an update.Med Pediatr Oncol,1994,23:323-327
[18]Garaventa A,Luksch R,Biasotti S,et al.A phase II study of topotecan with vincristine and doxorubicin in children with recurrent/refractory neuroblastoma.Cancer,2003,98:2488-2494
[19]Okamatsu C,London WB,Naranjo A,et al.Clinicopathological characteristics of ganglioneuroma and ganglioneuroblastoma:a report from the CCG and COG.Pediatr Blood Cancer,2009,53(4):563-569
[20]London WB,Castleberry RP,Matthay KK,et al.Evidence for an age cutoff greater than 365days for neuroblastoma risk group stratification in the Children′s Oncology Group.J Clin Oncol,2005,23(27):6459-6465
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














