实验四 动起来的蛋白质分子——蛋白质三维动态分子电影
蛋白质是一种由20种氨基酸以肽键连接而成的生物大分子,这种肽链称为蛋白质的一级结构。不同蛋白质肽链的长度不同,氨基酸的组成和排列也各不相同。肽链在空间卷曲折叠成为特定的三维空间结构,包括二级结构和三级结构两个主要层次。有的蛋白质由多条肽链组成,每条肽链称为亚基,亚基之间又有特定的空间关系,称为蛋白质的四级结构。所以蛋白质分子有非常特定的复杂空间结构。一般认为,蛋白质的一级结构决定二级结构,二级结构决定三级结构。
蛋白质的生物学功能在很大程度上取决于其空间结构,蛋白质结构构象多样性导致了不同的生物学功能。蛋白质分子只有处于它自己特定的三维空间结构情况下,才能获得它特定的生物活性;三维空间结构稍有破坏,就很可能会导致蛋白质生物活性的降低甚至丧失。因为它们的特定的结构允许它们结合特定的配体分子,例如,血红蛋白和肌红蛋白与氧的结合、酶和它的底物分子、激素与受体以及抗体与抗原等。蛋白质是药物作用的靶标,联合运用基因编码和蛋白质结构信息,药物设计者可以设计出小分子化合物,抑制与疾病相关的蛋白质,进而达到治疗疾病的目的。
1.蛋白质一级结构(primary structure)
蛋白质一级结构是指多肽链的氨基酸残基的排列顺序,也是蛋白质最基本的结构,由编码基因遗传密码的排列顺序所决定。
表5-3中,胰岛素(Insulin)由51个氨基酸残基组成,分为A、B两条链,其中A链21个氨基酸残基,B链30个氨基酸残基。A、B两条链之间通过两个二硫键联结在一起,A链另有一个链内二硫键。
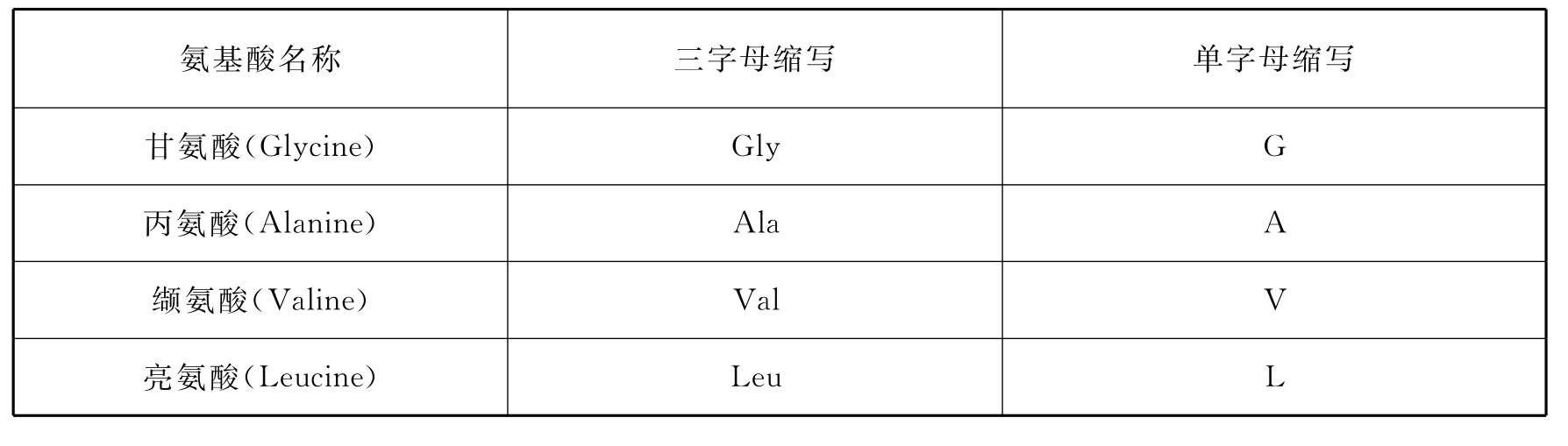
表5-3 组成蛋白质的20种常见氨基酸
续 表
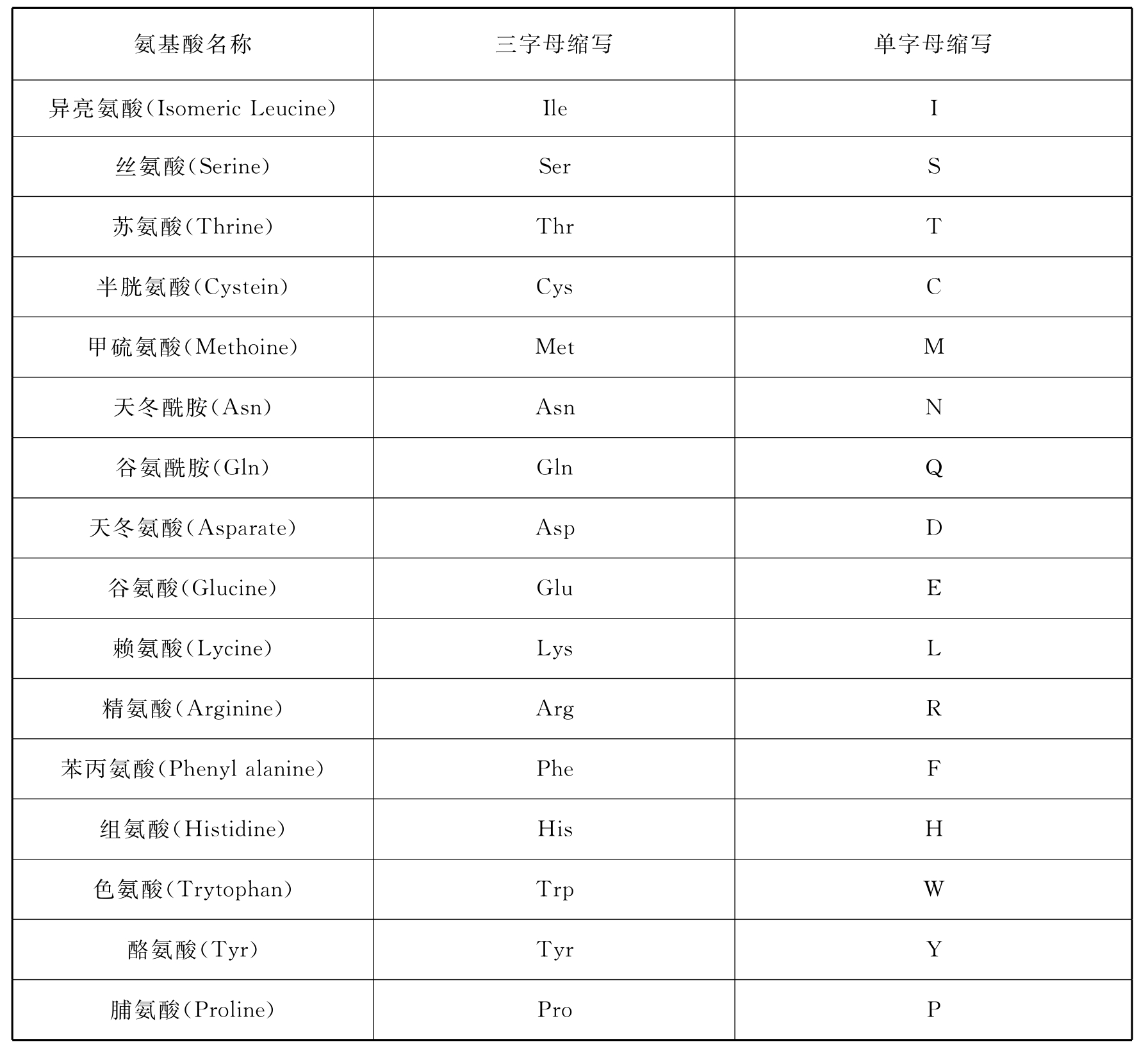
图5-38 胰岛素的一级结构及不同动物胰岛素在A链中的差异
2.蛋白质二级结构(secondary structure)
二级结构是指多肽链借助于氢键沿一维方向排列成具有周期性的结构的构象,是多肽链局部的空间构象,目前主要分为α-螺旋、β-折叠、β-转角等几种形式,它们是构成蛋白质高级结构的基本要素。
α-螺旋(α-helix)是蛋白质中最常见、最典型和含量最丰富的二级结构元件。在α-螺旋中,每1个螺旋周期包含3.6个氨基酸残基,残基侧链伸向外侧,同一肽链上的每个残基的酰胺氢原子和位于它后面的第4个残基上的羰基氧原子之间形成氢键。这种氢键大致与螺旋轴平行。一条多肽链呈α-螺旋构象的推动力就是所有肽键上的酰胺氢和羰基氧之间形成的链内氢键。在水环境中,肽键上的酰胺氢和羰基氧既能形成内部(α-螺旋内)的氢键,也能与水分子形成氢键。如果后者发生,多肽链呈现类似变性蛋白质那样的伸展构象。疏水环境对于氢键的形成没有影响,因而更可能促进α-螺旋结构的形成(图5-39)。
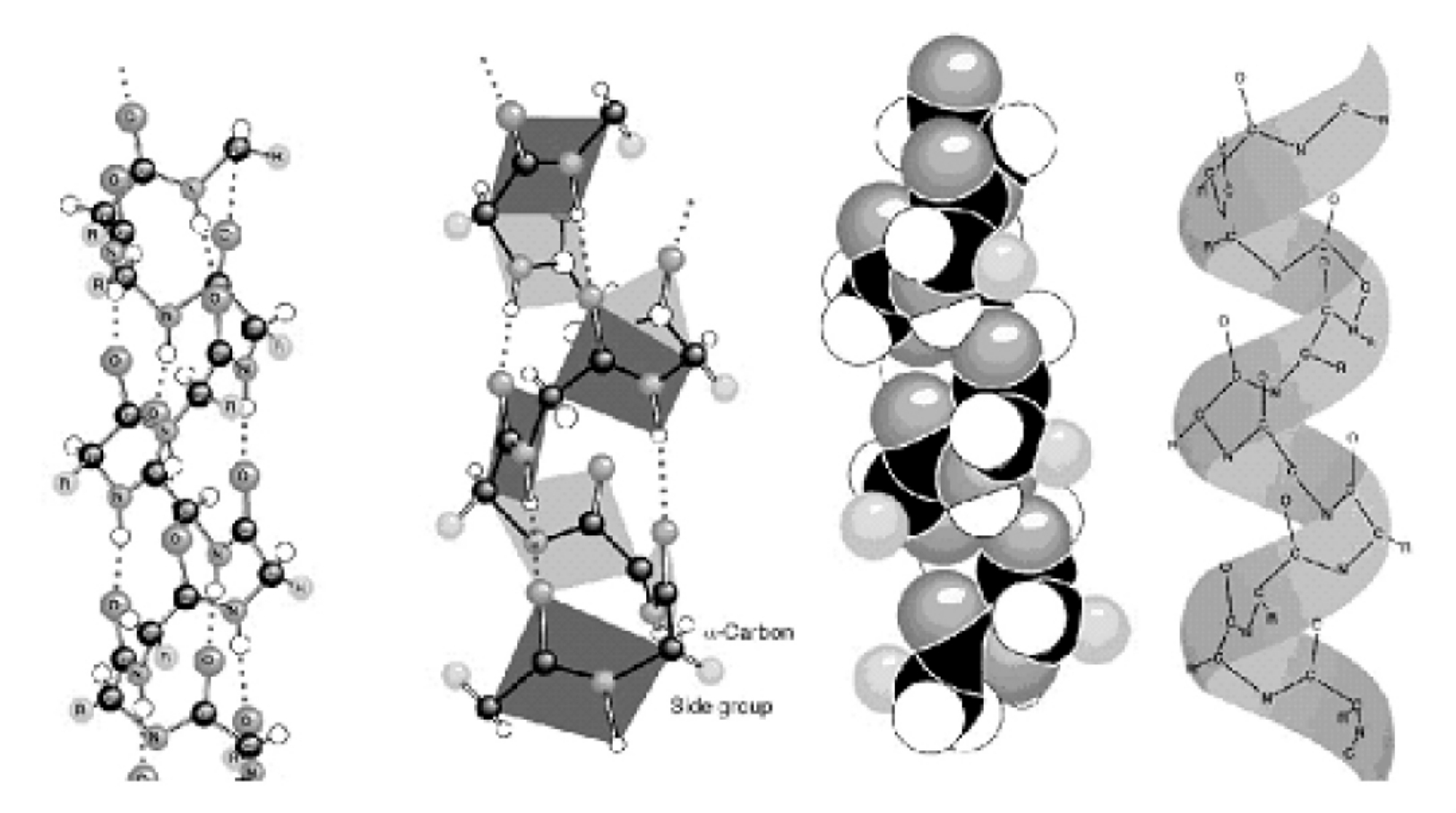
图5-39 四种不同的α-螺旋
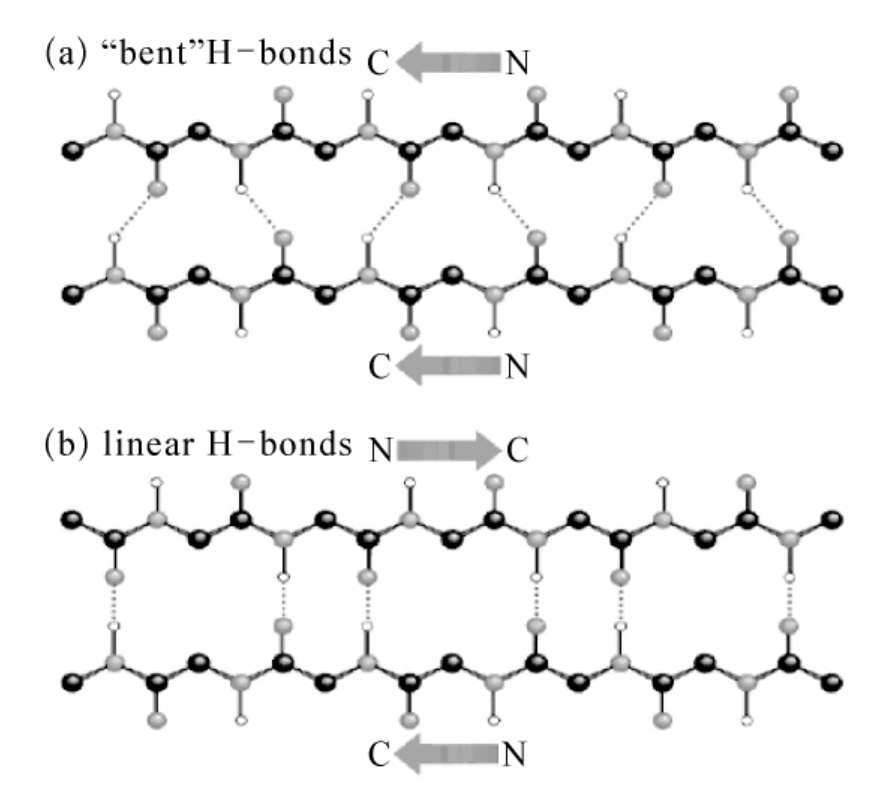
图5-40 β-折叠中氢键的排列
β-折叠(β-sheet)也是一种重复性的结构,可分为平行式和反平行式两种类型。它们通过肽链间或肽段间的氢键维系,可以把它们想象为由折叠的条状纸片侧向并排而成,每条纸片可看成是一条肽链,称为β-折叠股或β-股(β-strand),肽主链沿纸条形成锯齿状,处于最伸展的构象,氢键主要在股间而不是股内。α-碳原子位于折叠线上,由于其四面体性质,连续的酰氨平面排列成折叠形式。需要注意的是,在折叠片上的侧链都垂直于折叠片的平面,并交替地从平面上下两侧伸出。平行折叠片比反平行折叠片更规则且一般是大结构而反平行折叠片可以少到仅由两个β-股组成(图5-40)。
β-转角(β-turn)是种简单的非重复性结构。在β-转角中第一个残基的C═O与第四个残基的N—H氢键键合形成一个紧密的环,使β-转角成为比较稳定的结构,多处在蛋白质分子的表面,在这里改变多肽链方向的阻力比较小。β-转角的特定构象在一定程度上取决于它的组成氨基酸,某些氨基酸如脯氨酸和甘氨酸经常存在其中,由于甘氨酸缺少侧链(只有一个H),在β-转角中能很好地调整其他残基的空间阻碍,因此是立体化学上最合适的氨基酸;而脯氨酸具有换装结构和固定的角,因此在一定程度上迫使β-转角形成,促使多肽自身回折,这些回折有助于反平行β-折叠片的形成(图5-41)。
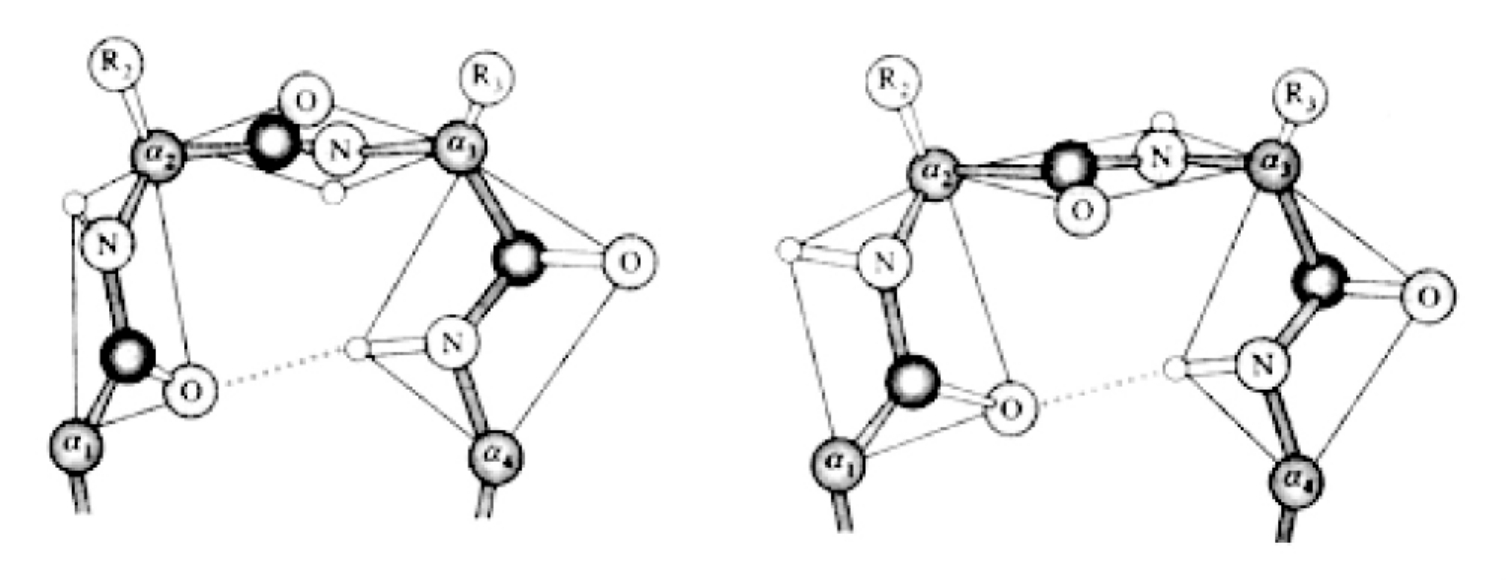
图5-41 两种主要的β-转角
其他常见的二级结构元件还有β-凸起(β-bugle)、无规则卷曲(random coil)等(图5-42)。
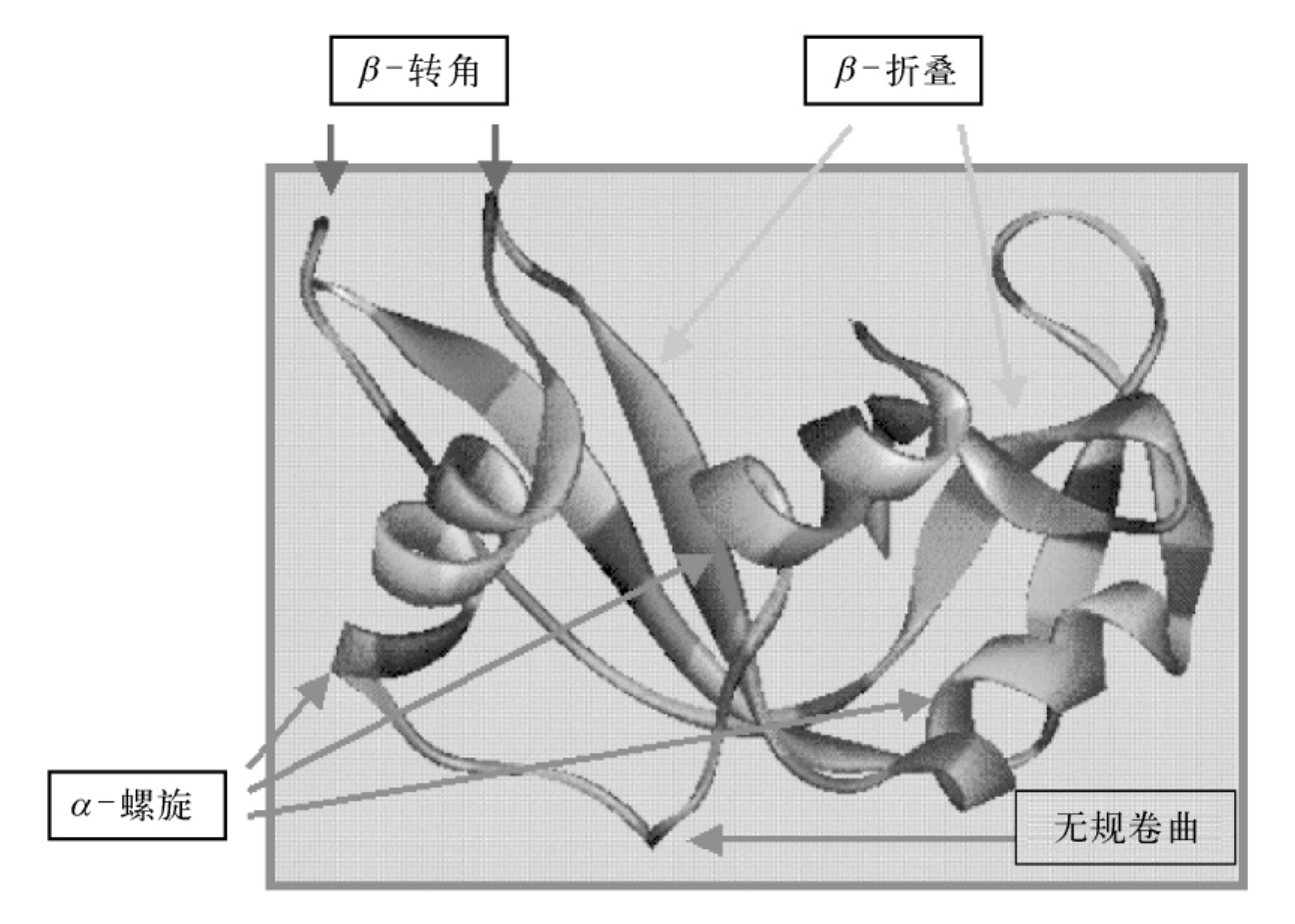
图5-42 RNase的某些二级结构
蛋白质可分为纤维状蛋白和球状蛋白。纤维状蛋白通常是水不溶性的,在生物体内往往起着结构和支撑的作用;这类蛋白质的多肽链只是沿一维方向折叠,β-折叠以反式平行为主且折叠片氢键主要是在不同肽链之间形成。球状蛋白一般都是水溶性的,是生物活性蛋白;它们的结构比起纤维状蛋白来说要复杂得多。α-螺旋和β-折叠在不同的球状蛋白质中所占的比例是不同的,平行和反平行β-折叠几乎同样广泛存在,既可在不同肽链或不同分子之间形成,也可在同一肽链的不同肽段(β-股)之间形成。β-转角、卷曲结构或环结构也是它们形成复杂结构不可缺少的。
3.三级结构(tertiary structure)
三级结构主要针对球状蛋白质而言,是指整条多肽链由二级结构元件构建成的总三维结构,包括一级结构中相距远的肽段之间的几何相互关系,骨架和侧链在内的所有原子的空间排列。在球状蛋白质中,侧链基团的定位是根据它们的极性安排的。蛋白质特定的空间构象是由氢键、离子键、偶极与偶极间的相互作用、疏水作用等作用力维持的,疏水作用是主要的作用力。有些蛋白质还涉及二硫键。如果蛋白质分子仅由一条多肽链组成,三级结构就是它的最高结构层次(图5-43,图5-44)。
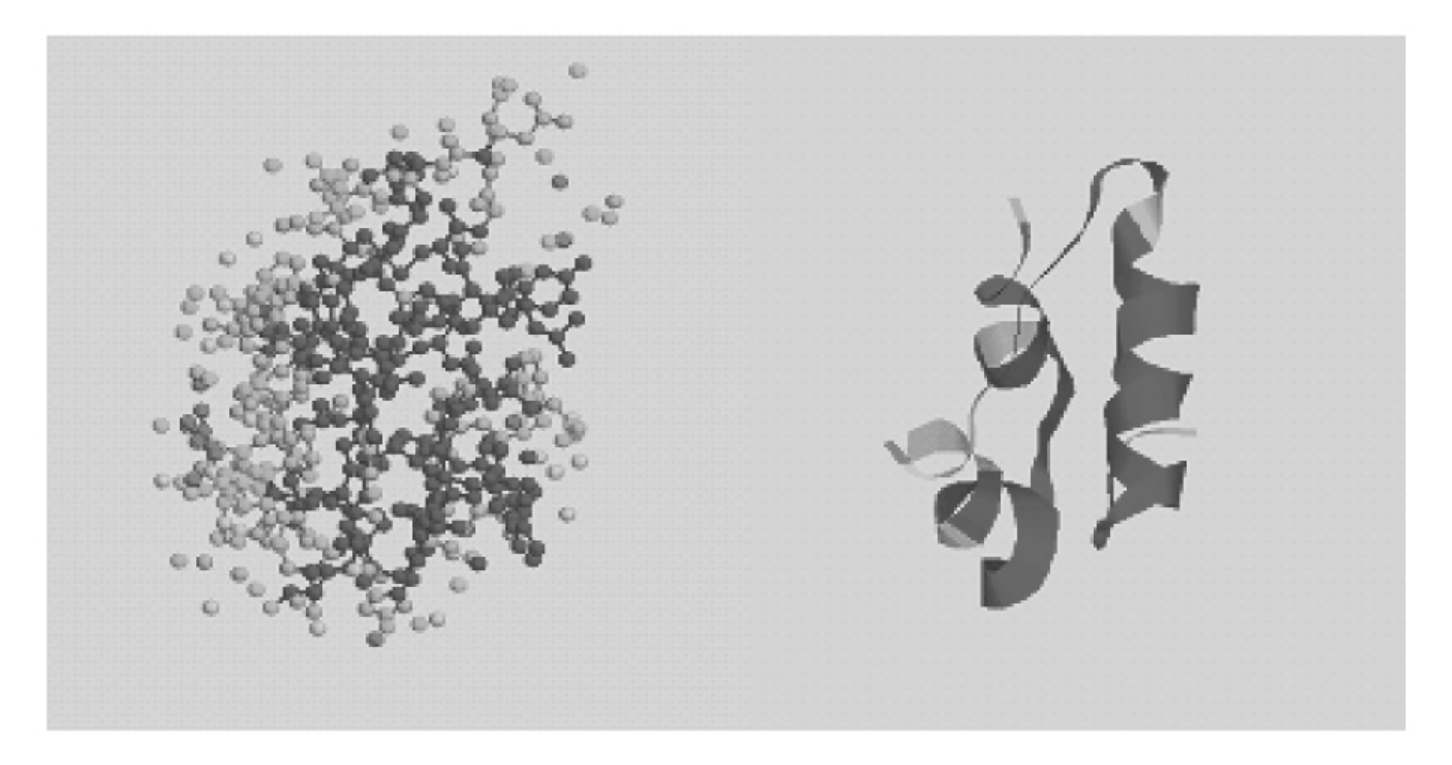
图5-43 胰岛素的三级结构
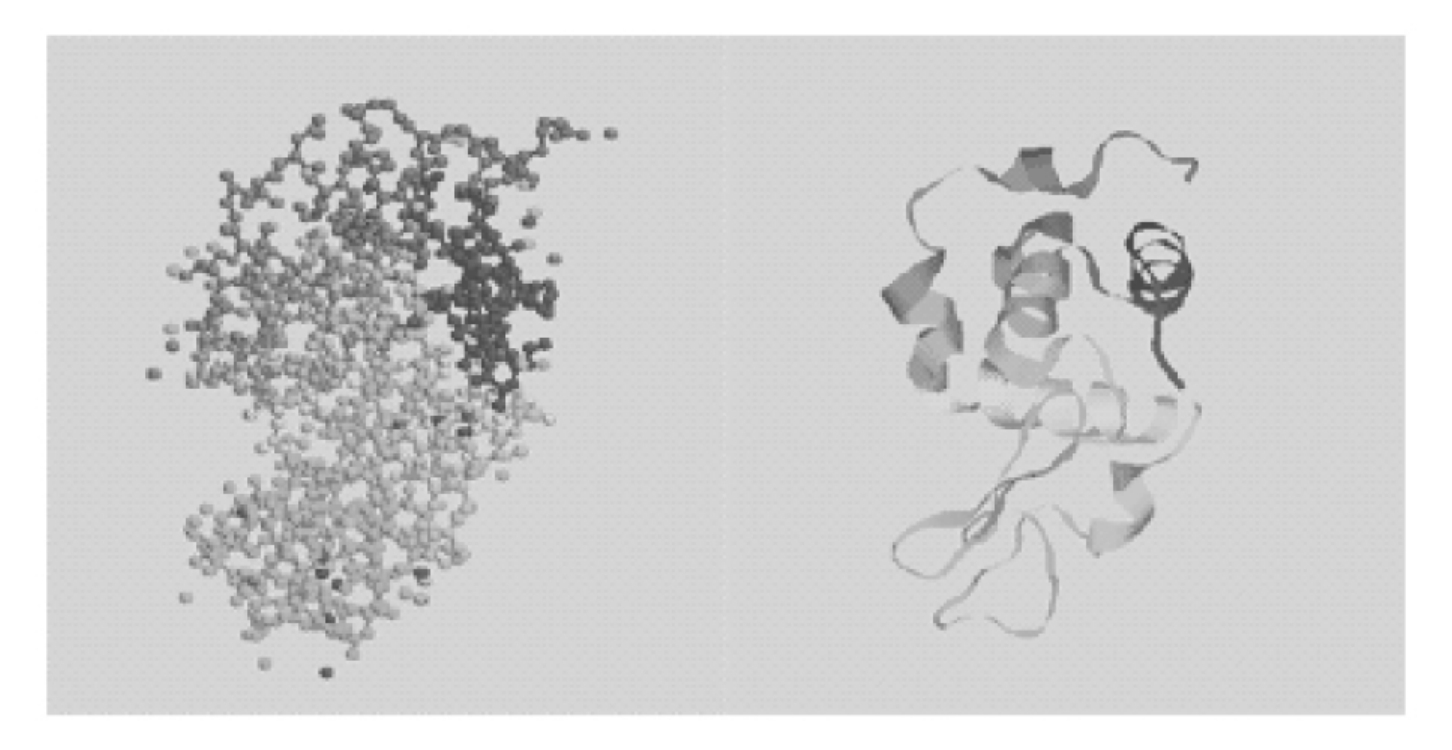
图5-44 溶菌酶分子的三级结构
蛋白质的折叠是有序的,由疏水作用力推动的协同过程。伴侣分子在蛋白质的折叠中起着辅助性的作用。蛋白质多肽链在生理条件下折叠成特定的构象是热力学上的一种有利的过程。折叠的天然蛋白质在变性因素影响下,变性失去活性。在某些条件下,变性的蛋白质可能会恢复活性。
4.四级结构(quaternary structure)
四级结构是指在蛋白质多个亚基之间通过疏水作用等次级键结合成为有序排列的特定的空间结构。四级结构的蛋白质中每个球状蛋白质称为亚基,亚基通常由一条多肽链组成,有时含两条以上的多肽链,单独存在时一般没有生物活性。亚基有时也称为单体(monomer),仅由一个亚基组成的无四级结构的蛋白质如核糖核酸酶称为单体蛋白质;由两个或两个以上亚基组成的蛋白质统称为寡聚蛋白质、多聚蛋白质或多亚基蛋白质。多聚蛋白质可以由单一类型的亚基组成,称为同多聚蛋白质;也可以由几种不同类型的亚基组成称为杂多聚蛋白质。对称的寡居蛋白质分子可视为由两个或多个不对称的相同结构成分组成,这种相同结构成分称为原聚体或原体(protomer)。在同多聚体中原体就是亚基,但在杂聚体中原体由两种或多种不同的亚基组成。
稳定四级结构的作用力与稳定三级结构的作用力没有本质区别。亚基的二聚作用伴随着有利的相互作用包括范德瓦尔斯力、氢键、离子键和疏水作用,还有亚基间的二硫键。亚基缔合的驱动力主要是疏水作用,因亚基间紧密接触的界面存在极性相互作用和疏水作用,相互作用的表面具有极性基团和疏水基团的互补排列;而亚基缔合的专一性则由相互作用的表面上的极性基团之间的氢键和离子键提供。
血红蛋白分子就是由两个由141个氨基酸残基组成的α-亚基和两个由146个氨基酸残基组成的β-亚基按特定的接触和排列组成的一个球状蛋白质分子,每个亚基中各有一个含亚铁离子的血红素辅基。四个亚基间靠氢键和八个盐键维系着血红蛋白分子严密的空间构象(图5-45)。
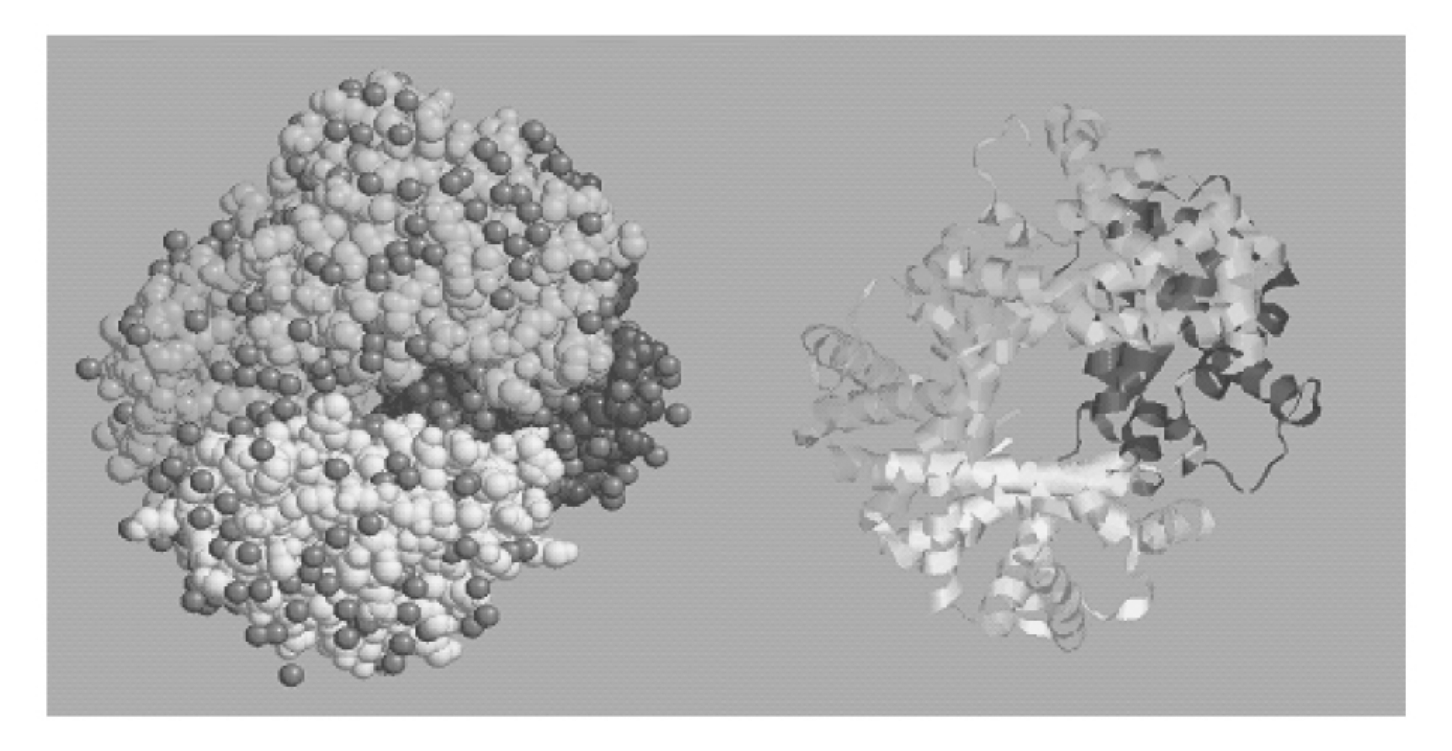
图5-45 血红蛋白的四级结构
5.实验目的
本实验的初衷,是让同学们了解蛋白质分子从一级结构到四级结构的概念以及种类,并学会使用PyMol观察蛋白分子的结构特征以及进一步运用PyMol建立蛋白分子动态过程的电影。
6.操作步骤
(1)对于一部电影来说,演员和导演都是非常重要的。作为一个导演,你必须选择有吸引力的演员。所以,首先你需要构建你自己的演员——蛋白或者多肽分子。
图5-46 PyMol软件用户界面
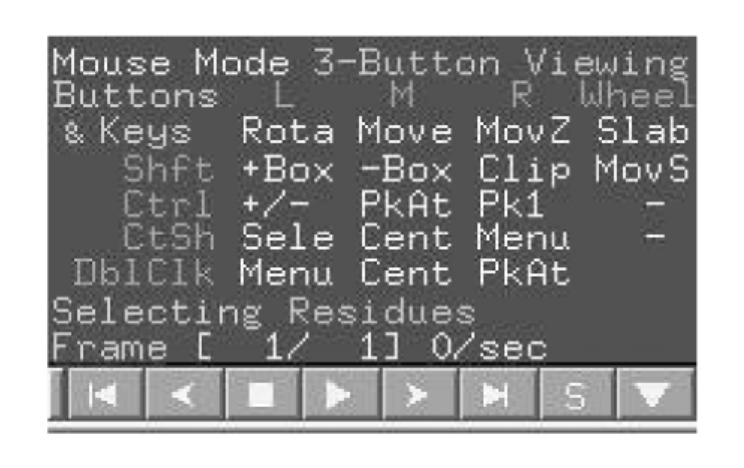
图5-47 PyMol鼠标操作方法
(2)打开PyMol软件(图5-47),选择Build(建立)→Residue(残基)并选择Helix(螺旋,一种二级结构)。
(3)选择Build→Residuals,点击不同的氨基酸残基,重复多次,构建一个包含10~12残基的多肽链。这样你就得到了一段完美的alpha-螺旋,值得注意的是,注意不要选择脯氨酸(Proline)。
(4)注意这时候多肽链的N末端和C末端还没
有完成。首先我们切换到鼠标编辑模式并选择N末端的氮原子,选择菜单Build(建立)→Make(pk1)Positive,然后选择Fill Hydrogens on(pk1)(在pk1上面添加氢原子)建立N末端NH3基团。而对C末端的修正有所不同,用鼠标选择C末端的碳原子作为(pk1),在命令行窗口输入“attach O,2,2”,为末端碳原子加入两个共价结合的氧原子,然后取消所有选择。
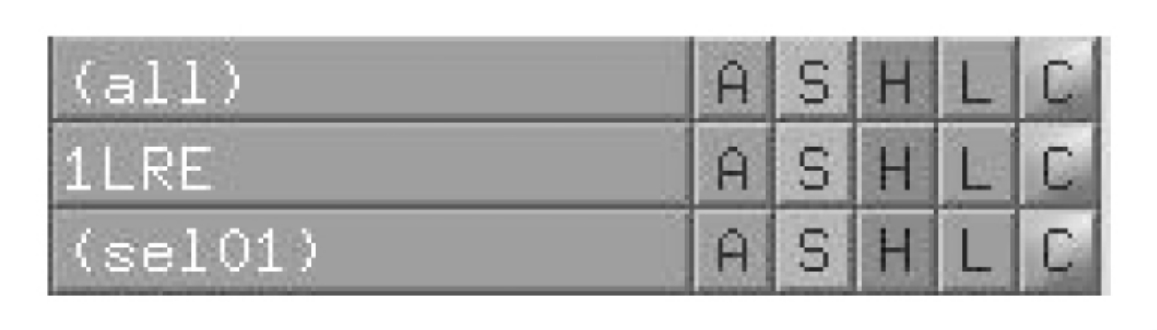
图5-48 PyMol的工具栏窗口
说明:PyMol的工具栏窗口(图5-48)中,最左边一列为研究对象,A表示对研究对象的操作(action),如改变其位置,居中(Center),删除、复制等;S则是显示(show)特定格式的操作,如cartoon格式、ribbon格式等等;H则是可以将特定的对象隐藏(hide)起来,仅显示我们想要显示的对象;L是显示特定的标签(label),例如氨基酸残基名称、原子名称或者其他特性;最后一个选项C则是指定选定对象的颜色(color)。
(5)从右边的工具栏窗口,选择Actions→assign sec.struct.,然后将碳骨架显示为cartoon模式,原子显示为lines模式。
(6)选择Settings→Edit All,这个菜单几乎可以个性化所有的PyMol动作。双击“cartoon_transparency(卡通模式的透明度)”,输入0.4。双击“cartoon_oval_length(卡通模式椭圆的长度)”,输入0.9,然后按下Done退出。
(7)在命令行窗口中输入“show sticks,name c or name o or name ca or name n or name h”命令来强调骨架原子。
(8)输入“dist(name o),(name h),1.8”显示骨架上的氢键。输入“hide labels”隐藏标签。
(9)输入“hide lines,elem h and(neighbor elem c)”隐藏所有的非极性氢原子。
好了,下面要开始动起来了。
首先,你得了解几个概念。
●状态(state)指的是你的体系给定的特定的三维连接。每个旋转或者平移的分子都是一个状态,状态与方向和位置无关。从分子动力学模拟构建出来的100个结构,就代表了100个状态。
●帧(frame)表示一个特定的方向、位置和状态的呈现方式。每一个状态都可以写成一个图像文件,这些图像文件按照先后次序连接起来,就形成了电影。
(10)转动分子,使螺旋垂直。
(11)预定义180电影帧,全部显示状态1,输入“mset 1,180”。
(12)使用预定义的动作,例如旋转完整一圈,均匀产生180幅快照,输入“util.mroll 1,180,1”。
(13)产生每一帧的文件,输入“set ray_trace_frames,1”;因为播放电影过程中,不需要将帧存入缓存,所以输入“set cache_frames,0”。
(14)选择File→Save Movie,选择PNG文件,将所有的PNG文件保存到预先建立的文件夹,关闭PyMol。
现在需要将一系列的PNG文件转换为电影文件,有很多软件可以做到这一点(这取决于你的操作系统),这里我们选择了开源的ImageMagic软件包。其中mogrify程序可以标记需要转换的图像文件,而convert程序可以在mpeg4encode程序的帮助下产生一个MPG格式的电影文件。
(15)开始-运行-cmd,打开命令行窗口,将当前目录切换到你的PNG文件所在的目录。
(16)mogrify—draw“text 20 30‘Hello,Oscar!’”—fill yellow—pointsize 18 helix*。
(17)convert—quiet—delay 1*.png helix_mov.mpg。
最后,你可以得到你的动态过程电影,可以用media player播放,也可以将动态电影插入你的PowerPoint文件。
7.实验小结
本实验在结合一定趣味性的基础上,使同学们对于生物大分子的高级结构有了更加直观和深入的认识,有兴趣的同学还可以从PDB数据库中下载一些自己感兴趣的生物大分子结构并用PyMol查看其结构特征。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














