一、蛋白质分子间的相互作用
蛋白质分子之间的相互作用在生命现象中占重要地位,从细胞骨架蛋白的装配,到免疫应答和细胞信号传导,基因转录和酶催化反应,配体受体相互作用,乃至代谢和生理活动及其调节都与蛋白质分子间相互作用直接相关。辅基、辅酶、神经递质、配基乃至药物与蛋白质分子间的结合亦是生理生化反应和药理作用的关键,其包括:①生物大分子生物大分子相互作用,如蛋白质蛋白质、蛋白质核酸等;②小分子生物大分子相互作用,如药物蛋白质、药物-DNA、神经递质、配基受体蛋白等。
关于受体学说可以追溯到Langley、Fischer和Ehrlich等人的工作,以往受体概念为药物在体内作用的位点,即药物作用“靶标”,其实质是药物与蛋白质、核酸等生物大分子特定的结合部位,研究蛋白质分子的结构和功能,分子间的对接和作用,是新药设计和研制的基础。
许多蛋白质的生理或药理功能,是通过与小分子相互作用体现出来的,如酶与底物的相互作用体现酶的催化功能。对小分子配体生物大分子相互作用有一个全面、准确的了解,就能以受体结构知识进行合理药物设计(structure-based rational drug design),对配体受体相互作用进行计算机模拟和理论计算研究,对配体受体相互作用的研究起十分重要的作用。理论计算可以解决某些实验不能解决的问题,如酶催化反应过渡态结构问题。
在过去的20年中,随着分子生物学和X线衍射晶体学、多维核磁共振(mD-NMR)等结构测定技术不断发展,认识了许多生物大分子的三维结构。对于那些仅知一级结构,不知其高级结构的生物大分子,可以用理论方法或分子模拟方法(如同源模建方法)预测三维结构。为受体配体相互作用的理论计算以及在此基础上的合理药物设计提供重要信息。与此同时,计算机科学的发展,也对配体受体相互作用进行高精度的理论计算(如自由能微扰计算)提供了良好的硬件平台。
分子之间的相互作用有成键和非键2种作用,其中,非键作用对生物过程尤其重要,例如药物与受体的特异性结合、底物与酶的作用、蛋白质分子的折叠,以及分子的几何对称型安排等。非键相互作用对药物与受体结合有重要意义,因为非键结合有利于药物的代谢和排泄。非键相互作用主要包括范德华作用、静电作用、氢键作用和疏水作用(表18-2)。这些作用的能量一般在4~20kJ/mol,虽属弱相互作用,但是它们的积累效应却是非常可观。
表18-2 水溶液中蛋白质分子间4种非键相互作用
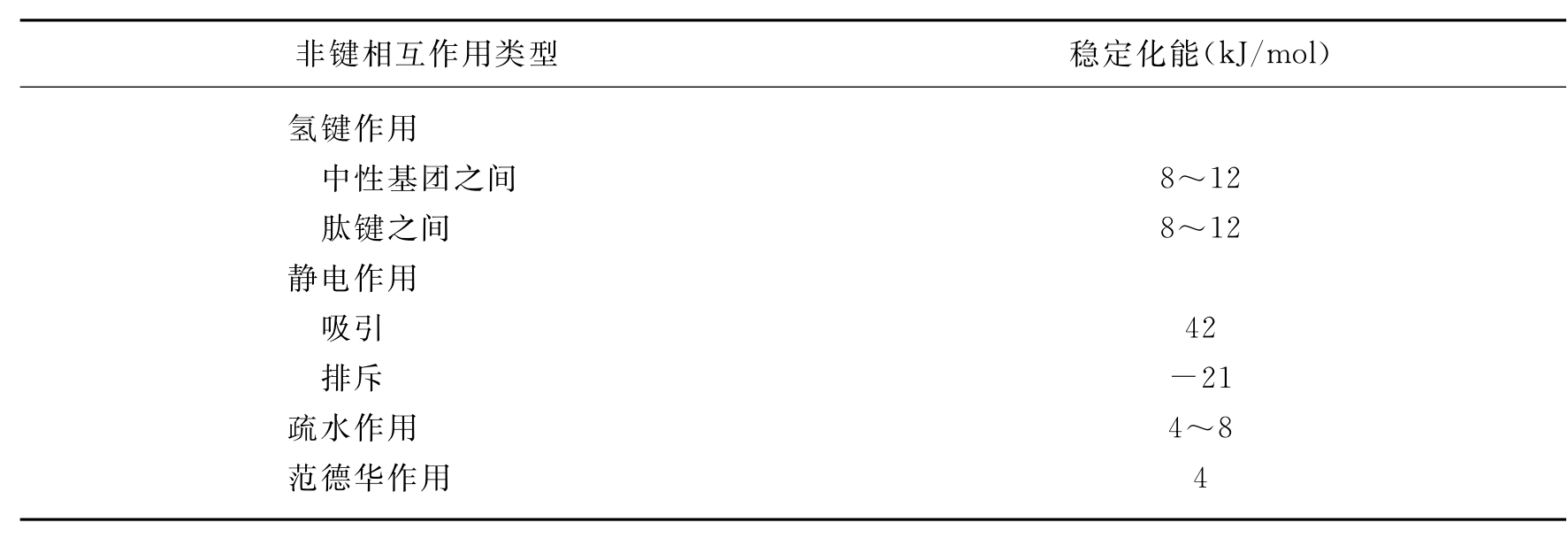
非键相互作用可以用经验力场方法计算,而共价相互作用,若牵涉到化学键的生成与断裂,就必须用量子化学方法计算。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














