《气体摩尔体积》教学设计
吴峥远
一、教学目标
1.知识目标
使学生在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念。
2.能力目标
通过气体摩尔体积的概念和有关计算的教学,培养学生分析、推理、归纳、总结的能力。
3.情感目标
通过本节的教学,激发学生的学习兴趣,培养学生的主动参与意识。
通过教学过程中的设问,引导学生科学的思维方法。
二、教材分析
本节教材在学习了物质的量和摩尔质量概念的基础上,学习气体摩尔体积的概念及有关计算,这样的编排,有利于加深理解、巩固和运用有关概念,特别是深化了对物质的量及其单位的理解。本节是今后学习有关气态反应物和生成物的化学方程式的计算以及学习化学反应速率和化学平衡的重要基础。
本节教材首先注意了学科间的联系和学生已有的知识,通过计算得出1mol几种物质的体积,设问: 1mol气态物质的体积是不是也不相同呢?然后介绍气态物质的体积与外界温度、压强的关系,计算出标准状况下1mol气体的体积,引出气体摩尔体积的概念,最后是关于气体摩尔体积概念的计算。
三、教法设计
1.认真钻研新教材,正确理解气体摩尔体积的概念。
教学中要给学生讲清气体摩尔体积与标准状况下气体摩尔体积22.4L/mol的关系。
2.本节引入方法
(1)计算法:全班学生分成3组,分别计算1mol固、液态几种物质的体积并填表。
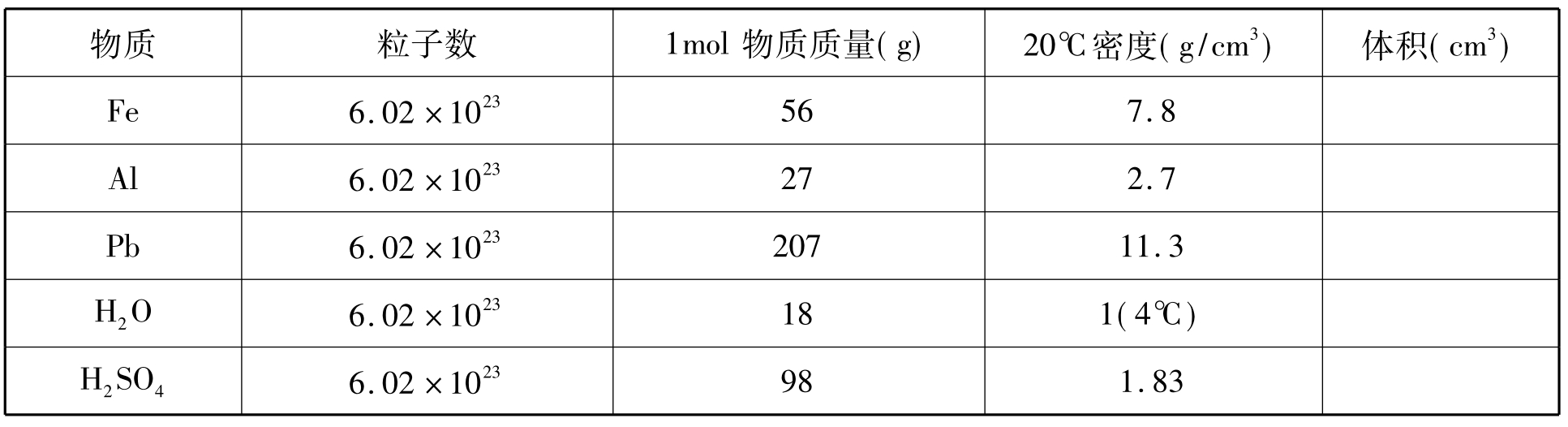
(2)实物展示法:有条件的学校,可分别展示1molFe、Al、Pb、H2O、H2SO4的实物,直观得到体积不同的结论;展示22.4L实物模型,这种实物展示方法学生印象深刻,感性经验得以丰富。
3.列表比较决定物质体积的主要因素(用“√”表示)
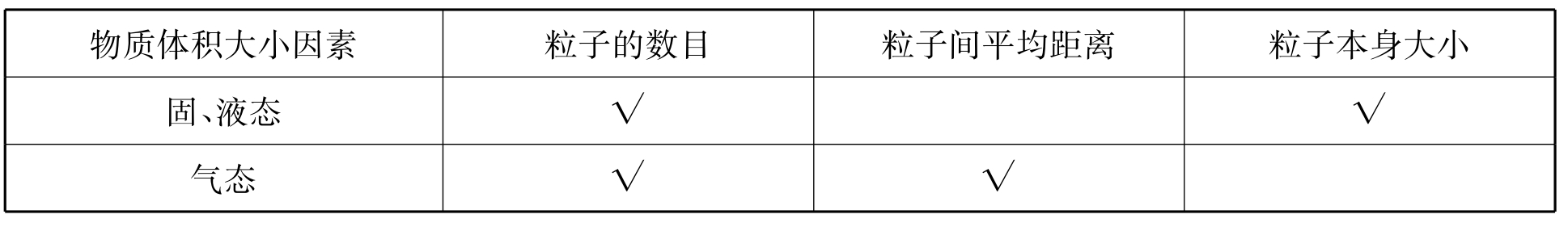
讲清当粒子数相同的条件下,固、液态体积由粒子大小决定,气体体积主要由分子间距离决定。举例:50个乒乓球和50个篮球紧密堆积或间隔1米摆放,前者球的大小决定体积,后者球间的距离决定体积。
4.充分运用多媒体素材,展示微观的变化,活跃课堂气氛,激发学生兴趣。例如:应用微机显示温度、压强对气体体积的影响;固、液、气态物质粒子间距离;1mol液态水(0℃,18mL),加热到100℃气化为水蒸气的体积变化等。
5.通过阅读、设问、讨论,突破难点。讨论题有:物质体积的大小取决于哪些微观因素?决定固、液、气态物质体积的主要因素?在粒子数一定的情况下,为什么气体体积主要取决于分子间距离?为什么比较一定量气体的体积,要在相同的温度和压强下进行才有意义?为什么相同外界条件下,1mol固、液态物质所具有的体积不同,而1mol气体物质所具有的体积却大致相同?在相同条件下,相同物质的量的气体所具有的体积是否相同?为什么1mol液态水变为1mol水蒸气体积由18mL变为3.06×104mL体积扩大1700倍。
6.在理解标况下气体摩尔体积这一特例时,应强调以下4点:①标准状况;②物质的量为1mol;③任何气体物质;④约为22.4L。只有符合这些条件,22.4L才是1mol任何气体在标准状况下的体积。因此,非标准状况下或固、液态物质,不能使用22.4L/mol。
四、教学重点与难点
1.教学重点:气体摩尔体积的概念。
2.教学难点:相同温度和压强下,相同物质的量的任何气体所占的体积大约相同的原因。
五、教学方法与手段
1.教学方法:设疑、导思、归纳、应用。
2.教学手段:多媒体辅助。
六、教学过程
[复习提问]1.1mol物质含有的粒子数约是多少?
2.什么叫摩尔质量?
[引入新课]前面我们学习的物质的量,它把宏观上可称量的物质与微观粒子联系起来,宏观上可感知的除了物质的质量,还有物质所占的体积。上节课我们研究了1mol物质所具有的质量,这节课我们来讨论1mol物质所占的体积。
[板书]一、气体摩尔体积
1.1mol固、液态物质的体积
[提问]已知物质的质量和密度,怎样求体积?
学生回答: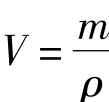
[投影]计算1mol几种固、液态物质的体积,填表;
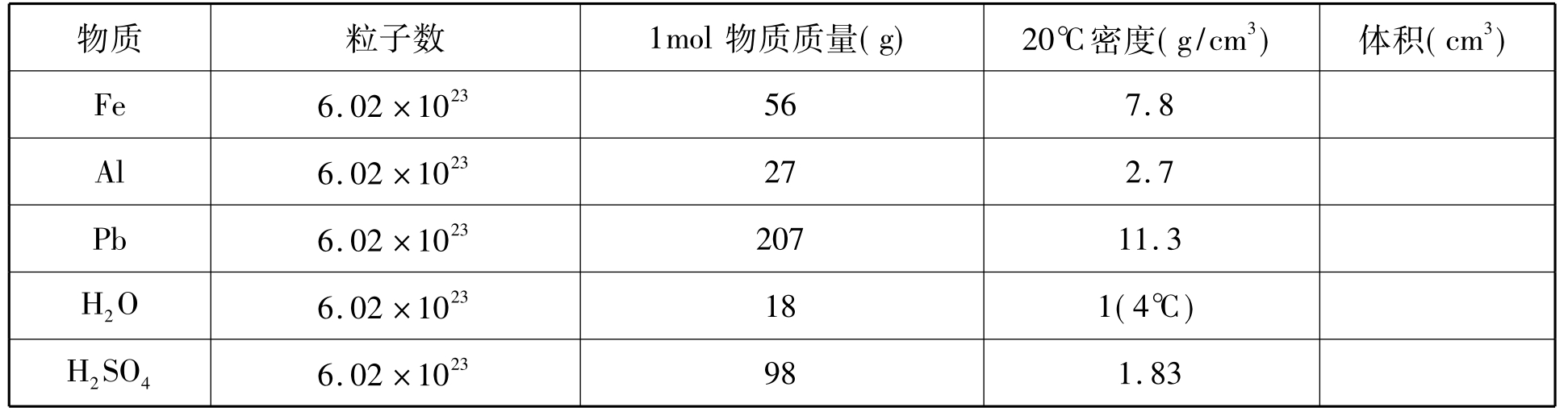
学生分组计算出1molFe、Al、Pb、H2O、H2SO4的体积分别为:7.2cm3、10cm3、18.3cm3、18cm3、53.6cm3。
[微机显示]1mol物质的体积。
[板书]1mol固、液态物质的体积不相同。
2.1mol气态物质的体积
[微机显示]影响气体体积的因素
指导学生注意观察分子间平均距离的变化。
[说明]比较一定质量气体的体积,必须在相同温度和压强条件下。
[板书]标准状况:0℃,101kPa
[投影]计算标准状况下,1mol H2、O2、CO2气体的体积,并填表:
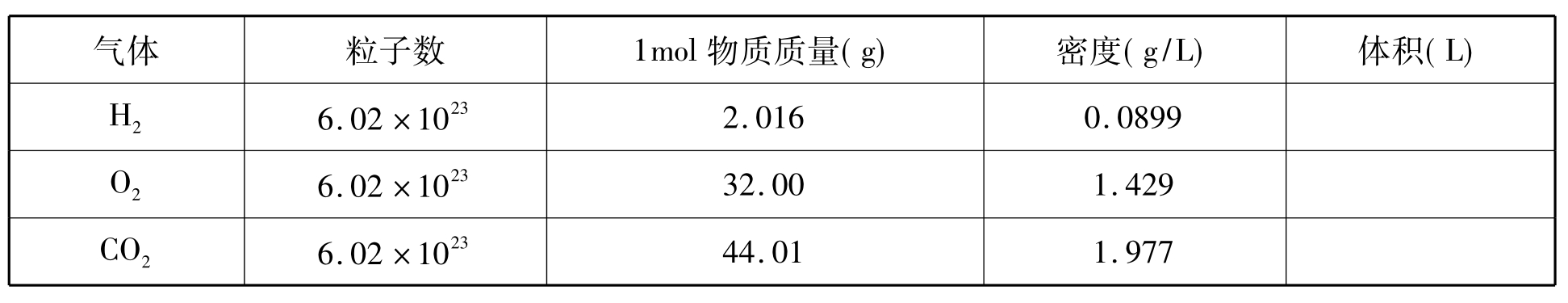
学生分组计算出标准状况下,1mol H2、O2、CO2的体积分别为:22.4L、22.4L、22.3L
[板书]在标准状况下,1mol任何气体所占的体积都约是22.4L。
[强调]①标准状况(0℃,101Kpa);②物质的量为1mol;③任何气体物质;④约为22.4L。
[展示]22.4L体积的实物模型
[设疑]在其他的温度和压强下,1mol气体是否占有大约相同的体积呢?
[板书]单位物质的量气体所占的体积叫做气体摩尔体积。
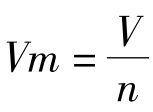 单位:L/mol
单位:L/mol
[提问]气体摩尔体积与标准状况下气体摩尔体积22.4L/mol是什么关系?
[强调]22.4L/mol只是在特定条件下的气体摩尔体积。气体摩尔体积是在任意温度、压强下,气体体积与气体物质的量之比。
[设问]为什么在一定温度、压强下,1mol固、液态物质体积不同,而1mol气体体积都大致相同呢?让我们从物质的组成和结构上找找原因。
[讨论]决定物质体积的主要因素
[微机显示]影响物质体积的因素
[提问]1.1mol液态水变为1mol水蒸气分子数是否变化?
2.为什么体积由18mL变为3.06×104mL,体积扩大了1700倍。
[指出]在粒子数相同的条件下,固、液态物质的体积主要决定于构成物质的粒子的大小,由于构成不同物质的粒子的大小不同,所以1mol固、液态物质的体积不相同;气体的体积主要决定于粒子间的距离,不同气体分子间的平均距离大约相等,所以1mol气体的体积大致相同。
[结论]在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。即阿伏伽德罗定律。应用:同温同压: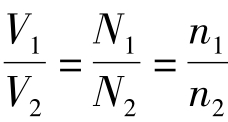 ,还可推导出
,还可推导出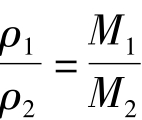
[练习](投影)下列说法是否正确?如不正确,指出错误的原因。
1.1mol任何气体的体积都是22.4L。
2.1molH2的质量是1g,它所占的体积是22.4L/mol。
3.1mol任何物质在标准状况时所占的体积都约为22.4L。
4.22.4LO2一定含有6.02×1023个O2。
5.在同温同压下,32gO2与2gH2所占的体积相同。
6.在同温同压下,20mLNH3与60mLO2所含的分子个数比为1∶3。
(答案:正确的是5和6。)
七、教学反思
本节课的教学内容对学生来说是一个全新的内容也是新的挑战,所以气体摩尔体积概念的理解是本节课的主要内容,在教学过程中我发现尤其要强调学生对于气体摩尔体积和22.4mol/L之间的关系以及在非标准状况下气体摩尔体积是否还有可能等于22.4mol/L的认识问题。除此之外,阿伏伽德罗定律应用的前提是气体物质也是要强调的重点,这些都是学生在理解上容易出错的地方。在后面的教学过程中要对学生加强此方面的训练,在注重学生理解力的基础上培养高中学生学习化学的积极性和兴趣。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















