第五章 阿斯特伯里遭到抨击
阿斯特伯里出生于工人家庭,靠奖学金升学而获得成功。他是全家的骄傲,他聪明能干,并证明是大有前途的!剑桥的宁静气氛对他并不合适;但在威廉·布拉格爵士的朴实的家庭里,先是在伦敦大学学院,以后在英国科学知识普及会,他变得才华横溢。他依靠自己在利兹大学对角蛋白的研究很快取得成就。布拉格没有估计到他是一位出色的演说家,这表明布拉格是何等地错误!毫无疑问,布拉格在英国科学知识普及会讲演的美好事例成了阿斯特伯里的榜样。人们应该念一下已出版的布拉格讲演集《老行业和新知识》,可以看出布拉格对工匠的工作感兴趣(布拉格,1926)。这本讲演集里有一篇应予注意的演说《关于织造业》,讨论了羊毛纤维的弹性。根据当时报纸上的报道来判断,布拉格一定是位最有效的宣传家,既是科学的宣传家,更是X光晶体学的宣传家。阿斯特伯里同样也成了织品研究和生物学中X光晶体学的有效宣传家,他是最初普及“分子生物学”这一术语的人士之一。他成了有名的公众演说家。很多人请他作报告。早在1933年就开始获奖,最初是可敬的染料工人公司金质奖和利兹大学的李利奖章。1937年,在洛克菲勒基金会的赞助下,他参观访问了“美国将近五十所最重要的大学和研究机构,所到之处都作了报告或讨论了纤维和生物组织的分子结构”(利兹大学织品工业系,1937,4)。
战争的头几年阿斯特伯里的研究计划中止了,与此同时,他对任何一种基本上不同于他的蛋白质研究方法,变得越来越独断、僵化和刚愎自信。二十世纪三十年代中参加阿斯特伯里的小组作为研究助理的伊恩·麦克阿瑟谈起他时说:“他像卖青苗一样地出售他的发现而不去清除杂草,也不去准备收获所必需的系统和技术。这不可避免地丧失了蛋白质结构的突破,并且还受到了损害。”(麦克阿瑟,1961,332)
麦克阿瑟差不多可说是一个完美主义者,他对阿斯特伯里迅速而大量地发表“未臻成熟的”研究感到沮丧和惊诧,在他为阿斯特伯里撰写的讣文中走得更远,甚至称阿斯特伯里为一位“艺术的业余爱好者而不是科学的专业人员”(同上)。正当X光晶体学这门科学趋向一个新高峰之际,阿斯特伯里变得过分自信了。傅里叶和帕特森的分析成了有用的技术,用以分析分子结构及测定键距和角度,其精确度可达五十分之一埃(Å)。但是,阿斯特伯里并未回过头来巩固他的工作基础,却根据所提出的角蛋白模型去解释新的多聚物。他从未用单晶图像去补充胱氨酸粉末图式的研究(阿斯特伯里和斯特里特,1932,91)。幸而他当时推论出的单位晶胞和空间群,也在贝尔纳先驱性的氨基酸、二酮吡嗪和肽的单晶分析中得到了(贝尔纳,1931)。阿斯特伯里没有根据原子半径的新数据去详细研究原子的敛集,这些新数据是加州理工学院的波林学派在二十世纪三十年代用电子衍射研究得出的,后来由科里所补充,当时他进一步开展了贝尔纳对氨基酸和肽所作的研究,并证实了二酮吡嗪中C—N键的部分双键的性质(科里,1937)。
橡胶模型
当阿斯特伯里在不太扎实的角蛋白基础上建立平面折叠时,库尔特·迈耶在日内瓦把橡胶的迈耶-马克螺旋结构推广到塑性硫和聚磷腈基氯,它们分别有9.26Å(8个硫原子)和5.17Å(2个残基)的轴重复,如图5.1所示(迈耶,1936)。两年后,布里尔和F.哈利在德文《自然科学》杂志上发表了一幅精美的反丙烯基苯酚X光衍射图,并注意到了数目日益增多、已具有螺旋构象的多聚物。从反丙烯基苯酚的18.50Å的轴周期性中,这些作者清楚地认识到:
……分子不可能由一条平面的锯齿形链所构成,但是——在侧基的影响下——它最可能的形式是螺旋形,类似于聚氧甲烯和聚氧乙烯的结构,它们都有相同的纤维周期。
(布里尔和哈利,1938,12)
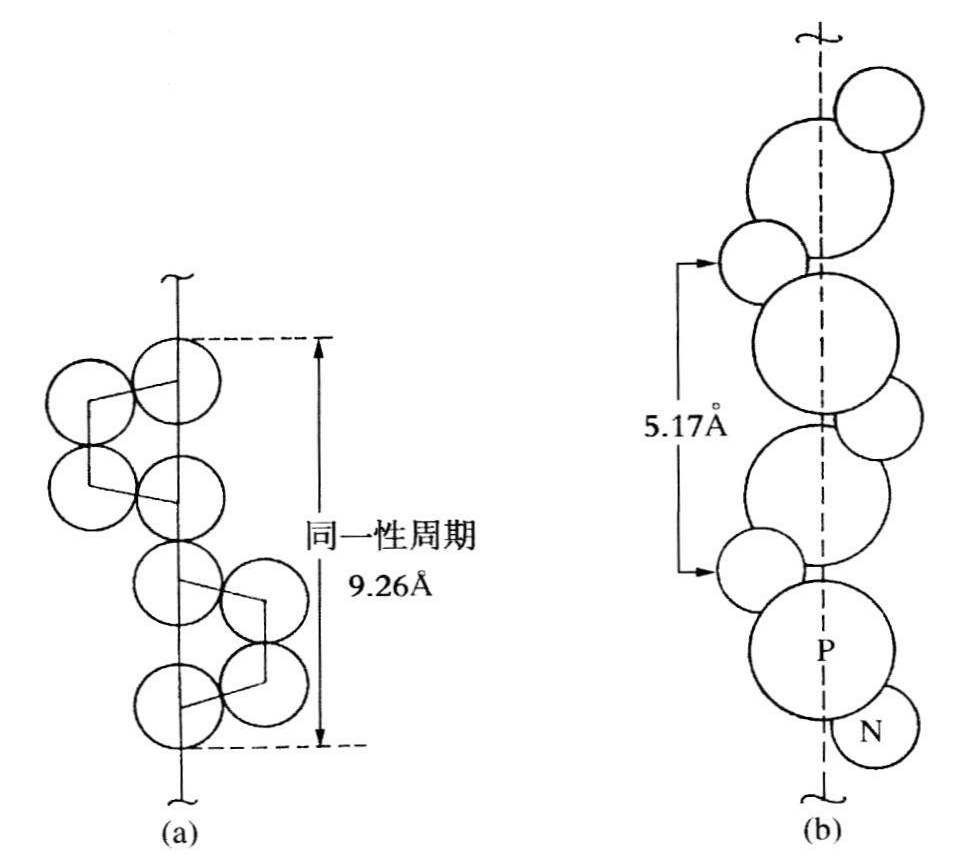
图5.1 (a)塑性硫的螺旋链(录自迈耶,1936,149);(b)聚磷腈基氯的螺旋链(录自迈耶,1936,151)。
这段引文使我们回到了欧文·索特在弗赖堡对聚氧乙烯结构所作的精细研究,它标记着打断了亚历克斯·缪勒在英国科学知识普及会和汉斯登伯格在弗赖堡为长链石蜡所确定的平面锯齿形链。汉斯登伯格认为不可能给氧化多聚物设计出这类模型,而不破坏碳的109°30′的四面体的角。索特设计出具有螺旋轴的一种分子结构,这种轴的平面投影呈圆盆形(索特,1933,188),用以替代图5.2b和图5.2c中所示的、他所说的“圆盆形式”。对于历史学家来说,聚氧甲烯的重要性不仅在于它能使斯托丁格证明大分子的存在(见第一章),而且还在于它使模型构思者不再把自己的数据去硬凑平面构型。其实,橡胶虽是螺旋形的,却能给予一种平面构型(具有二次折叠的螺旋轴),而聚氧甲烯则不能。带状模型是不可能的,因为四面体的角和锯齿形的链不具有所要求17.3Å的纤维重复。索特设计出一种非完整的螺旋以代之,它是9个残基重复4圈,每个残基旋转160。,就像汉斯登伯格于1927年最初提出的那样。
二十世纪三十年代末,莫里斯·哈金斯和H.S.泰勒把聚氧甲烯型的螺旋构象用于蛋白质。哈金斯的α-角蛋白模型每5.1Å重复有3个(但不一定正好是3个)残基,这种重复可以拉直而给出阿斯特伯里和伍兹所要求的百分之百的伸展。四十年代初期,多罗西·霍奇金在牛津构思的胰岛素分子模型是一条螺旋多肽链带有三重折叠的螺旋轴“部分是由晶体的三角对称性所造成,我们马上发现在我们之前,M.L.哈金斯(1943)和H.S.泰勒(1941)就已提出了”(霍金奇和赖利,1968,26)。四十年代初,各自建造螺旋模型的这些尝试,表明日益认识到锯齿形构型和平面构型是不合适的。阿斯特伯里提出的α-角蛋白的折叠盘曲如何受到抨击和他又如何作出反应的呢?
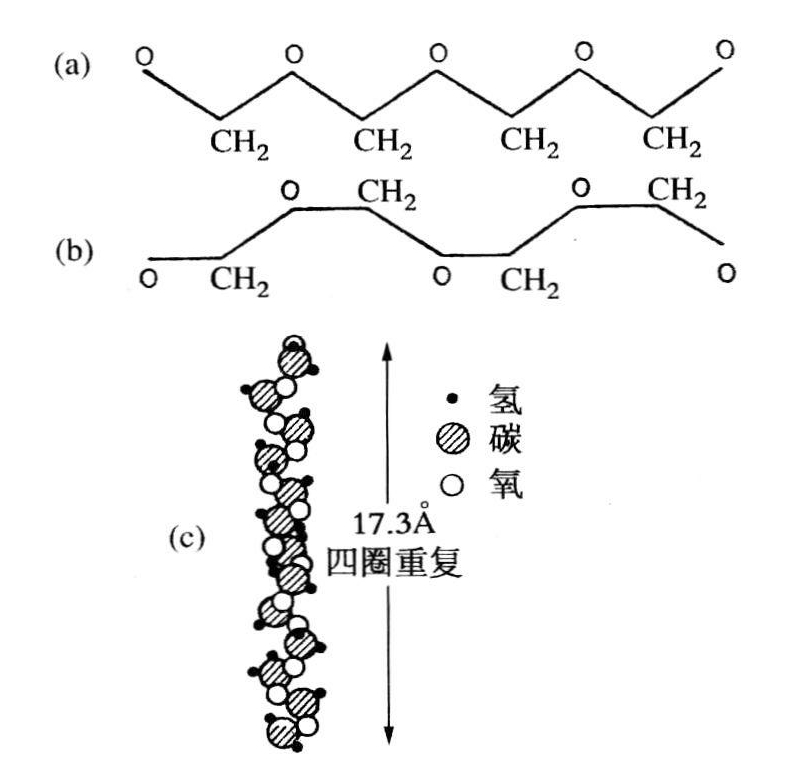
图5.2 (a)“老的”聚氧甲烯锯齿形链;(b)新的“圆盆”形式(录自索特,1933,188);(c)索特于1933年提出的聚氧甲烯的螺旋模型。
对α-角蛋白模型的批评
1936年普雷斯顿在纽约州罗彻斯特访问哈金斯时,第一次听到介绍α-角蛋白里的多肽链也许呈螺旋形,并认识到阿斯特伯里的α和β模型的缺点。一年前,由于他在伊斯门·柯达公司任职而进入了蛋白质领域。这家公司急于知道照相底片所用的白明胶的结构。哈金斯的顶头上司谢泼德博士要他按阿斯特伯里研究角蛋白那样地去研究白明胶,在1919年已得出氢键概念的哈金斯,非常适合于这一任务,与波林一样,他在加州理工学院罗斯科·迪金森那里学习,与波林合作把刘易斯理论应用于共价半径和共振结构的存在。他到罗彻斯特以后不久就引进了平面肽单位,作为比非平面单位更稳定的一种结构(哈金斯,1936)。提出了研究白明胶结构的任务后,哈金斯从检验阿斯特伯里提出的α-和β-角蛋白的模型着手。他写道:
一开始我打算修改阿斯特伯里的模型,使之符合于我的原理:引进NHO型的氢键,避免非键结合的原子过分靠近等(《有机化学》Ⅰ,407(1936),447~450)。对于β-角蛋白来说,这似乎导致了满意的结果,但我立刻认为这种模型不适合于α-角蛋白,因为链轴相对两侧的不平衡的力会使它不断弯曲。只有一种螺旋结构可以避免这一点。我研究了各种螺旋结构,希望能找到适合于α-角蛋白、胶原等的正确模型。1937年5月阿斯特伯里访问我时,给他看了我的模型,一开始他反对氢键。(我相信他以前并不熟悉这个概念)但在他离开之前,我相信我已使他信服了。
(哈金斯,1969a)
我告诉他,他提出的概念和模型有一些我是同意的,但另一些则很难苟同;而且我确实感到他在NH和CO基团之间用虚线表示的不清楚的吸引力,就是真正的氢键,而其他基团之间的虚线,则不代表任何东西。
(哈金斯,1969b)
这次会晤是阿斯特伯里在洛克菲勒基金会资助下到美国旅行期间进行的。两年后,阿斯特伯里接到美国蛋白质化学家汉斯·纽雷思的来信:
长期以来我想把去年春天在一次会议上发表的、至今还未出版的论文底稿寄给你。我真希望编辑会退稿,可是最近我被告知这一“胡思乱想”的结果已被刊物所接受。我将找出这份底稿并马上寄给你。我心情沉重,因为我发现你提出的α-角蛋白结构和超收缩的角蛋白与原子大小所要求的不尽符合。根据表明大小的原子模型来判断,我看不出有足够的空间可以容纳侧链和氢原子。论文请你一阅,并希望通过横渡大西洋的航空邮件得到你的回复,以便在必要时我仍能抽回这份底稿。
(纽雷思,1939)
阿斯特伯里在复信中承认:
……我可毫不迟疑地说,对你的论文内容我丝毫不感惊奇,因为一段时间以来,我已认识到要使侧链适合于我们的α-角蛋白模型也许有难以克服的困难。这个模型是在很久以前提出的,对于一些细节甚至其精确性我已不再坚持。您也许注意到了我最近发表的论文,我坚持所有的蛋白质基本上都是纤维性质,事实上我在《生物化学杂志》上发表的关于变性的论文,就假定球蛋白有一种铁丝网状的结构。这个系统当然就是一种折叠的β-构型,而且我曾多次指出,多肽链的折叠一般一定发生在与侧链横切的平面上,就像我提出的角蛋白和肌球蛋白的α-β转换那样。
可是,尽管我有了这些想法,最后还一定会出现像您论文中提出的那种麻烦,但我仍然认为您过高估计了困难,我想您也许过大地估计了原子间和分子间的距离。对于您的一般计算这也许不会造成很大差别,但蚕丝中的C—N距离算出来是1.37,尿素晶体中的C=O距离是1.15。您所取的氧的半径是在水中和无机盐中测定的,在有机酸中可能就不一样。我感到你要很快取回这份底稿,所以正如我以前说过的,我没有再花时间去构思模型或查阅有关原子数据的文献,但我建议您再研究后一个问题。
(阿斯特伯里,1940a)
纽雷思的信激励阿斯特伯里行动起来。他同研究助理弗洛伦斯·贝尔一起提出了角蛋白的新模型,但链的折叠仍是平面的(阿斯特伯里和贝尔,1941)(见图5.3)。

图5.3 修改过的结构的空间填充模型(录自阿斯特伯里,1941,5)。
回到老问题上再重新研究自己的答案,这最不符合阿斯特伯里的性格,也许正是因为如此,所以其结果同他以前提出的老模型并无根本区别。虽然摒弃了六面体的纤维素类似物,但仍保留了折叠的平面性,他依然认为这对保持角蛋白中的交联是必不可少的。总之,在他同时要做这么多事情的时候,他是不可能对这个课题进行旷日持久的重新检验,何况战争很可能会结束他的研究计划。
在他已着手而未完成的许多工作中就有核酸的研究。我承认他对核酸所作的X光检查只占他很少一部分时间,但这是二十世纪三十年代后期对核酸的唯一研究,并引起了关心染色体复制和基因性质的人们的注意。此外,这是阿斯特伯里在分子生物学研究方面达到的顶峰,分子生物学是以各种方式孕育形成的。
核酸的第一张X光照片
阿斯特伯里是国际知名的科学家,他对有重要生物学意义的纤维怀有无限热情,因此成功地制备了高黏度溶液并从中得到双折射纤维的人们,很自然地会把这些纤维送给他作X光研究。1935年或1936年当J.W.施米特从吉森寄材料给阿斯特伯里时,他确实没有向人索取过核酸。阿斯特伯里从这个材料得到了一幅十分完美的纤维图像,在大约3.5Å处有一个子午线角。这是对前两次尝试的改进,一次是赫佐格和贾克于1920年研究赫尔曼·斯托伊德尔提供的材料,另一次是十年后林纳的工作。在阿斯特伯里收到新鲜材料时,他有了一位新的研究助理。
1937年,阿斯特伯里的洛克菲勒研究助理西尔维亚·迪金森辞职了。她的继任人是位十分能干和动人的剑桥大学年轻毕业生弗洛伦斯·贝尔(现在成了索耶夫人),她去曼彻斯特之前是剑桥的大学生。这次迁居并未证明是成功的,但当她进入利兹大学作为一名腼腆的年轻研究生时立刻就大显身手了,阿斯特伯里发现她头脑清晰擅作分析,是位细心而可靠的研究科学家;对于他多变的思辨方式她持批判态度,因此给她取了个绰号叫做他的“鬼叫声”(索耶,1967)。阿斯特伯里能够很好地监督她工作,因为他俩的房间毗邻在同一层楼上。这个两人小组也许是三十年代后期在阿斯特伯里系里合作的楷模。取得的成果之一是DNA的第一个分子结构。
硬币堆叠模型
当细胞遗传学家杰克·舒尔茨作为洛克菲勒研究员赴斯德哥尔摩卡洛琳斯卡研究所的途中访问阿斯特伯里时,形成了要在利兹大学进行研究的计划。这促使他后来要求托布吉·卡斯帕森把用哈马斯登技术制备的高聚DNA寄一些给阿斯特伯里。虽然文因纳·哈马斯登对寄材料给利兹大学并不热心,但卡斯帕森答应了舒尔茨的要求,阿斯特伯里则把收到的材料交给了弗洛伦斯·贝尔。她制成钠盐胶片,方法是让一层溶液快速干燥在一块玻璃板上,并分成2毫米宽的条带。这些胶片被拉长为原来长度的二倍半,放在X光束的框架里。得到的图像有些是极好的,但好像是后来富兰克琳和戈斯林所描述的A型和B型的混合物。
两个特性很明显——3.34Å处有一个子午线角和16.2Å处有一个赤道点。根据原点附近的模糊的衍射点,阿斯特伯里和贝尔断言DNA分子轴上的真正周期,一定至少是一个核苷酸厚度的17倍(阿斯特伯里和贝尔,1938,113)。什么东西产生了3.34Å的点子,很明显一定有一些有规律地排列着的强烈散射的基团,它们之间相隔这一段距离。1932年,W.J.施米特注意到DNA纤维的负双折射。阿斯特伯里和贝尔认为这起因于嘌呤和嘧啶,这些碱基一定位于与纤维轴呈直角的平面上。现在可根据分子模型来解释染色体和DNA纤维的负双折射,在这个模型中,碱基是一个堆在一个上面,像是架子上的一块块板,或像图5.4所示的一叠钱币。他们认为既然四核苷酸假说要求在3.34×4=13Å处有一个重复;但子午线的这一距离上没有一个点子,使他们对这个著名的假说产生怀疑。很清楚,他们认为比3.34Å更高数量级的周期性起因于化学重复,而不是构象重复。
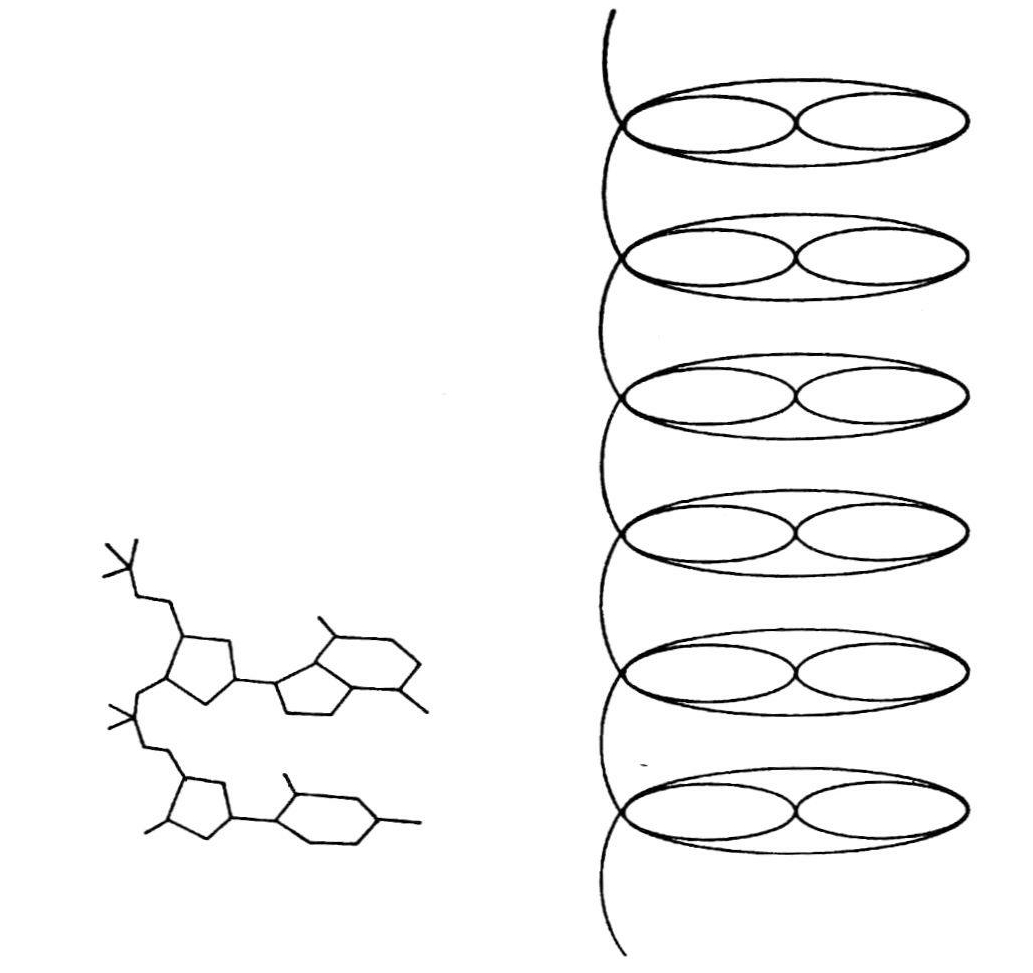
图5.4 构成胸腺核酸单位的核苷酸柱的示意图(录自阿斯特伯里和贝尔,1938,112)。
1938年4月他们在《自然》上发表了 DNA 结构的第一篇论文以后,阿斯特伯里出席冷泉港蛋白质化学讨论会,宣读了他同贝尔小姐一起研究的一篇论文。斯图尔特·马德是这篇论文的评论者之一(他是提出抗体和抗原具有互补的三维结构的人之一),他的评论是:
我发现你的核酸结构的图解特别令人放心,因为根据分析化学观点来讨论这一资料的一些化学家已提出问题:核酸组成中是否有足够的变异以产生血清学的各种特异性,但从你的图解来看,可能有的变异已绰绰有余。我们知道相同组成成分在构型和空间关系上的变化,确为血清学的特异性提供充分的基础。H和OH基团围绕不对称碳原子的旋转,会产生可在血清学上检出的差别。所以很明显,这一叠叠核苷酸只要稍稍改变一下核苷酸排列的次序,或是在构型上出现另一些变化,就能给特异性以充分的基础。
(马德,1938,118~119)
阿斯特伯里的答复是重申他的信念,“核苷酸柱的周期至少是一个核苷酸厚度的17倍。所以核苷酸之间的排列次序并非总是相同的,这就有产生大量变异的机会”(阿斯特伯里,1938,119)。核苷酸柱是一条单链分子,糖和碱基环在同一平面上,与链的轴呈直角。
阿斯特伯里和贝尔从卡洛琳斯卡的材料获得这么多的结晶性证据,他们对此感到兴奋,使他们特别喜悦的是间距3.34Å,对于一些参数他们作了如下评论:
有关染色体行为和结构的这些发现的重要意义是显而易见的,因为我们不能不对如下事实产生深刻印象,即连续相继的核苷酸之间的间隔,几乎正好等于在完全伸展的多肽链中连续相继的侧链之间的间隔。很难相信这种符合一致只是偶然巧合,它促使人们产生一种想法,即染色体里的蛋白质和核酸多半是在这种情况下相互作用的。在有丝分裂周期中,核酸在染色粒里的形态也有一种节律,我们可以设想在相互作用的核苷酸线性期的影响下,来认识涉及蛋白质链延长的有丝分裂中的某个关键时期。
这种想法等于说胸腺核酸的分子如此完美地符合于完全伸展的多肽链的侧链图式,即应该是几乎毫无障碍地发生相互作用;碱性侧链同磷酸根之间最易发生反应,酸性侧链同核苷酸碱性基团之间可能也是如此。此外,联结的产物应该也是纤维状,就像两种原来的组成成分一样。
(阿斯特伯里和贝尔,1938,113)
当问及他们是否已预料到这种等同性时,索耶夫人(弗洛伦斯·贝尔)写道:
我们为发现间隔的同一性而“得意忘形”——但并非真正感到惊奇,因为我们早就希望发现某种关系。阿斯特伯里认为核酸是蛋白质复制和组构的模板,并使多肽链在分裂过程中伸直和平行。这正是当他的“鬼叫声”(他给我的绰号)稍稍争辩的时候。
(索耶,1967)
他们通过在这两种化合物的水溶液之间形成膜状的核酸-鲱精蛋白复合物,来检验这个假说。当这种复合物卷成一条细带时,得到的X光图像十分类似于核酸单独产生的图像,他们由此推论鲱精蛋白附在核酸链一侧的下方。氨基酸残基相距3.34Å,将支持3.34Å的子午线反射。
这真是妙极了!阿斯特伯里竟把核酸放进了流行的理论框架,这种理论的核心是染色体蛋白质。他在祝词中写道:
我们现在从纤维蛋白的X光研究及其他有关的研究中了解到,……它们怎么会如此容易地同核酸分子相结合并仍然保持纤维状构型;很自然地去假定(至少可作为最初的工作假说)它们形成了很长的卷轴,在上面画上了生命的形式。没有别的分子能满足如此众多的要求。
(阿斯特伯里和贝尔,1938,114)
在这次冷泉港会议上,阿斯特伯里遇到了温德尔·斯坦利,后者在三年前把烟草花叶病毒(TMV)制成晶体。后来,阿斯特伯里和贝尔研究了斯坦利的TMV晶体的X光图形。斯坦利写道:“我希望在宣战之前您能得到一些肯定的结果,而且您仍能做某种至少是有用的科学研究。”(斯坦利,1939)但在此时,阿斯特伯里的注意力已转向胶原蛋白,他就这一化合物作了第一次普罗克特纪念讲演(1939年8月)。除此之外,如同他对斯坦利所说的,利兹大学实验室的全体人员都志愿从事科学服务工作,所以“我们随时都会应召而去。在这种情况下唯一要做的是尽可能地结束工作,而这些恰恰是我的正在研究的工作”(阿斯特伯里,1939a)。核酸化学家马森·古兰德也没有从阿斯特伯里处得到任何结果,他曾把BDH胸腺核酸和酵母核酸的样品寄给了阿斯特伯里(古兰德,1939)。
战争爆发前,阿斯特伯里对核酸的结构只发表了一篇文章——这是1939年他送交爱丁堡国际遗传学会议的论文。这篇论文没有什么新材料,但有关于核酸同蛋白质相互作用的许多猜测,这些猜测将在第七章里讨论。可是在这篇论文以及以前的论文中,阿斯特伯里有关核酸所作的讨论都是核酸同蛋白质的缔合作用。在阿斯特伯里的论据中,近乎等同的纤维周期起了决定作用,就像在α-和β-角蛋白中所起的作用一样,他显然认为最重要的是他验证了可以生成一种人工核蛋白,它的纤维图形与胸腺核酸钠盐的图形几乎完全相同。
阿斯特伯里像研究角蛋白那样地研究核酸,那时他没有打算去建立分子模型。假如他想建立分子模型,他肯定会发现糖和碱基不可能在同一平面上,而且其骨架一定形成螺旋。他也将会发现在18.1Å处的侧面间隔之一(贝尔和他认为这是单个核苷酸的最大长度),比这些残基的最大量度还要大两倍!他们的这一错误假设(由于他们相信糖和碱基在同一平面上)得出了支持单链模型的计算。接着是:假定一条单链的平均直径是18.1Å。该分子的总长度必定是18.1×300Å,因为流动双折射得出的长阔之比为300∶1。既然核苷酸的平均相对分子质量是330,核苷酸之间相距3.34Å,则整个分子的相对分子质量应为:
![]()
卡斯帕森和西格纳就同一材料得出的数值在5000000~1000000之间。我们如用9Å这个数值来代替18.1Å,则DNA的相对分子质量将是最小值的一半,最大值的四分之一。换句话说,在一个分子里一定有2~4条链!阿斯特伯里和贝尔已很高兴地解决了一条链。阿斯特伯里和贝尔有进一步考核他们结论的方法。贝尔测定了DNA在1.63克毫升干燥时的密度。这个数值乘上单核苷酸的体积,应得出理论平均相对分子质量为330。采用如下的核苷酸大小:15×7.5×3.4Å,他们得到的相对分子质量为364.5。假如他们知道核苷酸的真正“平均”大小,这项计算得到的数值将是330的一半左右。令人惊奇的是阿斯特伯里认为不应发表贝尔的更多的数据。这样,贝尔发现的是DNA在“常温”下的密度为1.515克毫升,含水量为21%(没有说按体积算还是按重量算)(贝尔,1939,56)。她画出了鲱精蛋白和胸腺核酸钠盐的图像,后者的大小是:a=36.2Å,b=53.5Å,c=22.2Å(贝尔,1939,67)。这个晶胞是如此之大,这一事实表明阿斯特伯里和贝尔像贝尔纳和来科钦一样,在标明纤维图像时碰到了困难(见第十四章)。b走向上的量度特别长,是由于把5.35Å处的一个角归因子第十极反射所引起。但是,阿斯特伯里非常聪明地把明显的赤道上的点子和子午线上的点子归因于DNA分子的特性,他的失算之处是没有让贝尔从她的全部资料中算出链的数目。
阿斯特伯里之所以没有特别注意到这一点,那是因为他当时的先入之见认为核酸同蛋白质的相互作用最为重要。贝尔写道:“在分子生物学的最新进展中,意义最重大的是认识到生命的始源同蛋白质与核酸的相互作用密切相关。”(贝尔,1939,63)回溯到1931年,阿斯特伯里已对基因复制的机制作了猜测(阿斯特伯里,1931,21)。蛋白质同核酸的残基之间的间隔距离接近相等,正好被阿斯特伯里用来证明核酸分子可以起到“绷架”作用,使多肽基因分子处于伸展的(β-角蛋白)构型,以便让新的基因铺放在它上面。
迟至1953年,波林仍支持阿斯特伯里,认为这种空间间隔的等同性有重大意义(波林和科里,1953,96)。不幸的是,阿斯特伯里的观点没有得到证实。DNA和RNA的核苷酸之间的间距与充分伸展的多肽链中氨基酸之间的间距相等是一条似是而非的线索,1956年,克里克用他的分子指出这是错误的。阿斯特伯里和贝尔发现的等同性,对蛋白质合成和染色体复制都不是那么重要,但它可能是DNA螺旋“包”在组蛋白里的基础。在这种情况下,DNA复制和信使RNA合成都不可能发生。
1938年时,阿斯特伯里和贝尔由于发现了这种等同性而洋洋自得,他们深信已发现了最核心的秘密——了解了染色体自我复制的方法。阿斯特伯里认为这种方法简单而合理,他以一个年轻的神秘主义者的热忱加以赞美。他认为蛋白质构成了基因,而相邻多核苷酸之间3.34Å的间隔是了解蛋白质复制的重要线索。从羊毛的弹性到基因的分子构造是一条漫长的道路,但阿斯特伯里认为自己已到达目的地!精神抖擞地从事科学研究,洞悉控制生命活动程序的方法,是多么美好呀!当阿斯特伯里作题为《纤维结构的伟大事变》的马瑟演说时,提到自己交了好运:“我走过的道路是最初训练成一名‘正规的’物理学家——通过了晶体学和X光结构分析的奇妙世界,然后去研究织品纤维,最后是涉足各种链状分子特别是生物学链状分子的科学。”(1952,81~82)在他的哈维演说中,他声称难以改进这种研究方法。
我不得不做的一切工作就是进行探索以及使进展系统化,当发展的全景展现在我眼前时,不可避免地扩大了我的兴趣。我建议遵循的方针是从结构出发,进到性质,然后探究其基础,最后打算深入追究事物的原由。
(阿斯特伯里,1950,5)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















