中华管鞭虾多酚氧化酶生化特性研究
郑斌 杨会成* 郝云彬 钟明杰 周宇芳 付万冬 廖妙飞 吴亮亮
[作者简介]浙江省海洋开发研究院,浙江舟山,316100。*通讯作者。
[基金项目]浙江省水产品加工产业创新团队(2009R50031)。
[原载期刊]《浙江海洋学院学报(自然科学版)》2011年第6期。本文有删改。
海捕虾类以其含有蛋白质、微量元素及生理活性物质等丰富营养物质,其特有呈味物质所产生的口味与人们的最佳味觉非常吻合,味道鲜美,深受人们喜爱。但由于其体内的多酚氧化酶(PPO)引起一系列生化反应,在壳体上产生黑色素沉淀,即形成黑点[1]。壳上的黑点严重影响外观,同时也制约着它的商品价值。多酚氧化酶天然地存在于甲壳内和甲壳下面的组织中,这种酶在冷冻、冰贮和解冻期间仍然保持着活性[2]。目前,一般使用焦亚硫酸钠处理海捕虾黑变症状[3],但是焦亚硫酸钠处理的虾类产品中二氧化硫严重超标。
为了从根本上解决海捕虾等甲壳类产品的保鲜防黑变问题,本文选取东海区海捕虾中重要的种类——中华管鞭虾(Solenocera crassicornis)为研究对象,研究了其多酚氧化酶的分离纯化和各种成分对酚氧化酶的影响,以提取的多酚氧化酶液作为研究对象,对其重要的生化特性进行了研究,以期为开发新型海捕虾防黑变保鲜剂奠定理论基础。
1材料和方法
1.1原料
新鲜中华管鞭虾购自舟山国际水产城。
1.2主要试剂
L-DOPA,儿茶酚,胰凝乳酶,β-葡聚糖,4-己基间苯二酚(4-HR),苯酚,十二烷基硫酸钠(SDS),十二烷基磺酸钠,氯化钠,氯化钙,氢氧化钠,碳酸钠,L-维生素C、EDTA二钠、柠檬酸、山梨酸、碳酸镁、硫酸铜、硫酸铜等所用化学试剂均为分析纯。
1.3主要仪器与设备
TU1800PC分光光度计;恒温水浴锅(上海申胜生物技术有限公司);p H计(梅特勒—托利多仪器有限公司);电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司)。
1.4方法
1.4.1粗酶的制备
称取半解冻后的样品5 g,加入p H为7.0的预冷Tris-HCl缓冲液10 mL,震荡仪震荡3 min,低温超声提取5 min,1℃下静置4 h,10000 r/min离心10 min,所得上清液即为粗酶液。
1.4.2酚氧化酶的活性测定
参照ASHIDA等[4]的方法,以及国内其他文献采用的方法,并略做调整。以L-DOPA为特异性底物测定酚氧化酶的活性。具体测定时,取待测酶液100μL,与100μL 0.015 mol/L的L-DOPA充分混匀,于40℃恒温水浴中反应40 min后,加入2.8 m L预冷的纯净水终止反应。用分光光度计测定490 nm处的吸光值。每1 min吸光值增加0.001定义为1个酶活性单位(A 490·103/min)。
1.4.3 p H值对酶活性的影响
取适量p H值为5.0、6.0、7.0、8.0、9.0和10.0的缓冲液放置在1℃的环境下预冷。同时,取待测酶液100μL,与100μL 0.015 mol/L的L-DOPA充分混匀,于40℃恒温水浴中反应。40 min后,加入0.28 m L预冷的缓冲液终止反应。用TU1800PC分光光度计测定490 nm处的光吸收。每1min吸光值增加0.001定义为1个酶活性单位(A 490·103/min)。
1.4.4温度对酶活性的影响
取待测酶液100μL,与100μL 0.015 mol/L的L-DOPA充分混匀,分别于20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃下恒温水浴中反应。40 min后,加入2.8 m L预冷的纯净水终止反应。分别对酚氧化酶的活性进行测定,以确定其最适反应温度。
1.4.5酚氧化酶的底物特异性
配置浓度均为0.015 mol/L的L-DOPA、儿茶酚、对苯二酚和苯酚。
分别取待测酶液100μL,与100μL 0.015 mol/L的L-DOPA、儿茶酚、对苯二酚和苯酚充分混匀,于40℃恒温水浴中反应40 min后,加入2.8 m L预冷的纯净水终止反应。用分光光度计测定490 nm处的光吸收。
1.4.6酚氧化酶的酶学动力学性质
以L-DOPA为底物,所用浓度分别为1 mmol/L、2 mmol/L、3 mmol/L、5 mmol/L、7.5mmol/L、10 mmol/L、12.5mmol/L和15 mmol/L。取待测酶液100μL,与100μL不同浓度的L-DOPA充分混匀,于40℃恒温水浴中反应40 min后,加入2.8m L预冷的纯净水终止反应。用TU1800PC分光光度计测定490 nm处的光吸收(以实验条件下每min A 490增长0.001定义为一个酶活力单位,即A 490·103/min)。对所得到的A 490值使用Lineweaver-Burk双倒数作图法绘制出酚氧化酶的动力学曲线,并根据Wilkinson法计算其Km值。
1.4.7酚氧化酶的激活
(1)自然条件下的激活
在不使用激活剂的情况下,酚氧化酶通过适度加热、与空气接触等都可以被激活。新提取的酚氧化酶在1℃冷柜中短期保存的情况下,有一个缓慢的激活过程。为此,每隔8 h测定一次1℃条件下保存的酚氧化酶的活性变化,探索1℃条件下酚氧化酶的活性变化规律。
(2)使用激活剂激活酚氧化酶
分别配置10 mmol/L的胰凝乳酶、β-葡聚糖、十二烷基硫酸钠(SDS)、十二烷基磺酸钠、氯化钠、氯化钙、氢氧化钠、碳酸钠、硫酸镁溶液。
取新提取的粗酶液100μL,分别加入10 mmol/L的胰凝乳酶、β-葡聚糖、十二烷基硫酸钠(SDS)、十二烷基磺酸钠、氯化钠、氯化钙、氢氧化钠、碳酸钠、硫酸镁溶液100μL,于40℃恒温水浴中反应20 min后,加入100μL 15 mmol/L的L-DOPA溶液,再次放入40℃恒温水浴中反应20 min后,加入2.7 m L预冷的纯净水终止反应。测定490 nm处的光吸收。
对照管采用100μL纯净水代替激活剂,其他条件不变。
1.4.8酚氧化酶的抑制
分别配置具有一定质量浓度梯度序列的山梨酸、柠檬酸、L-抗坏血酸、EDTA二钠、碳酸镁、硫酸铜、4-己基间苯二酚和硫脲等酚氧化酶抑制剂。
取经过活化处理的酚氧化酶提取液100μL,分别加入配好的一定浓度的抑制剂100μL,于40℃恒温水浴中反应20 min后,加入100μL 15 mmol/L的L-DOPA溶液,再次放入40℃恒温水浴中反应20 min后,加入2.7 mL预冷的纯净水终止反应。测定490 nm处的光吸收。
对照管采用100μL纯净水代替抑制剂,其他条件不变。
2结果分析

图1 不同p H值对酚氧化酶活性的影响
2.1酚氧化酶的最适反应p H
图1是在不同p H值环境条件下的酶活性测定结果。从图中可以看出,p H为8.0时酚氧化酶活性最高。而在p H低于8.0时,酚氧化酶活性随着p H值的升高而逐渐升高;在p H等于8.0时达到峰值;当p H超过8.0后,酚氧化酶活性又随着p H值的升高而逐渐降低。因此,中华管鞭虾酚氧化酶对L-DOPA的最适p H为8.0。
2.2酚氧化酶的最适反应温度
图2是不同温度条件对酚氧化酶活性的影响。从图中可以看出,45℃时的酚氧化酶的活性最高。当温度在25~45℃时,酚氧化酶的活性随着温度的升高而逐渐升高;超过45℃以后,酚氧化酶的活性则随着温度的升高而迅速降低;在60℃时酚氧化酶活性仅为45℃时的18.9%。因此,以L-DOPA为底物,中华管鞭虾的最适反应温度为45℃。
2.3酚氧化酶的底物特异性
由图3可以看出,酚氧化酶能够氧化L-DOPA和儿茶酚。但不能氧化对苯二酚和苯酚。

图2 不同温度对酚氧化酶活性的影响

图3 酚氧化酶的底物特异性
2.4酚氧化酶的酶动力学性质
如图4所示,利用Lineweaver-Burk双倒数作图法绘制酶动力学曲线。经测试,在40℃、p H 8.0时(优化试验后酚氧化酶的提取p H值定为8.0),中华管鞭虾酚氧化酶对L-DOPA的Km值为4.70 mmol/L。

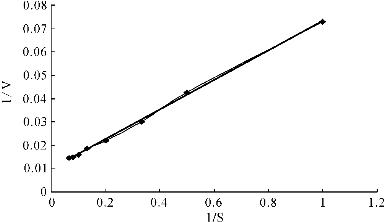
图4 酚氧化酶的酶动力学曲线
2.5酚氧化酶的激活
2.5.1自然条件下激活
如图5所示,由于中华管鞭虾酚氧化酶绝大多数以酚氧化酶原的形式存在,因此经提取后,放置在1℃环境下会发生激活反应。随着贮存时间的延长,在48小时内,酚氧化酶的活性逐渐增大。但酶的激活和失活是同时存在的,当一段时间后,酶的失活速度大于能够激活的酶的激活速度时,酶的活性开始降低。对保存在1℃条件下的管鞭虾酚氧化酶而言,这个临界点在48小时附近。其中,40小时时的酶活性是48小时时的95.6%;56小时时的酶活性是48小时时的94.1%。而32小时和64小时时的酶活性为48小时时的80%以上,但不足85%。为了保证试验的稳定,实验测定应尽量在酶的活性最大的一段时间内进行。因此,自然激活条件下,应尽量在酶提取后40小时到56小时这一时间段内进行。
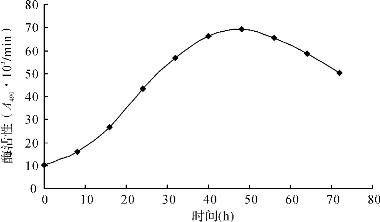
图5 酚氧化酶1℃条件下的活性变化
2.5.2激活剂对酚氧化酶的激活
在试验所选的激活剂中,氯化钠、氢氧化钠和碳酸钠对管鞭虾酚氧化酶的活性没有明显影响。胰凝乳酶、β-葡聚糖、十二烷基硫酸钠(SDS)、十二烷基磺酸钠、氯化钙和硫酸镁对中华管鞭虾酚氧化酶的激活作用,如图6所示。其中,十二烷基硫酸钠(SDS)对酚氧化酶的激活作用最大,激活率为71.9%;其次为胰凝乳酶,对中华管鞭虾酚氧化酶的激活率为62.4%;β-葡聚糖的激活率为33.4%;其他均不足30%。

图6 不同激活剂对酚氧化酶的激活效果
从图5和图6可以看出,将新提取的中华管鞭虾酚氧化酶在1℃放置40h能达到很好的激活效果。其激活效果好过使用化学激活剂。因此实验测定应尽量使用提取出静置激活40~56h的酚氧化酶粗酶液。
2.6抑制剂对酚氧化酶的抑制作用
利用配置一定质量浓度序列的山梨酸、柠檬酸、L-抗坏血酸、EDTA二钠、碳酸镁、硫酸铜、4-己基间苯二酚[3,5,6]和硫脲等抑制剂进行抑制试验发现,同一质量浓度时不同抑制剂具有不同的抑制效果。其中,同一质量浓度时,4-己基间苯二酚具有最大的抑制效果,其次为EDTA二钠。通过表1得出4-己基间苯二酚对中华管鞭虾的抑制作用最为强烈。其次依次为硫酸铜、EDTA二钠、L-抗坏血酸、柠檬酸、硫脲、山梨酸,测试样品中对中华管鞭虾酚氧化酶抑制效果最弱的是碳酸镁。
表1 各种酚氧化酶抑制剂对酚氧化酶活性的影响

3结论
本文通过对中华管鞭虾多酚氧化酶的活性进行研究,得出以下结论。
中华管鞭虾酚氧化酶的最适反应温度为45℃,当温度超过50℃酶反应呈现出不稳定性,温度超过55℃则酶反应速率迅速下降。同时,得出酚氧化酶的最适反应p H为8.0。40℃、p H 8.0条件下的中华管鞭虾酚氧化酶的Km值为4.70 mmol/L。
在激活剂对中华管鞭虾酚氧化酶的激活试验中,氯化钠、氢氧化钠和碳酸钠对管鞭虾酚氧化酶的活性没有明显影响。胰凝乳酶、β-葡聚糖、十二烷基硫酸钠(SDS)、十二烷基磺酸钠、氯化钙和硫酸镁等对中华管鞭虾酚氧化酶有明显的激活作用。其中,十二烷基硫酸钠(SDS)的激活作用最大,激活率为71.9%;其次为胰凝乳酶,激活率为62.4%;β-葡聚糖的激活率为33.4%;其他均不足30%。
研究表明,4-己基间苯二酚对中华管鞭虾的多酚氧化酶抑制作用最为强烈。另外,对于传统的抑制剂硫酸铜、EDTA二钠、L-抗坏血酸、柠檬酸和硫脲等也具有较强的抑制作用,这与陈丽娇[5]、汪小锋[6]等和赵晓[7]等的研究结果类似。
[1]MONTERO P,AVALOS A,PEREZ-MATEOS M.Characterization of Polyphenoloxidase of Prawns (Penaeus japonicus),Alternatives to Inhibition:Additives and High-pressure Treatment[J].Food Chemistry,2001(75):317—324.
[2]MARTINEZ-ALVAREZ O,LOPEZ-CABALLER M E,et al.Spraying of 4-hexylresorcinol Based Formulations to Prevent Enzymatic Browning in Norway Lobsters During Chilled Storage[J].Food Chemistry,2007(100):147—155.
[3]MENDES R,PESTANA J.Changes in 4-Hexylresorcinol Residues During Processing of Deepwater Pink Shrimp[J].Eur Food Res Technol,2006(223):509—515.
[4]ASHIDA M,DOHKE K.Activation of Prophenoloxidase by the Aetivating Enzyme of the Silkworm,Bombyx mori[J].Insect Bioehem,1980(10):37—47.
[5]陈丽娇,郑明锋,李怡宾.南美白对虾多酚氧化酶的生化特性[J].福建农林大学学报(自然科学版),2004(9):377—380.
[6]汪小锋,樊廷俊.中国对虾酚氧化酶的部分生物化学特性的初步研究[J].海洋科学,2003,27(4):71—75.
[7]赵晓,戚晓玉.日本对虾的酚氧化酶特性的研究[J].上海水产大学学报,1997,6(3):157—165.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















