动力Cd-Ni蓄电池是一种常用的碱性蓄电池,因正、负极活性物质含有镉和镍而得名。正极材料为氢氧化亚镍和石墨粉的混合物,负极材料为海绵状镉粉和氧化镉粉,电解液通常为氢氧化钠或氢氧化钾溶液。在密闭型Cd-Ni电池中,化学反应产生的各种气体不用排出,可以在电池内部化合。与铅酸蓄电池比较,Cd-Ni电池的寿命长、抗冲击能力强、低温性能好、耐过充放电能力强、结构紧凑、维护简单,密闭式电池可以以任何放置方式加以利用,无须维护,大量应用于小型电子设备、大型逆变器、电动工具领域,曾经一度占领整个小型二次电池市场。
3.3.1 动力Cd-Ni蓄电池的工作原理
Cd-Ni电池充电后,正极板上的活性物质变为羟基氧化镍,负极板上的活性物质变为金属镍;Cd-Ni电池放电后,正极板上的活性物质变为氢氧化镍,负极板上的活性物质变为氢氧化镉。
Cd-Ni电池充放电的化学反应方程式:
正极反应
负极反应
总反应
充电时,随着Ni OOH浓度的增加、Ni(OH)2浓度的减小,正极的电势逐渐上升,而随着Cd的增多、Cd(OH)2的减少,负极电势逐渐降低,当电池充满电时,正极、负极电势均达到一个平衡值,两者电动势之差即为电池的充电电压。
Cd-Ni电池充电时,电池电压缓慢上升,充满时可达1.5V(有的旧电池可达1.55V甚至1.6V)。一般来说,用较大的电流充电,电池充满时电压也较高;用较小的电流长时间充电,即使充满了电,电池电压也不到1.5V。停止充电的Cd-Ni电池,电压会很快降到1.35 V左右,然后缓慢地降到1.3V左右。
Cd-Ni电池放电时,电压缓慢下降,有较平稳的放电电压平台。当电压降低至1.15V以下时,电压下降的速度会越来越快。当电压降至0.9V时,应停止放电,否则会发生过放电。过放电期间,电压迅速下降,对电池造成损伤,缩短使用寿命。因此,一般放电应尽量使电池电压在0.9V以上。电池放电完成后,电压会很快回升至1.2V左右,所以不能用测量电压的方法来判断电池内部剩余电量的多少。
在动力电池组中,如果有个别容量较小的Cd-Ni电池在过放电后继续放电,该电池的电压会快速下降至零,继而变成负电压。此时该电池不但不再为电池组出力,反而会消耗其他电池的能量,使整组电池的电压下降,工作电流减小,导致整组电池的工作时间缩短。如果出现这种情况,应停止放电并更换新电池。
1. 镍电极的反应机理
镍电极充电时,首先是电极中Ni(OH)2颗粒表面的Ni2+失去电子成为Ni3+,电子通过正极中的导电网络和集流体向外电路转移;同时Ni(OH)2颗粒表面晶格OH-中的H+通过界面双电层进入溶液,与溶液中的OH-结合生成H2O。上述反应是发生在Ni(OH)2颗粒的表面层,使得表面层中质子H+浓度降低,而颗粒内部仍保持较高浓度的H+。由于存在浓度梯度,H+从颗粒内部向表面层扩散。
由于Ni(OH)2颗粒是一种电子导电性差的P型半导体,在KOH溶液中添加Li OH(每升电解液加15~20g),可增大电极在充电时缺陷和质子的扩散速度,减缓铁离子对镍电极的氧化影响,改善晶粒度和活性物质的利用率,使电池的性能在高温时更稳定。
镍电极充电时,由于质子H+在Ni OOH/Ni(OH)2颗粒中的扩散系数小,颗粒表面的质子浓度低,在极限情况下会降低到零,这时会发生:
Ni OOH+ → Ni O2+H2O+e-(3-4)
→ Ni O2+H2O+e-(3-4)
电极电势的升高,导致溶液中的OH-被氧化,会发生:
4OH-+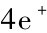 → O2↑+2H2O (3-5)
→ O2↑+2H2O (3-5)
在充电过程中,镍电极上会有O2析出,但这并不表示充电过程已全部完成,而活性物质颗粒内部仍有Ni(OH)2存在。一般情况下,充电不久镍电极上就会有氧气析出,这是镍电极的一个缺点。一般情况下,表面层中生成的Ni O2是掺杂在Ni OOH的晶格中存在的。Ni O2不稳定,会发生分解,析出氧气,即
镍电极成流反应与充电过程相反,溶液中的H+越过界面双电层进入固相,在表面层中占据质子缺陷与O2-结合生成OH-,临近的Ni3+与从外电路传输来的电子结合成为Ni2+。随着放电反应的进行,Ni OOH/Ni(OH)2颗粒表面层中H+增多,就会发生质子向活性物质颗粒内部扩散。由于质子在固相中扩散速率很小,会引起较大的浓差极化,使阴极电势变负。
2. 镉电极的反应机理
Cd-Ni电池的负极活性物质为海绵状金属镉,放电产物是难溶于KOH溶液的Cd(OH)2。镉电极的放电反应机理是溶解-沉淀机理,放电时Cd被氧化,生成Cd(OH)-3进入溶液,然后形成Cd(OH)2沉积在电极上。Cd电极的放电机理是首先发生OH-吸附:
Cd+ →— Cd-OH吸附+e- (3-7)
→— Cd-OH吸附+e- (3-7)
随着电极电势不断升高,镉进一步氧化,生成Cd( 进入溶液:
进入溶液:
Cd-OH吸附+2 →— Cd(
→— Cd( +e- (3-8)
+e- (3-8)
当界面溶液中Cd(OH)-3过饱和时,Cd(OH)2就沉积下来:
Cd(OH)-3
→— Cd(OH)2↓+OH- (3-9)
生成的Cd(OH)2附着在电极表面,形成疏松多孔的Cd(OH)2,有利于溶液中的OH-继续向电极内部扩散,使内部的海绵状镉也通过溶解-沉积过程转变为Cd(OH)2,实现内部活性物质的放电。镉电极的放电深度比较大,活性物质利用率高。
3.3.2 动力Cd-Ni蓄电池的正极材料
1. 正极活性物质
动力Cd-Ni电池的正极为氢氧化镍电极,其活性物质放电状态为Ni(OH)2,充电状态为Ni OOH,它是被广泛应用于Cd-Ni、Fe-Ni、Zn-Ni和MH-Ni等碱性蓄电池的正极活性物质。普通的Ni(OH)2颗粒形状不规则,晶粒尺寸范围较宽,振实密度约为1.6g/cm3。随着蓄电池的迅速发展,要求氢氧化镍有高的电化学活性和高的堆积密度。球形氢氧化镍外表呈球形或椭圆形,如图3-2所示,颗粒大小均匀,振实密度为1.9~2g/cm3,具有高活性和较好的流动性等特点。人们在球形氢氧化镍材料的制备过程中加入添加剂,如Co2+、Zn2+和Cd2+等,这些添加剂能明显改善电极性能。
球形氢氧化镍的制备方法有氨催化液相沉淀法、高压合成法、离子交换树脂法、化学平衡竞争法等,其中氨催化液相沉淀法工艺简单、设备投资少、产品质量高,是目前常用的方法。氨催化液相沉淀法生产球形Ni(OH)2的技术条件是:在50±2℃,p H=10.8±0.1条件下,Ni SO4、Na(OH)2和氨水并流加入反应容器中,反应14h制得堆积密度1.82g/cm3的球形均匀Ni(OH)2颗粒。
图3-2 覆钴球形氢氧化镍扫描电镜照片
Ni(OH)2有α、β两种晶型,Ni OOH有β、γ两种晶型,目前用于碱性二次电池的氢氧化镍均为β型,由层状结构的六方单元晶胞组成。
2. 镍电极添加剂
由于Ni OOH放电到一定深度时,导电性不好的Ni(OH)2增多,电荷传输成为镍电极放电的控制步骤之一,造成活性物质利用率很低。在镍电极活性物质中添加钙、钴、锌及某些稀土元素对镍电极的性能改善非常明显。
1)钴粉的作用
钴粉加入氢氧化镍电极后,可以提高氧的析出电位,降低镍电极的氧化电位,从而提高镍电极的充电效率;再者,钴可以有效抑制γ-Ni OOH的形成,以防镍电极的膨胀,从而保持电极电性能的长期稳定;第三,钴被引入Ni(OH)2中形成固溶体,在Ni(OH)2晶格中形成晶格缺陷,增加了质子进出的自由度,增加了Ni2+和Ni3+电化学反应的可逆性,提高了反应活性;另外,钴粉的加入提高了电解质分解时的电压,降低了在充电时电极的极化作用。
一般地,钴粉在镍电极中的含量最高不能超过3.5%,否则钴粉的作用将降低。钴粉加入氢氧化镍电极中,在活化阶段的充电过程中被氧化成Co3+,虽然放电时不参与反应,对电极容量并无贡献,但Co3+扩散渗入Ni(OH)2晶格中形成固溶体,并使晶格产生形变,增加了晶体缺陷,从而促进了质子在固相中的扩散,促进了Ni2+的相变,从而提高了活性物质利用率,并且由于Co OOH比Ni OOH导电性好,从而降低了放电残余容量,提高了镍电极的充放电循环寿命。研究还发现,加入Co2+比钴原子效果更好,因为Co2+比Co原子更易发生氧化反应形成Co3+,活性物质中加入少许镉粉或锌粉主要是使电极反应稳定在β-Ni OOH与β-Ni(OH)2之间进行,从而减少电极膨胀,强化析氧极化。
氢氧化镍电极中有的添加钴粉,有的添加一氧化钴,有的添加氢氧化钴,它们都能提高镍氢电池电性能。但以一氧化钴活性最好,一氧化钴极易与氧气或空气反应生成高价钴氧化物而失去活性,另外操作中需用惰性气体保护以防失火。
2)锌的作用
加锌当然会影响部分容量,但不会降低合金粉活性。当锌含量大于1%时,有抑制γ-Ni OOH生成的作用。锌在氧化镍电极中的最佳含量为20%。选择高密度的加锌球镍,可以降低正极膨胀,提高电池放电平台,提高循环寿命。
3)镍粉的作用
Ni(OH)2是很好的质子导体,却是很差的电子导体,其电化学活性发生在导体Ni OOH和非导体Ni(OH)2界面。镍电极在放电时,活性物质Ni OOH和集流体间存在着已被还原的Ni(OH)2阻挡层,Ni(OH)2的半导体性质阻止了其他Ni OOH获得电子还原为Ni(OH)2。镍粉的加入可大大改善Ni(OH)2和集流体间的导电环境,在镍电极中起收集电流的作用。一般地,镍粉在镍电极中的含量最高不能超过10%~13%。
4)稀土的作用
掺杂La、Nd能使镍电极比容量和可逆性均得到提高。由于氢氧化镍属于P型半导体,电极反应通过质子与空穴的定向移动来进行,当掺杂稀土元素后,引入大量的正缺陷,相对于未掺杂的晶体,增大了质子扩散能力。另外,还能降低Ni2+的外层电子轨道能级,使Ni(OH)2晶格畸变,显著改善晶体的质子扩散能力。混合稀土(Er、Tm、Yb、Lu)的氧化物可显著提高镍电极的吸氧过电势,尤其是在高温下更具有优越性。
图3-3所示是不同添加剂对正极活性物质利用率的影响。
图3-3 不同添加剂对镍电极活性物质利用率的影响比较
总之添加剂对镍电极的主要作用表现为:
(1)提高镍电极活性物质的利用率;
(2)改善镍电极充放电电势;
(3)提高镍电极的使用寿命;
(4)改善镍电极的储存性能,降低镍电极自放电;
(5)改善镍电极在宽温度范围内的使用性能和大电流放电能力。
3.3.3 动力Cd-Ni蓄电池的负极材料
Cd-Ni电池的负极活性物质为海绵状金属镉,一般首选制备Cd O,Cd O在电池化成时将转化为海绵状金属镉。Cd O在制备时,将金属镉在900~1000℃升华为镉蒸气,然后在氧化室内被氧化成浅棕红色至棕红色的Cd O。由于海绵状镉在充放电过程中有凝结的倾向,会导致电极容量降低,所以要添加海绵状铁。
电沉积方法制备镉电极:采用Cd Cl2溶液,加入适量亚铁盐,金属镉为阳极,冲孔镀镍钢带为阴极,钢带依次经过电沉积海绵状镉、一次辊压、一次烘干、浸渍镍盐、二次烘干、二次辊压、剪切而得到镉电极。小的电流密度和低溶液浓度有利于电沉积出较细的镉微粒,温度过高和电流密度过大会使沉积镉的附着力差。
镉是不易钝化的金属,它的低温性质比较好。但在较高的过电势下,镉电极也会发生钝化,生成一层很薄的Cd O钝化膜,阻碍金属的正常溶解。在放电电流密度过大、温度较低、电解液浓度较低时,容易引起镉电极钝化。另外,由于海绵状镉充放电循环过程中发生重结晶,会使镉电极真实表面积不断减小,极化增大,发生钝化。
为了阻止海绵状镉充放电时凝结,需要在活性物质中加入表面活性剂或其他添加剂,一般加入苏拉油或25号变压油。为提高电流密度,还可以加入Fe、Co、Ni等作为添加剂,Fe、Co、Ni可提高电极的放电电流密度。
镉电极的自放电很小,由于镉电极氧化的标准电极电势比氢析出的标准电极电势正,而且Cd是高析氢过电势金属。正常充电状态下,金属镉在碱液中不会自发地溶解而析氢气,只有当充电状态接近100%时,才会有氢气析出。通常镉电极的自放电是氧对海绵状金属镉的化学氧化而造成的。
3.3.4 动力Cd-Ni蓄电池的性能
Cd-Ni蓄电池放电电压平稳度好,容量受放电倍率影响小,能耐受大电流(高于正常使用电流的几倍乃至10倍的瞬时冲击而不损坏),适应苛刻环境,使用温度范围宽( -40~50℃),维护简单,保存方便,安全可靠,可充放电循环500~1000次,能做成容量不同和形状不同的产品。图3-4所示为镉镍袋式蓄电池,生产工艺为袋式工艺,蓄电池由正极活性物质、负极活性物质分别包在穿孔钢带中经加工而成正极板组和负极板组,以绝缘物隔离正、负极板,牢固地装在塑料外壳内。蓄电池盖上留有注液口,平时顶端装有带出气孔的塑料气塞,需要注入电解液时可以随时打开,它既能排除电池内部产生的气体,又可以防止杂物及灰尘落入蓄电池内。
图3-4 镉镍袋式蓄电池
1. 充放电特性
Cd-Ni电池的标准电动势为1.299V,标称电压为1.2V,平均工作电压为1.20~1.25 V。刚充足电的电池开路电压较高,超过1.4V,放置一段时间后,正极不稳定的Ni O2发生分解,开路电压会降到1.35V左右。
Cd-Ni电池充电开始时,电池电压在1.3V左右,随着充电进行,电压慢慢上升到1.4~1.5V并稳定较长时间。充电电压超过1.55V时,电解液中的水开始电解,产生气体,电压开始急剧上升。到充电末期,正、负极上都开始析出气体,电池电压达到1.7~1.8V。
Cd-Ni电池的放电曲线比较平稳,只是在放电终止时突然下降,一般以0.2C放电时,电压稳定在1.2V左右。电池放置一段时间后再放电,由于Ni O2的分解,初期放电电压稍有降低,容量也稍有减小。Cd-Ni电池放电终止电压的规定与放电倍率有关,一般在1.0V左右。
Cd-Ni电池允许大电流放电而不会损坏,允许的放电倍率在10C以上,但是大电流放电时,电压下降快,不能足额释放出电池储存的全部电能。Cd-Ni电池是随放电倍率的加大,容量下降最小、比容量保持最好而无损坏的电池。图3-5所示是Cd-Ni电池的充放电曲线。
图3-5 Cd-Ni电池的充放电曲线
(a)20℃下0.2C充电曲线;(b)20℃下0.2C放电曲线;(c)20℃下不同放电倍率曲线
2. 高低温放电性能
温度升高,Cd-Ni电池的容量增加,但超过50℃时,正极的析氧过电势降低,正极充电不完全;镉的溶解会随温度上升而增大,迁移到隔膜中,容易形成镉枝晶,导致电池内部微短路;高温还会加速镍极板腐蚀和隔膜氧化,导致电池失效。
由于Cd-Ni电池在成流反应中,氢氧化钾电解质只起电荷传递作用,这给电池容量、电压、充放电电流和低温性能等提供了很好的条件。低温下,电解液的电阻增大,会使Cd-Ni电池的容量下降。-45℃以0.2C放电,提供40%以上的额定容量; -18℃以3C放,电放出额定容量的30%以上。对于密封Cd-Ni电池,使用温度范围受限,但在-20~30℃之间仍可获得较好的工作特性。
3. 循环寿命与效率
在正常使用的条件下,镍镉电池的容量效率ηA·h为67%~75%,电能效率ηW·h为55%~65%,循环寿命约为2000次。
容量效率ηA·h和电能效率ηW·h计算公式如下:
式中,U充和U放应取平均电压。
4. 内阻
镍镉蓄电池的内阻与电解液的导电率、极板结构及其面积有关,而电解液的导电率又与密度和温度有关。电池的内阻主要由电解液的电阻决定。氢氧化钾和氢氧化钠溶液的电阻系数随密度而变。18℃时氢氧化钾溶液和氢氧化钠溶液的电阻系数最小。
5. 端电压
充足电后,立即断开充电电路,镍镉蓄电池的电动势可达1.5V左右,但很快就下降到1.31~1.36V。镍镉蓄电池的端电压随充放电过程而变化,可用下式表示:
U充=E充+I充R内 (3-12)
U放=E放-I放R内(3-13)
从式(3-12)和式(3-13)可以看出,充电时,电池的端电压比放电时高,而且充电电流越大,端电压越高,放电电流越大,端电压越低。
当镍镉蓄电池以标准放电电流放电时,平均工作电压为1.2V。采用8h放电率放电时,蓄电池的端电压下降到1.1V后,电池即放完电。
6. 记忆效应
镍镉电池使用过程中,如果电量没有全部放完就开始充电,下次再放电时,就不能放出全部电量。比如,镍镉电池只放出80%的电量后就开始充电,充足电后,该电池也只能放出80%的电量,这种现象称为记忆效应。
电池全部放完电后,极板上的结晶体很小。电池部分放电后,氢氧化亚镍没有完全变为氢氧化镍,剩余的氢氧化亚镍将结合在一起,形成较大的结晶体。结晶体变大是镍镉电池产生记忆效应的主要原因。
7. 容量和影响容量的主要因素
蓄电池充足电后,在一定放电条件下,放至规定的终止电压时,电池放出的总容量称为电池的额定容量,容量Q用放电电流与放电时间的乘积来表示,即
Q=I·t(A·h) (3-14)
镍镉蓄电池容量与下列因素有关:
(1)活性物质的数量;
(2)放电率;
(3)电解液。
放电电流直接影响放电终止电压,在规定的放电终止电压下,放电电流越大,蓄电池的容量越小。
使用不同成分的电解液,对蓄电池的容量和寿命有一定的影响。通常,在高温环境下,为了提高电池容量,常在电解液中添加少量氢氧化锂,组成混合溶液。实验证明:每升电解液中加入15~20g含水氢氧化锂,在常温下,容量可提高4%~5%,在40℃时,容量可提高20%。然而,电解液中锂离子的含量过多,不仅使电解液的电阻增大,还会使残留在正极板上的锂离子(Li+)慢慢渗入晶格内部,对正极的化学变化产生有害影响。
电解液的温度对蓄电池的容量影响较大。这是因为随着电解液温度升高,极板活性物质的化学反应也逐步改善。电解液中的有害杂质越多,蓄电池的容量越小,主要的有害杂质是碳酸盐和硫酸盐。它们能使电解液的电阻增大,并且低温时容易结晶,堵塞极板微孔,使蓄电池容量显著下降。此外,碳酸根离子还能与负极板作用,生成碳酸镉附着在负极板表面上,从而引起导电不良,使蓄电池内阻增大,容量下降。
3.3.5 动力Cd-Ni蓄电池的应用
Cd-Ni电池具有循环寿命长、比功率高、密封性能好、充放电性能佳、性价比高等优点,因而得到了广泛的应用。大型袋式和开口式镉镍电池主要用于铁路机车、装甲车辆、飞机发动机等作启动或应急电源;圆柱密封式镉镍电池主要用于电动工具、剃须器等便携式电器;小型扣式镉镍电池主要用于小电流、低倍率放电的无绳电话、电动玩具等,如图3-6所示。
图3-6 应用动力Cd-Ni蓄电池的电动工具
由于废弃镉镍电池对环境的污染,且镉被人吸收后,会置换骨骼里的钙而引起骨裂、骨折,即镉造成的“骨痛病”,该系列的电池将逐渐被性能更好的金属氢化物镍电池所取代。
法国SAFT公司前些年生产的Cd-Ni电池已誉满全球,而我国某公司自主研制的GNC170-(5)阀控式Cd-Ni电池也已成功应用于一些新兴的内燃机车上。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















