煤炭气化过程是一个热化学过程,它包括煤的热解和煤的气化反应两部分。 煤在加热时会发生一系列复杂的物理变化和化学变化,显然,这些变化主要取决于煤种,同时也受温度、压力,加热速率和气化炉型式等影响。
煤炭气化反应是指气化剂(空气、水蒸气、富氧空气、工业氧气以及其相应混合物等)与碳质原料之间的反应,以及反应产物与原料、反应产物之间的化学反应。
一、煤炭气化过程中煤的热解
1.煤的热解
热解是煤受热后,自身发生一系列物理和化学变化的复杂过程。 对此过程的命名尚未统一。 除热解这一名称外,习惯上长期应用“干馏”作传统名称,还有热分解也常被采用。 炼焦过程是典型而完整的在隔绝空气条件下的煤热解例子。 由于煤是矿物质,有机大分子化合物等组成的极复杂的混合物质,受热之后所发生的变化与煤自身的化学特性、孔隙结构以及热条件等密切相关。
煤炭气化过程中煤的热解有别于炼焦和煤液化过程中煤的热解行为,其主要区别在于:
①块状或大颗粒状煤存在的固定床气化过程中,热解温度较低,按煤焦加工惯例,属低温热解(干馏〕的区段了。
②热解过程中,床层中煤粒间有较强烈的气流流动,不同于炼焦炉中自身生成物的缓慢流动;其对煤的升温速率及热解产物的二次热分解反应影响较大。
③在粉煤气化(沸腾床和气流床)工艺中,煤炭中水分的蒸发、煤热解以及煤粒与气化剂之间的化学反应几乎是同时并存,且在短暂的时间内完成。
2.煤热解过程的物理形态变化
在煤热解阶段,煤中的有机质随温度的提高而发生一系列变化,其结果为逸出煤中的挥发分,并残存半焦或焦炭.煤的热解过程大致分为3个阶段。
(1)第一阶段(从室温到350℃)
从室温到活泼热分解温度为干燥脱气阶段,煤的外形无变化。150℃前主要为干燥阶段。 在150~200℃时,放出吸附在煤中的气体。 主要为甲烷、二氧化碳和氮气。 当温度达200℃以上时,即可发现有机质的分解。 如褐煤在200℃以上发生脱羧基反应,300℃左右时开始热解反应。 烟煤和无烟煤的原始分子结构仅发生有限的热作用(主要是缩合作用)。
(2)第二阶段(350~550℃)
在这一阶段,活泼分解是主要特征。 以解聚和分解反应为主,生成大量挥发物(煤气及焦油),煤黏结成半焦。 煤中的灰分几乎全部存在于半焦中,煤气成分除热解水、一氧化碳和二氧化碳外,主要是气态烃。 烟煤(尤其是中等煤阶的烟煤)在这一阶段经历了软化、熔融、流动和膨胀直到再固化。 出现了一系列特殊现象,并形成气液固三相共存的胶质体。 在分解的产物中出现烃类和焦油的蒸气,在450℃左右时焦油量最大,在450~554℃温度范围内,气体析出量最多。 黏结性差的气化用煤,胶质体不明显,半焦不能黏连为大块,而是松散的原粒度大小,或因受压受热而碎裂。
(3)第三阶段(550℃以上)
在这一阶段,以缩聚反应为主,又称二次脱气阶段。 半焦变成焦炭,析出的焦油量极少,挥发分主要是多种烃类气体、氢气和碳的氧化物。
3.煤热解过程的化学反应
煤热解的化学反应异常复杂,其间反应途径甚多。 煤热解反应通常包括裂解和缩聚两大类反应。 在热解前期以裂解反应为主,热解后期以缩聚反应为主。 一般来讲,热解反应的宏观形式为:
煤 煤气(CO2,CH4,H2,CO,H2O,NH3,H2S)+焦油(液体)+焦炭 (3.1) 4.原料煤对煤热解的影响
煤气(CO2,CH4,H2,CO,H2O,NH3,H2S)+焦油(液体)+焦炭 (3.1) 4.原料煤对煤热解的影响
煤的煤化程度、岩相组成、粒度等都对煤热解过程有影响。 其中煤化程度是最重要的影响因素之一。 它直接影响煤热解起始温度、热分解产物等。 随着煤化程度的增加,热解起始温度逐渐升高。
年轻煤热解时,煤气、焦油和热解水产率高,煤气中CO,CO2和CH4含量多,残炭没有黏结性;中等变质程度的烟煤热解时,煤气和焦油的产率比较高,热解水少,残炭的黏结性强,而年老煤(贫煤以上)热解时,煤气和焦油的产率很低,残炭没有黏结性。
5.加热条件对煤热解的影响
加热条件如最终温度、升温速度对煤的热解过程均有影响。 从煤的热解过程来看,由于最终温度的不同,可以分为低温干馏(最终温度600℃ )、中温干馏(最终温度800℃)和高温干馏(最终温度1000℃)。 但在气化炉中,煤基本是低温干馏。 显然,这三种干馏所得产品产率、煤气组成都不相同。 低温干馏时煤气产率较低,而煤气中甲烷含量高。
根据热解过程升温速度的不同,可以分为4种类型:
①慢速加热,加热速度<5K/s。
②中速加热,加热速度5~100K/s。
③快速加热,加热速度100~106K/s。
④闪蒸加热,加热速度>106K/s。
固定床气化属于慢速加热。 流化床与气流床气化则具有快速加热裂解的特点。
二、气化过程中的气化反应与化学平衡
使用不同的气化剂可制取不同种类的煤气,主要反应都相同。 煤炭气化过程可分为均相和非均相反应两种类型。 即非均相的气-固相反应和均相气-气相反应。 生成煤气的组成取决于这些反应的综合过程。 由于煤结构很复杂,其中含有碳、氢、氧和硫等多种元素,在讨论基本化学反应时,一般仅考虑煤中主要元素碳和在气化反应前发生的煤的干馏或热解,即煤的气化过程仅有碳、水蒸气和氧参加,碳与气化剂之间发生一次反应,反应产物再与燃料中的碳或其他气态产物之间发生二次反应。 主要反应如下:
(1)一次反应
C+O2→CO2ΔH=-394.1k J/mol (3.2)
C+H2O →CO+H2ΔH=+135.0k J/mol (3.3)
C+ O2→CO ΔH=-110.4k J/mol (3.4)
O2→CO ΔH=-110.4k J/mol (3.4)
C+2H2O →CO2+2H2 ΔH=+96.6k J/mol (3.5)
C+2H2→CH4ΔH=+84.3k J/mol (3.6)
H2 O2→H2O ΔH=-245.3k J/mol (3.7) (2)二次反应
O2→H2O ΔH=-245.3k J/mol (3.7) (2)二次反应
C+CO2→2CO ΔH=+173.3k J/mol (3.8)
2CO+O2→2CO2ΔH=-566.6k J/mol (3.9)
CO+H2O →H2+CO2ΔH=-38.4k J/mol (3.10)
CO+3H2→CH4+H2O ΔH=-219.3k J/mol (3.11)
3C+2H2O →CH4+2CO ΔH=-185.6k J/mol (3.12)
2C+2H2O →CH4+CO2ΔH=-12.2k J/mol (3.13)根据以下反应产物,煤炭气化过程可用下式表示:
煤 C+CH4+CO+CO2+H2+H2O (3.14)
C+CH4+CO+CO2+H2+H2O (3.14)
在气化过程中,如果温度、压力不同,则煤气产物中碳的氧化物即一氧化碳与二氧化碳的比率也不相同。在气化时,氧与燃料中的碳在煤的表面形成中间碳氧配合物Cx Oy,然后在不同条件下发生热解,生成CO和CO2。即:
CxOy→m CO2+n CO (3.15)
因为煤中有杂质硫存在,气化过程中还可能同时发生以下反应:
S+O2→SO2
SO2+3H2→H2S+2H2O
SO2+2CO2→S+2CO2
2H2S+SO2→3S+2H2O
C+2S →CS2
CO+S →COS
N2+3H2→2NH3
N2+H2O+2CO →2HCN O2
O2
N2+x O2→2NOx
在以上反应生成物中生成许多硫及硫的化合物,它们的存在可能造成对设备的腐蚀和对环境的污染。 在后面的章节中,还要详细介绍硫及其化合物对煤气的危害及净化方法。
前已述及。 煤炭与不同气化剂反应可获得空气煤气、水煤气、混合煤气、半水煤气等。其反应后组成见表3.2.1。
表3.2.1 工业煤气组成

三、气化过程的化学平衡
煤的气化过程是一个热化学过程,影响其化学过程的因素很多,除了气化介质、燃料接触方式影响外,其工艺条件的影响也必须考虑。 为了清楚地分析、选择工艺条件,现首先分析煤炭气化过程中的化学平衡及反应速度。
在煤炭气化过程中,有相当多的反应是可逆过程。 特别是在煤的二次气化中,几乎均为可逆反应。 在一定条件下,当正反应速度与逆反应速度相等时,化学反应达到化学平衡。
m A+n B →p C+q D
V正=k正[p A]m[p B]n
V逆=k正[p C]p[p D]q
化学平衡时: k正[p A]m[p B]n=k逆[p C]p[p D]q

式中 Kp——化学反应平衡常数;
pi——各气体组分分压(i分别代表A、B、C、D),k Pa;
k正、k逆——分别为正、逆反应速度常数。
1.温度的影响
温度是影响气化反应过程煤气产率和化学组成的决定性因素。 温度对化学平衡的关系如下:

式中 R——气体常数,8.314k J/(kmol·K);
T——绝对温度,K;
ΔH——反应热效应,放热为负,吸热为正;
C——常数。
从上式可以看出:若ΔH为负值时,为放热反应,温度升高,Kp值减小,对于这类反应,一般来说降低反应温度有利于反应的进行。反之,若ΔH为正值时,即吸热反应,温度升高,Kp值增大,此时升高温度有利于反应的进行。
例如气化反应式(3.3)、式(3.8)其反应如下:
C+H2O →H2+CO ΔH=+135.0k J/mol
C+CO2→2CO ΔH=+173.3k J/mol
两反应过程均为吸热反应,在这两个反应进行过程中,升高温度,平衡向吸热方向移动,即升高温度对主反应有利。
C与CO2反应生成CO,反应如式(3.8)所示,反应在不同温度下CO2与CO的平衡组成见表3.2.2,如图3.2.1所示。
表3.2.2 在不同温度下的反应中CO2与CO的平衡组成

从表3.2.2中可以看到,随着温度升高,其还原产物CO的含量增加。 当温度升高到1000℃时,CO的平衡组成为99.1%。

图3.2.1 不同温度下的反应中CO与CO2的平衡组成
2.压力的影响
平衡常数Kp不仅是温度函数,而且随压力变化而变化。压力对于液相反应影响不大,而对于气相或气液相反应平衡的影响是比较显著的。CO2还原反应的平衡常数曲线如图3.2.2所示。 根据化学平衡原理,升高压力平衡向气体体积减小的方向进行;反之,降低压力,平衡向气体体积增加方向进行。 在煤炭气化的一次反应中,所有反应均为增大体积的反应,故增加压力,不利于反应进行。 可由下列公式得出:
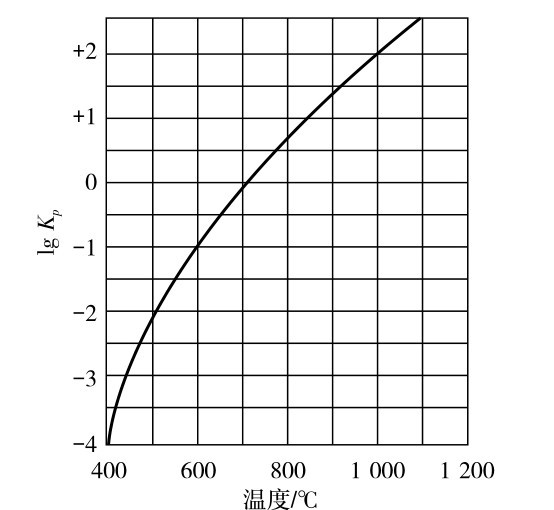
图3.2.2 CO2还原反应的平衡常数曲线
Kp=KN·gpΔu(3.18)式中 Kp——用压力表示的平衡常数;
KN——用物质的量表示的平衡常数;
Δu——反应过程中气体物质分子数的增加(或体积的增加)。
理论产率决定于KN,并随KN的增加而增大。当反应体系的平衡压力p增加时的pΔu值由Δu决定。
如果Δu<0,增大压力p后,pΔu减小。则由于Kp是不变的,如果KN保持原来的值不变,就不能维持平衡,所以当压力增高时KN必然增加,因此加压有利,即加压使平衡向体积减少或分子数减小的方向移动。
如果Δu>0,则正好相反,加压将使平衡向反应物方向移动,因此,加压对反应不利,这类反应适宜在常压甚至减压下进行。
如果Δu=0,反应前后体积或分子数无变化,则压力对理论产率无影响。
例如,在下列反应中:
C+CO2→2CO ΔH=+173.3k J/mol
Δu=2-1=1,此时Δu>0,即反应后气体体积或分子数增加,如增大压力,则使pΔu增大,平衡向左移动;相反,如此时减小压力,平衡则向右移动;因此上述反应适宜在减压下进行。
图3.2.3为粗煤气组成与气化压力的关系图,从图3.2.3中可见,压力对煤气中各气体组成的影响不同,随着压力的增加,粗煤气中甲烷和二氧化碳含量增加,而氢气和一氧化碳含量则减少。 因此,压力越高,一氧化碳平衡浓度越低,煤气产率随之降低。
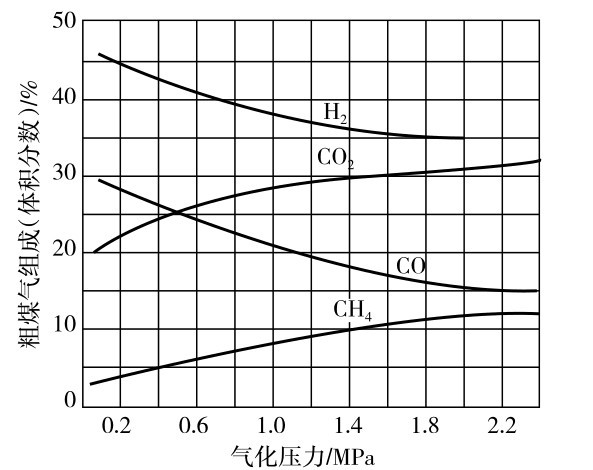
图3.2.3 粗煤气组成与气化压力的关系
由上述可知,在煤炭气化中,可根据生产产品的要求确定气化压力,当气化炉煤气主要用作化工原料时,可在低压下生产;当所生产气化煤气需要较高热值时,可采用加压气化。这是因为压力提高后,在气化炉内,在H2气氛中,CH4产率随压力提高迅速增加,发生如下反应:
C+2H2→CH4ΔH=-84.3k J/mol
CO+3H2→CH4+H2O ΔH=-219.3k J/mol
CO2+4H2→CH4+2H2O ΔH=-162.8k J/mol
2CO+2H2→CO2+CH4ΔH=-247.3k J/mol
上述反应均为缩小体积的反应,加压有利于CH4生成,而甲烷生成反应为放热反应,其反应热可作为水蒸气分解、二氧化碳等吸热反应热源,从而减少了碳燃烧中氧的消耗。 也就是说,随着压力的增加,气化反应中氧气消耗量减少;同时,加压可阻止气化时上升气体中所带出物料的量,有效提高鼓风速度,增大其生产能力。
在常压气化炉和加压气化炉中,假定带出物的数量相等,则出炉煤气动压头相等,可近似得出,加压气化炉与常压气化炉生产能力之比如下式所示:

对于常压气化炉,p1通常略高于大气压,当p1=0.1078MPa左右时,常压、加压炉的气化温度之比T1/T=1.1~1.25,可得:

V1=3.19~3.41 p2 (3.20)例如气化压力为2.5~3MPa的鲁奇加压气化炉,其生产能力将比常压下高5~6倍;又如(鲁尔-100)气化炉,当把压力从2.5MPa提高到9.5MPa时,粗煤气中甲烷含量从9%增至17%,气化效率从8%提高到85%。 煤处理量增加一倍.氧耗量降低10%~30%。 但是,从下列反应:
C+H2O →H2+CO ΔH=+135.0k J/mol
可知,增加压力,平衡左移,不利于水蒸气分解,即降低了氢气生成量。 故增加压力,水蒸气消耗量增多。
四、气化反应的反应速率
气化反应动力学的任务在于研究气化反应的速度和机理,以及各种因素对反应速度的影响。 煤的气化反应主要是非均相反应,其中既包含了化学过程—化学反应,又包含了物理过程—吸附、扩散、流体力学、热传导等,同时也有气体反应物之间的均相反应。 因此对气化反应动力学的研究也就包括化学反应机理及物理因素两个方面。
1.煤气化反应模型
在气化炉中煤首先进行脱挥发分和热分解,得到固体残留物—半焦。 随着热分解进行,将发生半焦与气体间的反应。 这种反应可以分为两类颗粒反应模式,即整体反应(或称容积反应)模型和表面反应(或称收缩未反应芯)模型。 整体反应主要在煤焦内表面进行,而表面反应则是反应气体扩散到固体颗粒外表面就反应了,很难扩散到煤焦内部。 两者都属于气固相反应。 通常当温度高时或反应进行得极快时,容易发生表面反应,如氧化反应、燃烧反应,而整体反应主要发生在多孔固体及反应速度较慢的情况下。
在整体反应模型中,反应气体扩散到颗粒的内部,分散渗透了整个固体,反应自始至终同时在整个颗粒内进行,产生的灰层在颗粒的孔腔壁表面逐渐积累起来。 固体反应物逐渐消失。
在表面反应模型中,反应气体很难渗透到固体颗粒的内部,流体一开始就与颗粒外表面发生反应。 随着反应的进行,反应表面不断向固体内部移动,并在已反应过的地方产生灰层。 未反应的核(即未反应芯)随时间变化不断收缩,反应局限于未反应核的表面。 整个反应过程中,反应表面是不断变小的。
2.气固相反应历程
对于气固相的气化反应,其总的气化历程通常必须经过如下7个步骤。
①反应气体由气相扩散到固体碳表面(外扩散)。
②反应气体再通过颗粒内孔道进入小孔的内表面(内扩散)。
③反应气体分子被吸附在固体碳的表面,形成中间络合物。
④吸附的中间络合物之间,或吸附的中间络合物和气相分子之间进行反应,其称为表面反应。
⑤吸附态的产物从固体表面脱附。
⑥物分子通过固体的内部孔道扩散出来(内扩散)。
⑦物分子由颗粒表面扩散到气相中(外扩散)。
由此可见,在总的反应历程中包括了扩散过程①、②、⑥、⑦和化学过程③、④、⑤,扩散过程又分为外扩散与内扩散;化学过程包括了吸附、表面反应和脱附等过程。 上述各步骤的阻力不同,反应过程的总速度将取决于阻力最大的步骤,亦称速度最慢的步骤,该步骤就是速度控制步骤。
当总反应速度受化学过程控制时,称为化学动力学控制;反之,当总反应速度受扩散过程控制时,称为扩散控制。
在气化过程中,当温度很低时,气体反应剂与碳之间的化学反应速度很低,气体反应剂的消耗量很小,则碳表面上气体反应剂的浓度就增加,接近于周围介质中气体的浓度。 在此情况下,单位时间内起反应的碳量是由气体反应剂与碳的化学反应速度来决定的,而与扩散速度无关,即总过程速度取决于化学反应速度。 此时,传质系数β远大于化学反应速度常数K,即β≪K,则:

该区间称为化学动力学控制区。
随着温度的升高,在碳粒表面的化学反应速度增加。 温度越高,化学反应速度越快。 直至当气体反应剂扩散到碳粒表面就迅速被消耗,从而使碳粒表面气体反应剂的浓度逐渐下降而趋于零,此时扩散过程对总反应速度起了决定作用。 其化学反应速度常数远大于传质系数,即K≪β,则:

该区间称为扩散控制区。 在扩散控制区,碳表面上反应剂的浓度趋近于零,但不等于零。 因为当反应剂浓度等于零时,化学反应将停止。
气化反应的动力学控制区与扩散控制区是反应过程的两个极端情况,实际气化过程有可能是在中间过渡区或者邻近极端区进行。 如果操作条件介于扩散控制区和化学动力学控制区之间,即所谓两方面因素同时具有明显控制作用的过渡区间(或称中间区间),此时物理和化学作用同样重要,则应考虑两种阻力对总速度的影响。
3.气化生产过程的强化措施
对于外扩散控制的过程,气化过程进行的总速度取决于气体向表面的质量传递速度。增加气体的线速度和减小煤炭颗粒粒度,也即增加单位体积内的反应表面积,可达到强化过程的目的。
对内扩散控制的过程,颗粒外表面和部分内表面参加反应,这时减小颗粒尺寸和提高反应温度是强化反应过程的关键。
对于动力学控制的过程,反应物向颗粒表面的扩散阻力较小,反应总速率取决于气体在煤炭的内、外表面化学反应的速度。 在这种情况下提高温度可以显著强化反应过程。
不论在哪一种控制条件下,减小固体颗粒粒度,即采用小颗粒煤炭,均可提高反应速度,且能较快地达到高的转化率,因此是有效的强化措施。
关于采用加压气化方法,对处于过渡型或扩散控制的工况,随着压力的增加,虽然分子扩散阻力增加,是不利的,但较高的压力却有利于提高反应物的浓度,而且不论在何种工况中,反应速率总是随着反应物浓度增加而增加的。
温度是强化生产的重要因素。 一般情况下,提高温度能急剧增加表观速度,从而提高反应物的转化率。 仅在外扩散控制的情况下,温度对反应表观速率的影响较小。
五、煤气化技术主要评价指标
煤气化技术的主要评价指标有冷煤气效率、气化效率、碳转化率和有效气体产率等。
1.冷煤气效率
用于衡量原料中的化学能转化成产品化学能的效率,其定义为:
冷煤气效率=
2.气化效率
用于衡量原料中化学能转化为可回收的能量的效率,其定义为:气化效率
3.碳转化率
用于衡量原料中的化学能转化成产品化学能的效率,其定义为:
碳转化率=1-
4.有效气体体积(重量)产率
用于衡量单位原料可以产生有效气体量,其定义为:
有效气体产率=
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














