蒜氨酸的分离纯化及其部分生理活性研究
刘同军1 董永胜1 李田2
(1.山东轻工业学院食品与生物工程学院 济南 250100;
2.山东省高新技术投资有限公司济南250013)
摘要:采用改进的方法获得了高纯度的蒜氨酸,并对蒜氨酸的部分生物学活性进行了测定,抑菌实验表明,高纯蒜氨酸对大肠杆菌(Eschrichia coli) ,枯草芽孢杆菌(Bacillus subtilis) ,金黄色葡萄球菌(Staphylococcus aureus) ,痢疾杆菌(Shigella dysenteriae) ,幽门螺旋杆菌(Helicobacter pylori)等测试菌株有极强的杀死作用,其MIC分别为4.06×10-3 mg/ml,4.06×10-3mg/ml,4.06×10-3mg/ml,8.13×10-3mg/ml,1.63×10-2mg/ml。同时,体外细胞实验结果显示,蒜氨酸对肿瘤细胞人急性早幼粒白血病细胞(HL-60)和人肝癌细胞(H-7402)有很高的抑制和杀死作用。说明蒜氨酸在食品防腐、抗肿瘤药物开发和保健品的研制上有很好的应用潜力和应用前景。
关键词:蒜氨酸;提取;生理活性
百合科葱属植物大蒜(Allium sativum)数千年来在中国和埃及等国一直是一种食药两用的食品。自20世纪70年代以来国际上越来越重视对大蒜药用价值的研究和应用,现已备受国际医学界和消费者的青睐。现代医学研究证明大蒜和天然大蒜制剂有非常好的防病治病功效[1,2],几乎无任何毒副作用。其功效有抑菌、杀菌、杀病毒、降血脂、降胆固醇、预防动脉硬化和脑梗塞、保护肝脏,防治肝炎、抑制肿瘤、清除自由基,提高免疫力和抗衰老等等。国内对大蒜和大蒜制剂的研究、应用也越来越广泛。
虽然对大蒜药理活性的研究已经进行了几十年,但对其功效成分的研究迄今大多集中在大蒜辣素(allicin) 、大蒜新素、蒜油等几个早已合成或分离的化合物上,并取得了大量的研究成果[3~6],但这对于阐明大蒜诸多的药理活性机制是不够的。近年来,大蒜中的极性单体—蒜氨酸引起了学者的广泛重视。研究证明以蒜氨酸为代表的含硫氨基酸具有独特的药理活性。蒜氨酸是大蒜中独特的含硫氨基酸,存在于大蒜鳞芽中,其纯品是无臭、无刺激性的针状晶体,溶于水但不溶于乙醇。用于食品保鲜可延长食品防腐保鲜期,且无毒性反应。
对蒜氨酸的研究和对大蒜的深加工具有重要的理论意义和较高的经济价值。蒜氨酸的活性在80年代才受到少数国外学者的关注,目前对大蒜及其他百合科植物中的含硫氨基酸的研究仍然集中在国外,还不够系统和丰富,它们的潜在价值仍有待发现。但一个已经证实的结论是含硫氨基酸的确是大蒜的活性成分之一,它们的研究成果对有效开发大蒜药用成分具有深远的意义。
以往对于蒜氨酸的研究,其提取工艺只能在实验室里进行,很难应用于大规模生产。本文利用改进的方法(该法易于应用到工业化生产上)提取纯化了蒜氨酸并对其进行了分析,然后研究了其部分生理活性。
1 材料与方法
1.1 材料
1.1.1 分离分析用材料
大蒜购自济南市七里堡蔬菜批发市场;气相色谱6890N GC (Agilent) ; 7501型紫外分光光度计(上海分析仪器厂) ;蒜氨酸标准品(Sigma公司) 。
1.1.2 抑菌试验供试菌种
大肠杆菌(Eschrichia coli) ,枯草芽孢杆菌(Bacillus subtilis) ,金黄色葡萄球菌(Staphylococcus aureus) ,痢疾杆菌(Shigella dysenteriae) ,幽门螺旋杆菌(Helicobacter pylori)由山东轻工业学院菌种保藏中心提供。
1.1.3 肿瘤细胞株
人急性早幼粒白血病细胞(HL-60) 、人肝癌细胞(H-7402)由山东省医学科学院提供。
1.2 实验方法
1.2.1 蒜氨酸分离提取
采用两步法,第一步为醋酸提取(详细方法另文发表) ,第二步为乙醇提取,提取液加95%乙醇,取上清液,薄膜浓缩,硅胶拌样后上硅胶柱,用75%乙醇洗脱,洗脱液浓缩后放置析出白色结晶,75%乙醇重结晶即得蒜氨酸。
1.2.2 抑菌试验
琼脂平板打孔法测定MIC[7]
1.2.3 体外抗肿瘤活性试验(MTT法[8,9])
参照卫生部药政局编《新药(西药)临床前研究指导原则汇编》要求,MTT用0.02 mol/LPBS (pH 7.4) -0.02mol/LNaCl配制成5 mg/ml,0.45μm膜过滤除菌后-20℃冻存,4℃避光保存备用(两周内使用) ;将蒜氨酸溶液用滤器加0.45μm膜过滤除菌;人急性早幼粒白血病细胞系(HL-60)细胞和肝癌细胞(H-7402)采用常规培养。培养液为含10%的小牛血清,青霉素、链霉素各1×105U.L-1的RPMI 1640,在饱和湿度,37℃,5%CO2孵箱中培养,每2~3d传代培养一次;将HL-60细胞悬液调整为1×105/ml,将H-7402细胞悬液调整为0.8×105/ml,接种于96孔培养板,每孔0.1ml,实验组分别加入7种不同浓度的蒜氨酸(10,20,30,40,50,60,70 g/L) ,对照组不加蒜氨酸,另设空白组(只有培养基,无细胞) ,每组8个复孔,饱和湿度条件下,37℃,5%CO2培养箱中培养,于68h细胞贴壁生长后在各孔中加入20μl MTT,继续培养4h,中止培养前每孔加入二甲亚砜(DMSO) 100ul,37℃过夜,轻微振荡20~30min (时间过长OD值会下降)使甲亻贝夫夫结晶充分溶解,用微板光谱仪测定各孔在570nm处的吸光度值,按下式计算细胞抑制率。
![]()
根据各浓度抑制率,采用Logit法计算半数抑制浓度IC50。
2 结果与讨论
2.1 提取样品的紫外吸收
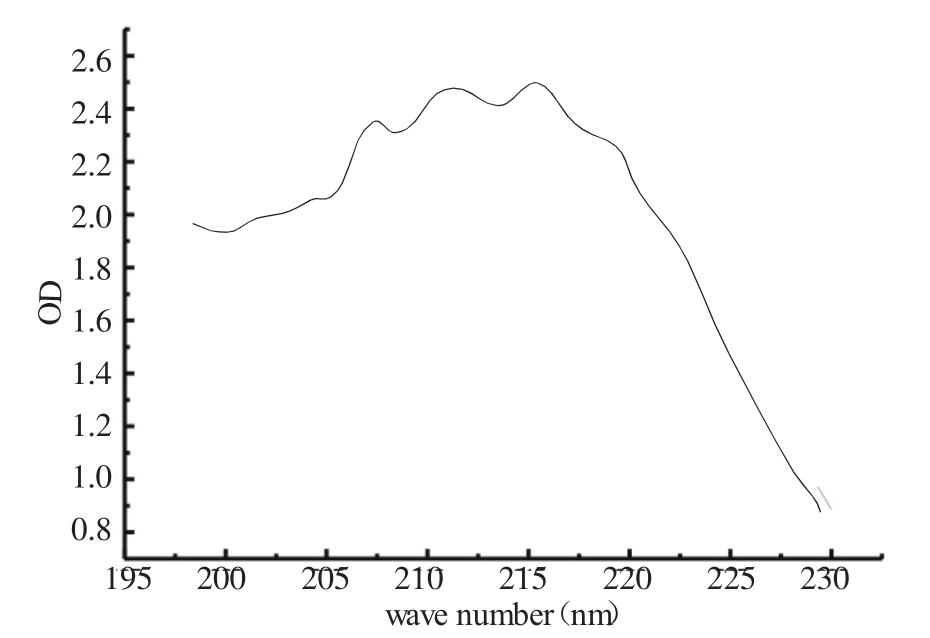
图1 蒜氨酸样品的紫外吸收光谱
从图1可以看出样品溶液在218nm处有最大紫外吸收,该吸收是羧基的特征吸收。所得图谱与Sigma公司标准品基本一致。
2.2 蒜氨酸提取液样品与标准品的氢焰色谱对照
标准品在保留时间4.129min时出现最大峰,即蒜氨酸的色谱峰;样品在保留时间4.034min时出现最大峰(图2) ,二者的保留时间非常相近,而且峰形也基本一致,因此可推断出粗提样品的色谱曲线中出现的最大的峰为其中所含的蒜氨酸的峰形。结合紫外吸收实验结果可确定提取得到的化合物即为蒜氨酸。经计算,样品中的蒜氨酸含量为90.48%,浓度为0.52 mg/ml。
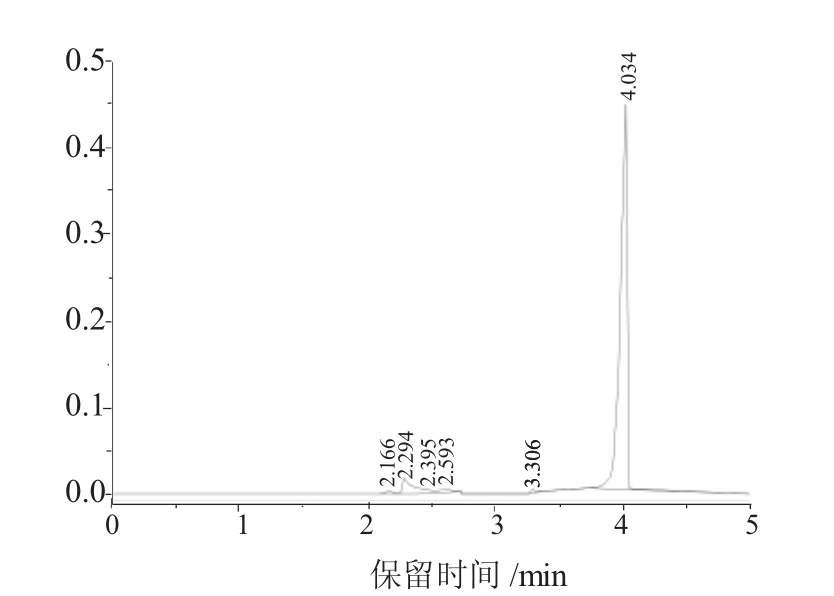
图2 蒜氨酸样品的GC图谱
2.3 蒜氨酸抑菌活性的测定
大蒜提取物对多种微生物有杀死作用,以往的研究主要集中在提取混合物上或者是蒜辣素和蒜油等成分上,而对于蒜氨酸这种单一成分的研究还未见报道。图3和图4显示用改进方法提取得到的蒜氨酸溶液对所测试的多种致病菌有较强的抑制和杀死作用,抑菌圈非常明显。对各种测试菌的最小抑制浓度见表1。
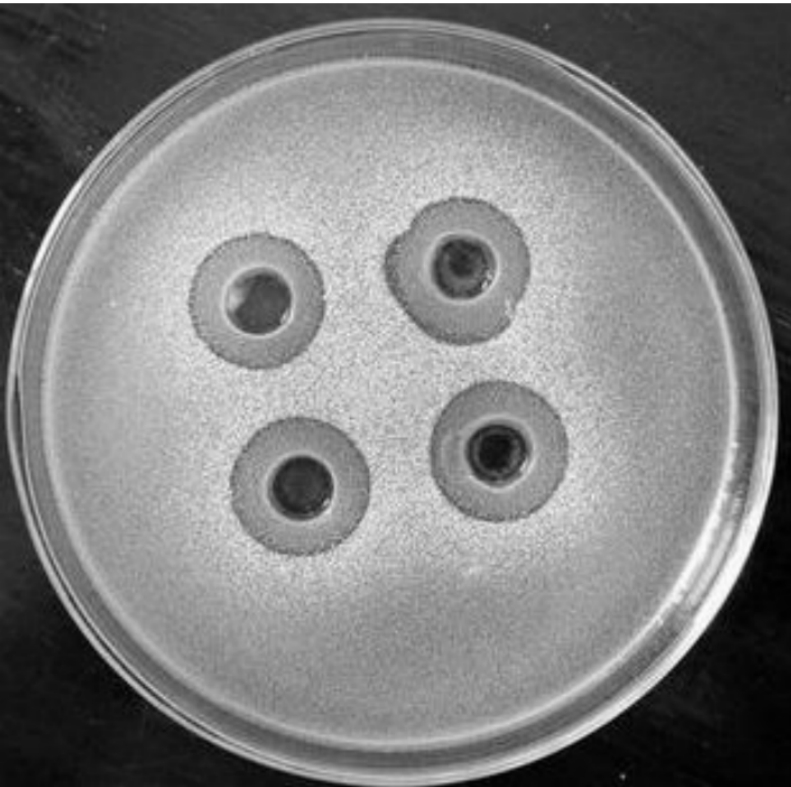
图3 蒜氨酸2倍稀释液作用于Shigella dysenteriae的抑菌圈

图4 蒜氨酸原液作用于Bacillus subtilis的抑菌圈
表1 蒜氨酸对供试菌的最小抑制浓度(MIC)

2.4 蒜氨酸体外抗肿瘤活性研究
体外实验表明,蒜氨酸对HL-60细胞和H-7402细胞的生长抑制作用基本呈S形曲线,在低浓度和高浓度有比较典型的平台区,在一定浓度范围内呈线性关系(图5) 。对于两种细胞增殖的抑制作用,其IC50分别为23.675ug/ml (HL-60)和26.327ug/ml (H-7402) 。

图5 蒜氨酸对细胞株H-7402和HL-60生长的影响
实验中,我们观察到细胞系HL-60和H-7402对蒜氨酸很敏感,抑制率优于已知药物。蒜氨酸对HL-60和H-7402的抑制作用机理在本实验中没有一个完美的解释,因为有多种可能会导致这样的结果,如通过细胞毒的作用直接杀死癌细胞,诱导肿瘤细胞凋亡等,这需要进一步的研究才能得出确切的结论。
3 结论
通过对改进方法提纯的蒜氨酸的研究表明,这种单一成分具有极高的杀菌和抗肿瘤作用,显示出较高的药用价值,当然作为药物的开发还有很多的工作要做,本实验为下一步工作打下了良好的基础。蒜氨酸不仅可以作为药物来开发还可以当作保健品来提高人体免疫力,这种纯天然的物质正符合了人们对安全无毒食品药品的需求。大蒜不仅可以用来提取蒜氨酸还可以用来加工成一系列的产品,我国大蒜资源丰富,蒜氨酸的提取制备工艺简单,成本低,因此蒜氨酸的研究和大蒜的综合利用具有极高的学术意义和经济价值。
参考文献:
[1]刘直.大蒜的研究进展[J].上海中医药杂志,1989,10(5):45~48
[2]顾银娜,黄蕴慧,李新岗.大蒜有效成分的提取及药理作用[J].南京军医学院学报,2000,22 (4):249~250
[3]王岩,李新霞,陈坚.薄层扫描法测定大蒜中蒜氨酸的含量[J].中国药学杂志,2003,38 (3):217~218
[4]黄蕾蕾,薛承斌.大蒜提取物的药理作用与临床应用[J].医药导报,2003,22 (S1):70~71
[5] Land shuterJ,Lohmoller E.,Knobloch K.Purification and Characterization of C-S-lyase from Remson,the Wild Garlic Alliumursinum. [J].Planta Med.,1994,60 (2):343~347
[6] Lancaster,J.e.,Kelly.K.E.Quantitative Analysis of the Salk (en)yl-L-cysteine Sulfoxide sinonion(allium cepa L.)[J].J Sci Food Agric,1983,34(5):129~1235
[7]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002
[8]Hanse MB,Nielsen SE,BergK,Reexamination and further development ofa precise and rapid dye method for measuringcell growth/cell kill [J].J Immunol Methods,1989,119(3):203~208
[9] Francois D.Rita L.,Rapid colorimetric assay for cell growth and survival modifications to the tetrazodium dye procedure givingimproved sensitivityand reliability[J].J Immunol Methods,1986,89(2):271~278
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














