实验117 酪氨酸酶的提取及其催化活性研究
实验目的
认识生物体中酶的存在和催化作用,使学生了解生物体系中在酶存在下的合成或分解与普通的有机合成的相同和不同之处,认识一些生物化学过程的特殊性;掌握生物活性物质的提取和保存方法,学会使用仪器分析手段研究催化反应特别是生物化学体系中催化过程的基本思想和方法。
实验原理
在实验室里,复杂的有机物合成与分解往往要求在高温、强酸、强碱、减压等剧烈条件下才能进行。而在生物体内,虽然条件温和(常温、常压和接近中性的溶液等),许多复杂的化学反应却进行得十分顺利和迅速,而且基本没有副产物,其根本原因就是由于生物催化剂酶的存在。
酶是具有催化作用的蛋白质。按照酶的组成,可将其分为两类:①简单蛋白质,其活性仅取决于它的蛋白质结构,如脲酶、淀粉酶等;②结合蛋白质,这种酶需要加入非蛋白质组分(称之为辅助因子)后,才能表现出酶的活性。酶蛋白质与辅助因子结合形成的复合物称为全酶。例如,酪氨酸酶就是以Cu+或Cu2+为辅助因子的全酶。辅助因子虽然本身无催化作用,但参与氧化还原或起运载酰基载体的作用。若将全酶中的辅助因子除去,则酶的活性就失去了。
通常把被酶作用的物质称为该酶的底物。一种酶只催化特定的一个或一类底物的反应,酶催化具有很高的选择性和灵敏度,因而引起了广大分析工作者的兴趣。目前,酶已作为一种分析试剂得到应用,特别是在生化、医学方面应用非常广泛。例如,一些生命物质和液体中的特殊有机成分,用其他方法测定有困难,用酶法分析却有其独到之处。
本实验拟通过从土豆中提取酪氨酸酶并测定其活性,使学生对酶有初步的了解。当土豆、苹果、香蕉、蘑菇受损伤时会显棕色,这是由于土豆、苹果等含有酪氨酸和酪氨酸酶。酶存在于物质内部,当内部物质暴露出来后,在空气中的氧参与下,发生了如下的一系列反应,生成黑色素。
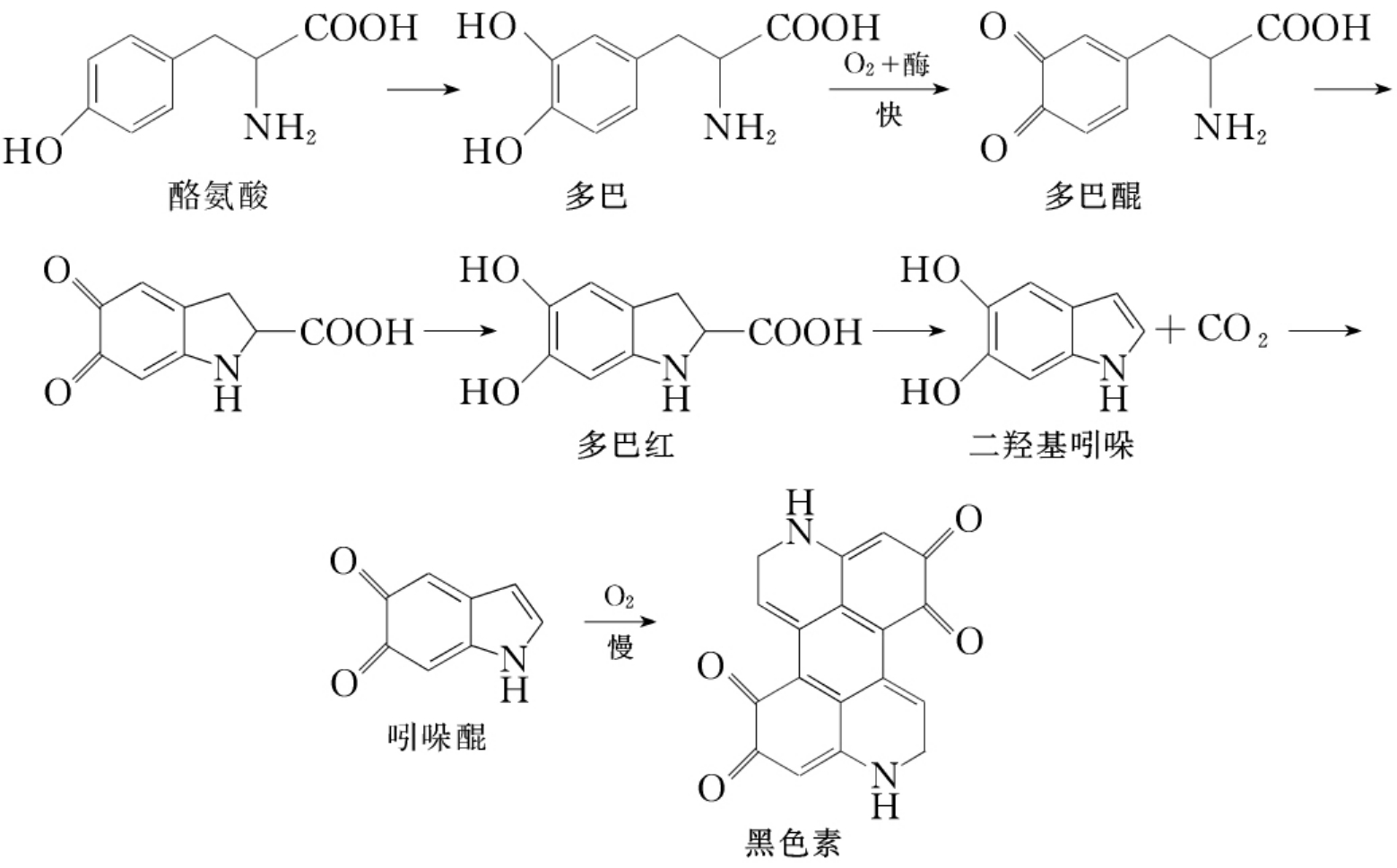
![]()
酪氨酸酶可用比色法测定。由于多巴转变成多巴红的速率很快,而转变到下一步产物速率慢得多,故可在酶存在下,测定多巴转变为多巴红的速率,从而测定酶的活性。可用吸光度对时间作图,从所得的直线斜率求酶的活性。
酶的活性计算:一般定义在优化条件下(pH值、离子强度等),25℃时在1min内转化1μmol底物所需要的量为酶的活性单位。通过下式可计算出所用的酶的活性:式中:a为所用溶液的酶的活性;ΔA为最大吸收处吸光度的变化;t为时间;ε为多巴红的摩尔吸光系数;V为加入的酶的体积。
进而计算出所用原料中的酶的活性:
![]()
式中:U为原料中酶的活性;V0为原料所得的酶溶液的总体积;m为原料总质量。
实验用品
仪器 分光光度计;离心机;水浴;秒表;比色管等。
试剂 多巴(二羟基苯丙氨酸);Na2HPO4(0.20mol·L-1);HCl(0.1mol· L-1);Sephedex柱;土豆(或苹果)等。
实验步骤
1.溶液配制
0.10mol·L-1磷酸缓冲液(pH=7.2):50mL 0.20mol·L-1 Na2HPO4+8mL 0.1mol·L-1 HCl,稀释到200mL。
0.10mol·L-1磷酸缓冲液(pH=6.0):50mL 0.20mol·L-1 Na2HPO4+22 mL 0.1mol·L-1 HCl,稀释到200mL。
0.010mol·L-1多巴溶液:称取0.195g多巴,用pH=6.0的磷酸缓冲液溶解并稀释到100mL。
2.酶的提取
在研钵中放入10g切碎了的土豆,加入7.5mL pH=7.2的磷酸缓冲液,用力挤压。用两层纱布滤出提取液,立即离心分离(约3000r·min-1,5min)。倾出上层清液,保存于冰浴或冰箱中。提取液为棕色,在放置过程中不断变黑。有条件的话,可以经Sephedex柱进一步纯化。
3.多巴红溶液吸收光谱的测定
取0.4mL已稀释过的土豆提取液,加2.6mL pH=6.0的磷酸缓冲液。加2 mL多巴溶液,摇匀。反应约10min后,使用1cm比色皿于扫描分光光度计上进行重复扫描,即可获得多巴红的吸收光谱。若使用自动扫描分光光度计,可从混合开始以时间间隔为1min进行连续扫描,可以观察到吸光度随时间变化的现象。
4.酶的活性测量
取2.5mL上述提取液,用pH=7.2的磷酸缓冲液稀释至10mL比色管中,摇匀。取0.1mL稀释过的提取液于10mL比色管中,加入2.9mL pH=6.0的磷酸缓冲溶液,再加入2mL多巴溶液,同时开始计时,用分光光度计在480nm处测定吸光度。开始6min内每分钟读1个数,以后隔2min读1个数,直至吸光度变化不大为止。
取0.2mL、0.3mL、0.4mL已稀释过的提取液重复上述实验。注意总体积为5 mL,每次换溶液洗比色皿只能倒很少量溶液洗1次。
以吸光度对时间作图,从直线斜率求出酶的活性。
实验结果与数据处理
(1)绘制不同酶加入量的动力学曲线。以吸光度值为纵坐标,时间为横坐标,可得出在加入酶的作用下,多巴的转换动力学过程,再由直线部分得出转换速率,即为酶的活性。
依次得出不同提取液的活性,比较不同体积的提取液加入后相同量的多巴的转换速率。
(2)酶的活性计算。将不同体积提取液的实验结果填入表6-21,计算出原料中酶的活性。
表6-21 酶活性的测定

(3)影响酶的活性的因素研究。
取0.40mL稀释过的提取液,在沸水浴中加热5min,冷却后配成测定溶液,观察现象。
取0.40mL稀释过的提取液,加少量固体Na2S2O3配成测定溶液,观察现象。
取0.40mL稀释过的提取液,加少量固体Na2EDTA振荡混合,反应一段时间后,配成测定溶液,观察现象。
思考题
(1)酶的活性受何种条件影响?
(2)提取物在放置过程中为何会变黑?
(3)经热处理后酶的活性为何显著降低?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














