胞苷产生菌诱变育种的研究
黄艳辉1 魏志强1 程远超1 徐庆阳1 陈宁1,2
(1.天津科技大学生物工程学院;2.天津市工业微生物重点实验室 天津 300222)
摘要:以枯草芽孢杆菌(Bacillus subtilis) NO122为诱变出发菌株,经紫外线(UV)和硫酸二乙酯(DES)逐级诱变处理和选育,选育出尿嘧啶缺陷(U-)回复株、胞苷脱氨酶缺失突变株(CRDAE-)菌株,然后经3-脱杂氮尿嘧啶(3-DU) 、5-氟胞苷(5-FCR)结构类似物平板定向筛选,获得胞苷产生菌株TZM1012。在以葡萄糖为碳源、以硫酸铵为氮源的培养基中36℃下直接发酵3d,产胞苷可达0.873g/L,并具有较好的遗传稳定性。
关键词:胞苷枯草芽孢杆菌发酵育种
胞苷(Cytidine)又名:胞嘧啶核苷、胞啶、1-β-D-呋喃核苷胞嘧啶。胞苷主要用于生产抗肿瘤、抗病毒药物的中间体,随着抗病毒、抗肿瘤、治疗艾滋病药物的深入研究,天然的嘧啶核苷需求量加大,期望需求廉价的,能大规模生产胞苷的工艺方法。国外在20世纪90年代中期才有关于胞苷可以经发酵法大规模生产的报道,而我国对发酵法生产胞苷的研究尚属空白。随着嘧啶核苷需求量的加大,发酵法生产胞苷的研究也日益得到更广泛的重视[1,2]。
1 材料与方法
1.1 菌株
枯草芽孢杆菌(Bacillus subtilis) NO122,天津科技大学代谢控制发酵研究室保存菌株。
1.2 培养基(g/L)
基本培养基[3]:葡萄糖5,柠檬酸钠1,(NH4)2SO42,MgSO4· 7H2O 0.2,K2HPO414,KH2PO46,琼脂粉20,pH7.0,灭菌条件: 0.1 MPa 15min。
完全培养基[3]:葡萄糖5,牛肉膏3,蛋白胨10,MgSO4· 7H2O 2,pH7.0,灭菌条件:0.1MPa 20min。
抗性培养基:在基本培养基中加入0.6mg/ml3-脱杂氮尿嘧啶和50μg/ml5-氟胞苷种子培养基:葡萄糖40,蛋白胨20,酵母膏5,MgSO4· 7H20 0.5,K2HPO40.5,KH2PO41.5,pH7.0~7.2,0.1MPa灭菌15min。
发酵培养基[4]:玉米浆40,玉米蛋白粉5,尿素20,碳酸钙5,葡萄糖160pH7.0~7.2,0.1MPa灭菌15min。
1.3 培养条件
种子培养条件:接种后的种子发酵液置于旋转式摇床,转速160r/min,34℃培养10h。摇瓶发酵培养条件:接种后的摇瓶置于旋转式摇床,转速220r/min,36℃培养96h。
1.4 诱变方法及突变株的筛选方法
紫外线(UV)诱变方法:一级种子培养17~18h后,再以10%的接种量转接到二级种子培养基中,培养8h使细胞达到同步培养。将培养液无菌离心,收集菌体,用生理盐水洗涤2~3次,转入到带玻璃珠的三角瓶中打散,得菌悬液,使细胞浓度控制在108个/ml左右。在15W紫外灯下30cm处照射一定时间后转接入种子培养基中避光培养约12h。取出后培养液按梯度稀释并涂布筛选平板,34℃恒温培养。
硫酸二乙酯(DES)诱变方法:一级种子培养17~18h后,再以10%的接种量转接到二级种子培养基中,培养8h使细胞达到同步培养。取培养液10ml无菌离心,菌体用pH7.0的磷酸缓冲液洗涤2~3次,转入带玻璃珠的三角烧瓶中打散,得菌悬液,使细胞浓度控制在108个/ml左右。取菌悬液,加入硫酸二乙酯,使其终浓度为1% (V/V) 。 34℃下振荡反应一定时间,诱变结束后加入同体积25%Na2S2O3终止反应,用无菌生理盐水洗涤2~3次后,接入到种子培养基中后培养8~10h。离心洗涤按梯度稀释并涂布筛选平板,34℃恒温培养。
3-DUr、5-FCr突变株的筛选:配制基本培养基,灭菌后加入适量的药物,制成不同浓度梯度的筛选平板。涂布上述经诱变处理过的菌液,置34℃恒温箱中培养5~7d,挑取长出的菌落,即为所需突变株。
1.5 分析方法
菌体生长测定:取0.2ml待测液,加入9.8ml0.25mol/L盐酸以溶解溶液中的碳酸钙,摇匀,以空白培养液为参比,用752型分光光度计在波长620nm下测菌体光密度值。
pH值测定:pH计进行测定。
还原糖:采用SBA-40C多功能生物传感分析仪测定。胞苷测定:采用高效液相(HPLC)测定[4]。
2 结果与讨论
2.1 胞苷酸产生菌TZM1012的诱变谱系
以枯草芽孢杆菌(Bacillus subtilis) NO122为诱变出发菌株,采用紫外线、DES诱变处理,根据代谢控制发酵原理,依次赋予其U-、CRDAE-、3-DUr、5-FCRr遗传标记,最后获得一株胞苷产生菌TZM1012,其诱变谱系见图1。

图1 胞苷生产菌诱变育种图谱
2.2 紫外线诱变及结果
2.2.1 紫外线照射时间与致死率的关系:为了选择合适的诱变处理时间,对紫外线照射时间与致死率的关系作了试验,测定结果见表1。
表1 紫外诱变致死率的测定结果

由表1可知,致死率与诱变剂量成正相关。采用致死率为99.1%的照射时间4min的诱变剂量对出发菌株进行诱变。
2.2.2 突变株TD300与出发菌株NO122的3-DU抗性的比较:分别将TD300菌株和NO122菌株的菌悬液涂布在含不同浓度3-DU的基本培养基上,34℃培养5~7d,观察菌株的生长情况,结果如表2所示。这一特征反映出经过诱变后突变株获得了新的遗传性状,胞苷生物合成的代谢调控机制得以不同程度的变化,从而使突变株积累胞苷的能力不断提高。
表2 TD300菌株和NO122菌株对3-DU抗性的比较
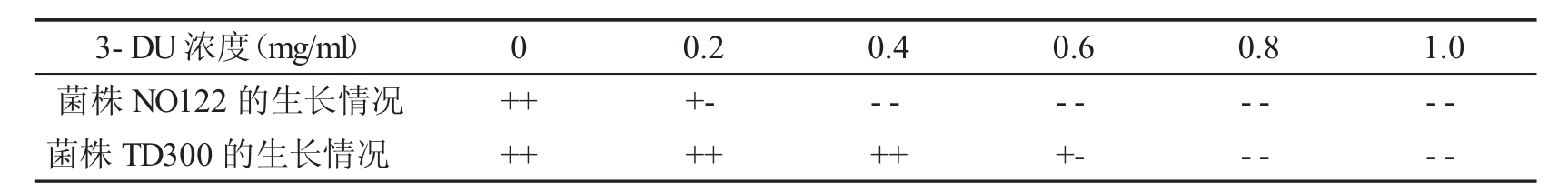
+ +表示生长良好,+ -表示微弱生长,--表示没有生长,以下同。
2.3 DES诱变及结果
2.3.1 DES诱变致死率结果:在进行DES诱变时,首先考察了不同诱变剂量的致死率。诱变剂量与致死率的关系如表3所示。
表3 DES处理TD300致死率的结果
![]()
2.3.2 菌株TD300和TZM1012对5-FCR耐受程度的比较:胞苷的生物合成受其自身的
反馈抑制和反馈阻遏[5],选育结构类似物抗性突变株以解除胞苷自身的反馈调节使胞苷得以积累。5-FCR的结构与胞苷结构基本一致,因此5-FCR可以作为胞苷的结构类似物,选育已经解除代谢途径中胞苷的反馈调节的突变株。在不同5-FCR浓度平板上涂布适当稀释的菌株TD300和TZM1012的菌悬液,34℃培养5~7d,观察菌株对5-FCR的抗性,结果如表4所示。
表4 菌株TD300和TZM1012对5-FCR抗性比较

2.3.3 DES不同处理时间突变情况的比较:上述五种不同处理时间诱变后的5-FCR抗性平板中各随机挑取100株进行实验。以胞苷产量为检测指标,产量提高10%以上计为正突变株,减低10%以上计为负突变株,产量改变在10%以内的计为稳定株,比较不同诱变剂量下正突变率和负突变率的情况,结果见图2所示。
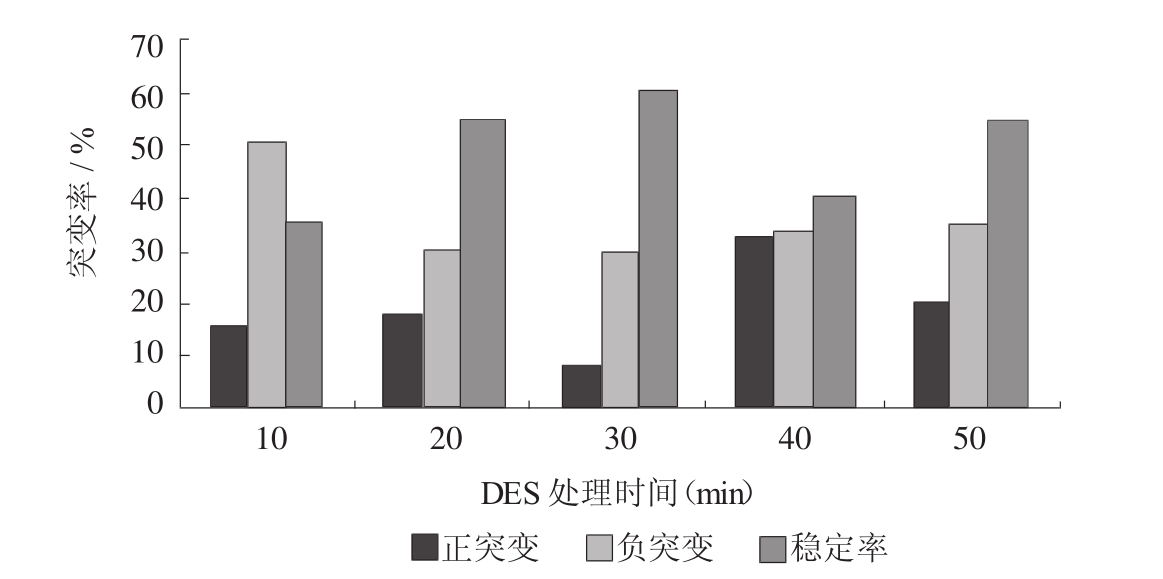
图2 DES不同处理时间突变情况的比较
用DES对菌株进行诱变,不定向的改变了所获得菌株的遗传特性,导致菌体代谢控制机制的变化,这种变化反映在胞苷积累能力上则有正变和负变。从实验结果可知,正突变率与诱变剂量之间并没有特别的关系。
2.4 菌株TZM1012的遗传稳定性
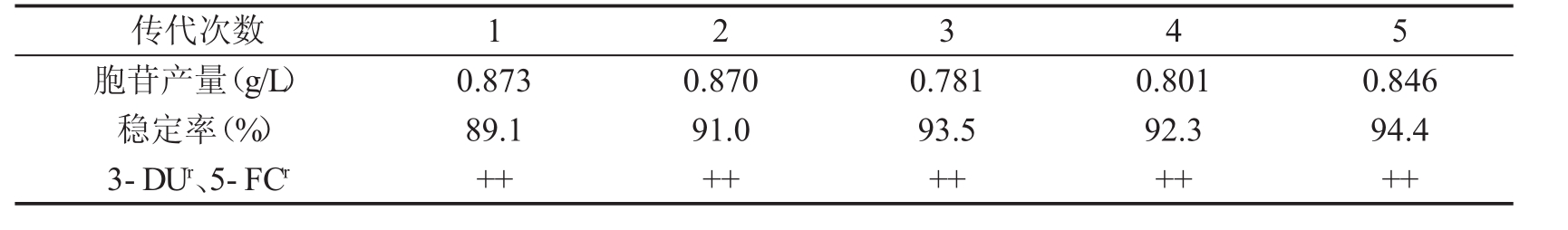
将菌株TZM1012平皿上划线分纯,进行传代稳定性试验,连续传种五代,涂平皿分离单菌落。每一代中与亲株相比产量改变在10%以内的计为稳定株,测定胞苷产量及稳定率,以及对3-DU (0.6 mg/ml) 、5-FCR (50μg/ml)的抗性,结果见表5。该突变株的遗传稳定性较好,连续传种5次,其产量未见明显变化,抗性标记遗传较好。
表5 菌株TZM1012的遗传稳定性
3 结论
以枯草芽孢杆菌(Bacillus subtilis) NO122为诱变出发菌株,经紫外线(UV)和硫酸二乙酯(DES)逐级诱变处理和选育,选育出一株胞苷产生菌株TZM1012,并具有较好的遗传稳定性。
在合适的条件下,对菌种进一步进行处理,使其能耐受更大的抗性,并进一步探究发酵条件,使其工业化生产成为可能,这也是作者正在研究的课题。
参考文献:
[1]乔宾福.微生物产生核苷和核酸.工业微生物[J],1998; 28 (1):2
[2]张克旭,杜连祥译.核酸发酵[M].北京:中国轻工业出版社,1987
[3]杜连祥主编.工业微生物学实验技术[M].天津:天津科学技术出版社,1992
[4]Satoru Asahi,Yutaka Tsunemi,Cytidine production by mutants of Bacillus subtilis[J] Biosci.Biotech.Biochem,1994,58 (8):1399~1402
[5]怀丽华,陈宁.嘧啶核苷高产菌的代谢控制育种策略.食品与发酵工业,2005,31 (10):107~110
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















