(一)dup(1)(q12-21q31-32)
形成的机制不明,可能由于不平衡易位[如der(1)t(1;1)(p36;q21)]所导致。大多数情况下为继发改变,约1/3的病例继发于t(8;14) (q22;q32),在约25%的Burkitt淋巴瘤患者中出现;另外1/3的病例常见于高超二倍体,通常为唯一结构异常。Array-CGH研究发现近端的断裂点集中在1q21-21.1大约1.4 Mb的区域,而远端的断裂点差异很大,在ALL患者中最小增加区域为57.4 Mb[dup(1)(q22q32.3)]。全基因表达谱分析发现,在伴有dup(1q)的高超二倍体ALL患者中,B4GALT3、DAP3、RGS16、TMEM183A和UCK2这5个位于最小增加区域内的基因表达明显高于没有dup(1q)的患者[36]。dup(1q)通常不影响患者预后,特别是出现在高超二倍体亚群中也不会改变该群患者的良好预后[3]。
(二)del(6q)
见于5%~13%的ALL患者,B系及T系均可累及,同时也常见于其他淋系肿瘤如慢性淋巴增殖性疾病和非霍奇金淋巴瘤,常伴有其他染色体异常。del (6q)断裂点差异大,最常见的断裂区域为6q15-q21。目前没有明确证据显示del(6q)对ALL患者的预后有影响。
(三)i(7)(q10)
该等臂异常在ALL中相对常见,为继发性改变,常合并t(1;19)、t(4;11)或高超二倍体等异常。
(四)del(9p)
光镜下可识别的9p异常无论在儿童还是在成年ALL患者中均有相当多的报道,主要表现为9p21缺失。在这一区段包含两个前后相联的基因,分别为CDKN2A(既往命名为p16)和CDKN2B(既往命名为p15),这两个基因编码细胞周期依赖激酶抑制物,其中CDKN2A是ALL患者9p21缺失的主要靶点。除了缺失造成基因失活外,突变或高甲基化同样也可造成CDKN2A基因失活,但后两者的发生率远低于缺失。相当一部分9p缺失因片段小,常规核型分析难以发现,需使用分子遗传学手段方能检出。在分子水平,9p缺失的片段大小变异也很大,可从单个外显子到大的基因组区段,可以为单等位基因缺失也可为双等位基因缺失。
无论在B-ALL或T-ALL,del(9p)均可继发于其他常见的原发性核型异常。在儿童ALL患者中,9p异常的发生率约为10%,而CDKN2A基因失活率更高,在B-ALL约为20%,而在T-ALL中可高达50%[37]。CDKN2A基因失活的发生率与细胞遗传学亚群密切相关,在高超二倍体或ETV6-RUNX1融合基因(+)等良好预后组中的发生率明显较低。9p异常的预后意义仍不明确,最近研究发现无论在儿童还是成年B-ALL患者中,CDKN2A缺失均与预后无关[38,39]。
(五)del(13)(q12-14)
在各个年龄段的B-ALL患者中,del(13q)的发生率约为2%,多表现为臂内缺失,近端的断裂点区域为13q12-14区段,远端的断裂点区域为13q21至长臂末端。del(13q)是常见的继发性异常,在儿童ALL患者中往往提示不良预后,除非出现在高超二倍体或ETV6-RUNX1融合基因(+)等良好预后核型[1]。
(六)i(17)(q10)
为ALL患者中最常见的等臂染色体异常之一,相对多见于高超二倍体,有时是唯一的结构异常,也可继发于其他染色体易位(如t(4;11)(q21;q23)和t(8;14)(q11;q32))。尽管i(17q)不会影响高超二倍体或ETV6-RUNX1融合基因(+)组的良好预后,但在儿童B-ALL其他核型亚群中此异常均与不良预后相关[1]。i(17q)异常的分子遗传学机制尚不明确,尽管会导致TP53基因缺失,但由于TP53突变在儿童淋系肿瘤中的发生率很低,因此可能还存在其他的异常靶点。
病历摘要:患儿,女,5岁。血常规:WBC:68.67×109/L,RBC:1.23×1012/L,Hb:40 g/L,PLT:14×109/L。
临床诊断:急性白血病。
流式细胞学:异常细胞,约占有核细胞的81.6%,表达HLA-DR、CD10、CD19、CD22、CD34、TdT,部分细胞表达CD38,不表达cIgM,考虑为急性B 淋巴细胞白血病(普通型B-ALL)。
分子遗传学:融合基因筛查为阴性。
讨论:该患者核型改变为众数51~65的高超二倍体,无高危的染色体结构异常存在,提示细胞遗传学预后良好。
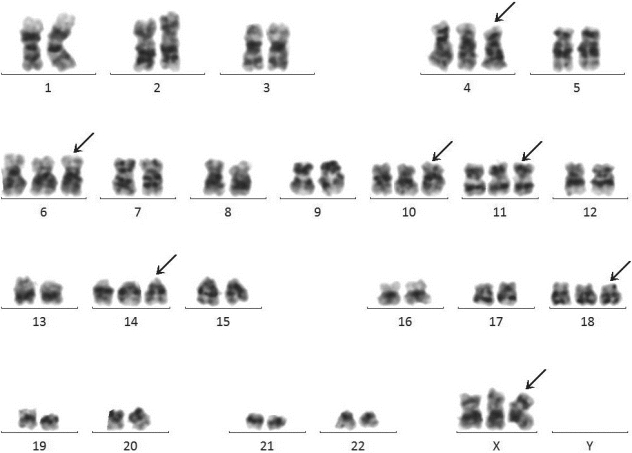
图6-1 急性前体淋巴母细胞白血病患者骨髓细胞G带核型
53,XX,+X,+4,+6,+10,+11,+14,+18
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















