通过应用组织工程肌腱修复缺损肌腱的研究,观察修复后肌腱形态的恢复、功能的重建、力学特性等指标,阐明肌腱细胞与支架材料的关系,细胞的作用,新肌腱的成活、营养、代谢改变,与受体肌腱的愈合方式,与周围组织的关系及生物力学表现等,从而检测组织工程肌腱构建的成功与否(图12-3)。
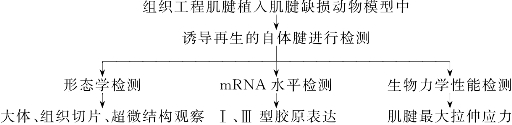
图12-3 组织工程化肌腱检测技术路线流程图
一、所需试剂及仪器
Trizol reagent总RNA提取试剂盒、OneStep RT-PCR试剂盒、ΦX174-HincⅡdigest DNA Marker、琼脂糖凝胶、抗BrdU抗体、兔抗人Ⅰ型胶原、PCR仪、紫外分光光度计、JEM-1200EX透射电子显微镜、LKB-V型超薄切片机、台式低温冷冻离心机、电泳仪、凝胶成像系统。
二、组织工程肌腱的体内植入
参照本章第一节中制备兔肌腱损伤动物模型的方法,将人胚肌腱细胞与HHK人工腱联合立体培养7d形成的组织工程肌腱植入兔跟腱损伤部位,以单纯HHK人工腱植入为对照。
三、体内植入后的形态学检测
(一)大体观察
分别于植入后1、3、6、9、12、16周取材,观察组织工程肌腱与周围组织的关系以及肌腱断端的愈合情况。
结果:HHK人工腱植入体内后1周,肉眼观察可见四组兔跟腱离断处表现相同,HHK人工腱表面无明显变化;植入后3周,人工腱表面被覆一层光滑的白色鞘膜,人工腱可自由滑动,各组间无显著差异;植入后9周,人工腱周围新生的腱细胞鞘增厚,人工腱已不能自由滑动,发束减少;植入后12周,可见人发已被明显降解吸收,近侧端已完全降解吸收,远侧端尚有残留(图12-4,彩图28);植入后16周,腱细胞鞘已完全腱化成腱,人发接近消失,新腱与正常肌腱接头处已完全融合(图12-5,彩图29)。实验组的新生腱较对照组明显为粗。
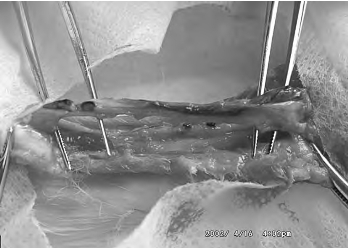
图12-4 植入后12周,组织工程肌腱被部分降解,与再生自体肌腱共存

图12-5 植入后16周,组织工程肌腱几乎完全降解,完全被再生自体腱代替
(二)组织切片观察
1.组织切片HE染色 组织标本取材后,4%多聚甲醛固定,常规石蜡切片,片厚5μm,HE染色,乙醇脱水,二甲苯透明,中性树胶封固。
2.免疫组织化学染色
(1)Ⅰ型胶原的检测
①0.5%H2O2(纯甲醇配制)室温浸泡30min,阻断内源性过氧化物酶。蒸馏水洗2次。
②滴加正常羊血清,室温封闭20min,以消除非特异性染色。甩去多余液体。
③滴加兔抗人CollagenⅠ(1∶100),4℃过夜。PBS洗2次,5min/次。
④滴加相应的生物素化二抗,室温孵育20min。PBS洗2次,5min/次。
⑤滴加SABC,室温20min。PBS洗2次,5min/次。
⑥用DAB试剂盒室温显色,显微镜观察控制显色。
⑦苏木精轻度复染。脱水、透明、中性树胶封片。
(2)BrdU的检测:同上灭活内源性过氧化物酶及正常血清封闭后,切片置4NHCl,室温10min;1×TBE(pH8.4)洗,室温5min;PBS洗,2min后检测缓冲液的pH值,当pH达7.0~7.5时,加小鼠抗BrdU(1∶20)稀释,室温1~2h;滴加生物素化山羊抗小鼠IgG,20~37℃,20min;PBS洗2次,5min/次。滴加SABC,室温20min。PBS洗2次,5min/次。用DAB试剂盒室温显色,显微镜观察控制显色。苏木精复染。脱水、透明、中性树胶封片。
结果:组织工程肌腱植入后1周,可见完整的人发结构,人发间可见巨噬细胞和中性粒细胞等细胞成分,还可见BrdU阳性反应的细胞;植入后3周,对照组人工腱的外周包绕一层纤维膜,紧靠人工腱有幼稚的腱细胞,其外侧有富含血管的疏松结缔组织。此时人发的毛小皮破裂,在其周围可见吞噬色素颗粒的巨噬细胞和多核巨细胞。在组织工程肌腱植入组,除有新生幼稚腱细胞外,可见许多呈BrdU阳性反应的细胞,呈Ⅰ型胶原阳性反应的腱细胞位于人发周围;植入后9周,对照组腱膜增厚,内层有大量的腱细胞和丰富的毛细血管,外层纤维排列规则,较致密,其间有腱细胞分布。与对照组相比,实验组中HHK人工腱周围的腱细胞和胶原纤维更多些。植入后16周,新形成的胶原纤维粗大,排列较规则,胶原纤维被结缔组织分隔成束。胶原纤维间的腱细胞细长呈梭形,沿腱长轴排列。
(三)超微结构观察
1.样品制备 组织取材后,2.5%冷戊二醛(0.1MPBS配制)固定,4℃过夜。0.1MPBS缓冲液洗涤,1%锇酸后固定,4℃1h。梯度丙酮脱水,Spur树脂包埋,常规超薄切片,醋酸双氧铀及枸橼酸铅双染色,透射电镜下观察肌腱缺损处植入细胞的微细结构及周围胶原纤维的排列形式。
2.结果 植入后第3周,可见数量较多的幼稚腱细胞,胞质中有粗面内质网和游离核糖体,细胞周围有Ⅰ级胶原纤维和大量的Ⅱ级胶原纤维,Ⅰ级胶原纤维组装形成Ⅱ级胶原纤维。植入后12周,有的腱细胞胞质较少,细胞周围有较多的胶原纤维;此时的胶原纤维增粗,排列整齐,有明暗相间的横纹;有的腱细胞功能很活跃,细胞核大,椭圆形,常染色质丰富,胞质内含有大量平行排列的粗面内质网和丰富的线粒体,细胞周围纤维细而少;植入后16周,大部分腱细胞处于功能不活跃状态,胞质中细胞器少,含有分泌泡,泡内可见前胶原蛋白细丝的断面,胶原纤维更粗,排列更加致密规则,横纹更加清晰,类似于成熟的胶原纤维,也可见处于相对静止期的腱细胞,胞质少,细胞器少,由胞体发出翼状突起,伸至周围的胶原纤维束之间。
四、体内植入后组织工程肌腱
Ⅰ、Ⅲ型胶原的共表达
1.总RNA的提取 植入物植入后6周的新生肌腱组织按Trizol Reagent试剂盒说明进行。
(1)匀浆:取液氮保存的兔肌腱组织50~100mg,加入含1ml Trizol Reagent的组织匀浆器中,将肌腱组织制成匀浆。
(2)相分离:转入1.5ml离心管后室温放置5min,以完全分离核蛋白;加入0.2ml氯仿/ml Trizol,振荡15s,室温放置10min,以12 000r/min离心,4℃,15min。最终得到含RNA的水相(约占总体积的60%)及红色的酚氯仿相。
(3)RNA析出:将水相小心吸取,转置另一洁净的1.5ml离心管中,加入0.5ml异丙醇,室温下孵育10min以使RNA充分沉淀;12 000r/min离心,4℃,10min。
(4)RNA洗涤:去上清后,用75%乙醇(以无RNA酶的DEPC水配制)冲洗,9 500r/min,4℃,8min。
(5)RNA重溶解:去上清,迅速吹干RNA(勿完全干燥);加入5μl DEPC水溶解之。
(6)用紫外分光光度计测定RNA浓度,测得OD260/OD280>1.8(1.8~2.0)。同时将RNA样品作琼脂糖凝胶电泳分析,剩余保存于-20℃。
2.RT-PCR反应
按Qiagen onestep RT-PCR试剂盒操作说明书进行上述基因的扩增。具体操作如下:向每个RT-PCR反应体系中依次加入:DEPC水15μl,5×Qiagen onestep RT-PCR缓冲液5μl,dNTP混合物(每种dNTP为10mM)1μl,上、下游引物各1.66μl,Qiagen onestep RT-PCR酶复合物(含有OmniscriptTM反转录酶、SensiscriptTM反转录酶和HotStar TaqTMDNA聚合酶)1μl,RNA酶抑制剂0.25μl,模板1μl,总反应体积为26.55μl,充分混合后,加入与RT-PCR反应体系等体积的矿物油覆盖。反应体系中的无RNA酶的水和模板的量依据具体情况可作适当调整。在PCR仪上进行扩增反应。GAPDH作为外参照。热循环条件为,①反转录:50℃,30min;②初始PCR活化:95℃,15min;③3步循环参数为:变性94℃,1min,退火52℃,1min,延伸72℃,1.5min,共30个循环;终延伸72℃,10min。
PCR反应产物经1%琼脂糖凝胶(含EB)电泳,以ΦⅩ174HincⅡdigest DNA Marker为分子量参照。电泳条件为1× TBE缓冲液,60V电压,室温下电泳。电泳完毕后,在紫外灯下观察照相,密度扫描分析PCR产物电泳带的吸光度,计算Ⅰ型胶原与GAPDH PCR产物的绝对吸光度,两者的比值为Ⅰ型胶原的相对表达量,即以Ⅰ型胶原/GAPDH的比例来计算。
结果:实验组和对照组在肌腱再生修复不同时期的再生腱组织中Ⅰ型胶原mRNA的表达均明显高于正常肌腱,且在植入术后第6周时最高,相比而言,实验组Ⅰ型胶原表达更高,Ⅲ型胶原mRNA却呈低表达;而在Ⅲ型胶原表达较高的单纯HHK植入组(对照组)Ⅰ型胶原则呈较低表达。这一结果说明,在肌腱损伤的再生修复中,既有腱细胞自身分裂、增殖的内源性愈合作用,也有腱周围组织成纤维细胞分裂增殖的外源性愈合作用,这是对腱修复中内源性愈合与外源性愈合并存理论的有力支持和补充。也从另一角度说明,组织工程肌腱更能促进内源性愈合,防止外源性愈合引发的粘连发生。
五、生物力学性能的检测
1.生物力学样品制备 取正常兔肌腱、术后9周、12周、16周兔再生肌腱各2例,使用游标卡尺测量肌腱的横截面积,将其夹持于生物材料试验机(MTS生物材料试验机,美国858-Mini Bionix)上,用自动缓慢拉力作用于肌腱上,拉伸速度为2mm/min,环境温度为25℃,相对湿度70%,拉伸至肌腱完全断裂。计算机采集、处理数据,得到肌腱的最大拉伸应力,即肌腱被拉断瞬间的拉力。
2.结果分析 HHK人工腱作为一种新型生物材料腱,其强度已达正常肌腱的力学强度。HHK人工腱植入体内后腱化成腱的过程中,动物一直可以自由活动。植入9周、植入12周和植入16周,其最大拉应力分别为:73.0191N、100.2294N和163.461N,是正常肌腱拉应力的20.92%、28.71%和46.82%。术后9周时的拉应力强度由未被完全吸收的HHK人工腱和正在形成中的再生腱共同维持,肌腱各部分的拉应力强度很不均一所致。术后12周时,HHK人工腱与再生腱依然共存,但其拉应力亦明显增强。术后16周时,兔肌腱的最大拉应力已达正常兔肌腱的46.82%。结果表明,HHK人工腱植入体内后,在一定时间内保持了较好的力学强度,在体内被降解吸收的同时诱导机体形成新生腱,但术后16周的新生肌腱虽然可适应一定范围的活动,却仍处于肌腱的形成与改建并存时期,尚不能满足肢体过度拉伸的需要。
六、组织工程肌腱的临床应用
上述动物肌腱缺损模型只是用于跟腱缺损的修复,而在人体,手部肌腱的损伤却更为常见,但是由于手部的结构和功能的特殊性,研究有一定困难,只有在跟腱修复的研究中取得进一步深入成熟后,才能用于手部屈指肌腱损伤的修复。
虽然组织工程肌腱在动物研究已取得较大的进展,但距离产业化应用于临床还有很大差距,有许多问题尚待进一步研究:寻找更为适宜的种子细胞,细胞的快速大量扩增,控制细胞的免疫反应;建立组织工程产品的中试基地,规范组织工程产品的审批制度,制定审批标准等。只有经过严格的质量检测,临床验证,由国家权利机构认证后,才能真正应用推广于临床。
(南方医科大学基础部 路艳蒙)
参 考 文 献
1Breitbart AS,Grande DA,Kessler R,et al.
Tissue engineered bone repair of calvarial defects using cultured periosteal cells.Plast Reconstr Surg,1998;101(3):567
2Freed LE,Langer R,Martin I,et al.Tissue engineering of cartilage in space.Proc Natl Acad Sci USA,1997;94(25):13885
3Freed LE,Vunjak- Novakovic G.Microgravity tissue engineering.In Vitro Cell Dev Biol Anim,1997;33(5):381
4Goodship AE.An assessment of filamentous carbon fiber for the treatment of tendon injury in the horse.The veterinary Record,1980;8:217 5Ricci G.Morphological characteristics of tendon cells cultured on synthetic fibers.J Biomed Materials Research,1984;18:1073
6Schwarz RP,Goodwin TJ,Wolf DA.Cell culture for three-dimentional modeling in rotating wall vessels:Anapplication of simulated microgravity.J Tissue Culture Methods,1992;14(2):51
7Saltzman WM.Weaving cartilage at zero g:the reality of tissue engineering in space.Proc Natl Acad Sci USA,1997;94(25):13380
8Vacanti MP,Leonard JL,Dore B,et al.Tissue-engineered spinal cord.Transplant Proc,2001;33(1-2):592
9Woo SL,Hildebrand K,Watanabe N,et al.Tissue engineering of ligament and tendon healing.Clin Orthop,1999;(367Suppl):S312
10Xu XM,Zhang SX,Li H,et al.Regrowth of axons into the distal spinal cord through a Schwann-cell-seeded mini-channel implanted into hemisected adult rat spinal cord.Eur J Neurosci,1999;11(5):1723
11 朴英杰,刘连璞,戴 云,等 .人发角蛋白人工腱植入部位的形态学观察 .电子显微学报,1998;17(4):423
12王 前,曹启迪,卢海俊,等.109HH人工腱体内腱化过程中力学性能测评 .中国临床解剖学杂志,1996;14(4):310
13 项 舟,杨志明,蔚 凡,等 .组织工程人工肌腱的实验研究 .中华手外科杂志,2000;16(3):140
14 季爱玉,邹云雯,夏精武 .人发角蛋白人工腱在跟腱修复中的应用 .青岛医学院学报,1999;35(1):52
15 陈文直,陈秉礼,赵大渝,等 .早期控制被动活动对游离肌腱移植的影响 .中国修复重建外科杂志,1993;7(3):177
16 邹云雯,王志杰,季爱玉,等 .人发角蛋白人工肌腱的免疫学研究及临床应用的初步结果 .中华手外科杂志,1999;15(4):208
17 黄凤鸣,韩汉平,宋 涛,等 .人发肌腱的实验研究与临床应用.中华实验外科杂志,1988;5(2):64
18 杨志明 .组织工程基础与临床 .四川:科学技术出版社,2000:211-218
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














