第二节 免疫治疗在肺癌治疗中的应用
肺癌的免疫治疗是一种应用细胞生物学和分子生物学手段,对机体免疫系统或肿瘤生长进行调节,从而杀伤或抑制肿瘤生长的治疗方法,是手术、放疗、化疗三大常规治疗的有益补充。特别是在现代免疫学理论和生物技术飞速发展的基础上,免疫治疗显示出良好的临床应用前景。
一、非特异性主动免疫治疗
许多物质(主要是微生物及其制剂)可以刺激网状内皮系统活性,非特异性的增强免疫功能。非特异性主动免疫治疗就是通过这些物质的刺激,以增强机体的抗肿瘤免疫功能。这种方法不依赖于肿瘤抗原的识别,也不受MHC-Ⅰ限制。自20世纪50年代以来,卡介苗、短小棒状杆菌等相继应用于临床。随着时间的推移,不断有新的微生物制剂得到研究和应用。日本学者采用溶链菌制剂(OK432)雾化吸入法治疗支气管肺泡癌,取得了很好的效果。进入肺泡内的OK432在局部激活了肺泡内的巨噬细胞,诱导抗肿瘤细胞毒活性并产生多种细胞因子(如IL-2、TNF-α等)。Sakamoto等将1 520个例手术切除原发灶后的NSCLC患者随机分为两组,分别给予OK-432辅助性免疫化疗及单纯化疗。其结果经Meta分析提示,术后用OK-432辅助性免疫化疗可以提高NSCLC患者的术后生存率。O'Brien等对不能手术的NSCLC患者给予化疗,并对其中部分患者辅以热灭活牝牛分枝杆菌菌苗(SRL172)非特异性主动免疫治疗,结果发现SRL172注射组中位存活率及1年生存率均明显高于对照组。目前认为,非特异性主动免疫治疗与化疗联合应用,在增强机体抗肿瘤免疫功能的同时,又在一定程度上拮抗了化疗药物对机体免疫系统的抑制作用,因而能够取得令人比较满意的结果。
二、特异性主动免疫治疗
肿瘤疫苗(tumor vaccine)是应用处理过的自体肿瘤细胞、培养的肿瘤细胞、异体肿瘤细胞或基因工程疫苗在体外经致死性剂量照射后,重新接种于患者体内,可以激发或增强患者的特异性抗肿瘤免疫应答,抑制或减少肿瘤的生长、转移及复发。因此又被称为肿瘤特异性主动免疫(specific active immunotherapy)。其优点为针对性强、特异性 CTL直接杀伤相应的肿瘤细胞,特异性免疫反应物细胞因子等能激活非特异性免疫起协同增强作用和免疫记忆功能。在肿瘤诱发机体主动特异性免疫的不同阶段采取相应措施,以增强机体对肿瘤的主动特异性免疫功能。在20世纪初肿瘤疫苗开始应用于临床,通过给患者注射肿瘤疫苗,激发特异性细胞免疫功能来攻击肿瘤细胞,克服因肿瘤代谢产物而造成的免疫抑制状态和增强肿瘤相关抗原的免疫原性,从而提高自身免疫力,达到治疗肿瘤的目的。目前临床应用的肺癌疫苗有以下几种。
CTL直接杀伤相应的肿瘤细胞,特异性免疫反应物细胞因子等能激活非特异性免疫起协同增强作用和免疫记忆功能。在肿瘤诱发机体主动特异性免疫的不同阶段采取相应措施,以增强机体对肿瘤的主动特异性免疫功能。在20世纪初肿瘤疫苗开始应用于临床,通过给患者注射肿瘤疫苗,激发特异性细胞免疫功能来攻击肿瘤细胞,克服因肿瘤代谢产物而造成的免疫抑制状态和增强肿瘤相关抗原的免疫原性,从而提高自身免疫力,达到治疗肿瘤的目的。目前临床应用的肺癌疫苗有以下几种。
(一)肿瘤细胞疫苗
肿瘤细胞具有特异性肿瘤抗原,能够被宿主免疫系统识别,引起免疫反应,破坏肿瘤细胞。在大多数情况下,肿瘤细胞本身抗原性较弱,或抗原特异性不强,不足以引起有效的抗肿瘤反应;可应用加热、冷冻、照射、经神经氨酸酶或病毒处理等物理、化学或生物学方法处理肿瘤细胞,改变抗原结构,提高免疫原性。随着基因技术的发展,出现了基因修饰的肿瘤细胞疫苗,主要包括MHC分子、共刺激信号B7分子、各种细胞因子及其受体、黏附分子以及编码肿瘤抗原肽的基因修饰的肿瘤细胞。如用载有人类B7-1 cDNA的腺病毒感染肺癌细胞,可使这些肺癌细胞表面迅速产生充足的B7-1分子,刺激机体T细胞对肿瘤的免疫反应,其结果是对B7-1阳性或阴性的肺癌细胞均产生了溶解杀伤能力。有人认为,作为疫苗的肿瘤细胞含有除肿瘤抗原以外的其他成分,而这些成分所引起的副反应有可能对机体造成伤害。因此,目前主张肿瘤疫苗应以确定的糖蛋白或糖脂而不是整个细胞或未确定成分的细胞提取物为基础。研究表明,小段肽段能够代替作为免疫原的完整肿瘤细胞。Kawano等研究发现了一种与肺癌相关的新的基因,位于染色体q31、22,可编码一种含有412个氨基酸、相对分子质量为46 ku核实的蛋白质。这种蛋白质在除白血病以外的大多数恶性细胞及组织中均有表达。其两个肽段(13~20、75~84)可诱导肺癌患者外周血单核细胞产生HLAA24限制性肿瘤特异性细胞毒T细胞(CTL),HLA-A24对阳性的肺癌有特异性免疫治疗作用。
(二)分子疫苗
1.胚胎抗原疫苗过去在肺癌方面研究较多的是癌胚抗原(CEA),近年来黑色素瘤抗原基因(MAGE)与肺癌的关系逐渐引起人们的重视。MAGE是从黑色素瘤中分离出的一族肿瘤胚胎抗原基因,主要包括MAGE-1、MAGE-2、MAGE-3。最近有研究认为,MAGE-3 mRNA在我国NSCLC中的表达率为53.6%,而正常肺组织中未见MAGE-3 mRNA表达,说明该基因具有肿瘤特异性。而另一项研究发现,在104例NSCLC中,未见同一标本中部分肿瘤细胞MAGE-3抗原阳性而另一部分为阴性的情况,只见到全部肿瘤细胞MAGE-3抗原阳性或阴性,说明选用MAGE-3基因产物作为靶分子对阳性患者进行免疫治疗,有可能对全部肿瘤细胞均产生杀伤效应。肿瘤相关性抗原MAGE-3的疫苗已进入治疗NSCLS的临床试验阶段。欧洲48个机构参与的一项多中心研究,参加者180例,其中120例应用针对MAGE-3的疫苗(GSK249533),60例应用安慰剂,74例经免疫组化测得MAGE-3(阳性)。
2.抗独特型疫苗抗独特型抗体是抗原的内影像,它可以模拟抗原成为疫苗,只需以所需抗原的单抗为免疫原制备抗体,其制备简单,免疫原性强。有人以抗神经节苷酯GD2的单克隆抗体14G2A(Ab1)作为免疫原,诱导产生出抗独特型抗体1A7(Anti-Id 1A7)并将其用于SCLC的免疫治疗,可使生存时间明显延长,本研究在美国已进入Ⅲ期临床阶段。而针对SCLC的疫苗主要集中对GD2、GD3的抗独特性抗体的研究。GD3的独特性抗体BEC2被认为可以特异性的与肿瘤上高度表达的GD3结合从而起到治疗的作用,目前业已进入Ⅲ期临床试验。外源性的肿瘤相关抗原(tumora ssociateda ntigen,TAA)免疫动物能产生特异型抗体Abl,而Abl本身具有免疫原性,其免疫动物可产生抗独特型抗体Ab2。部分Ab2在三度空间上类似外源性TAA,称为Ab2p,这种R型的抗独特型抗体被称为体内的抗原内镜像,它可以模拟抗原激发相应的淋巴细胞增殖,重诱导机体免疫系统产生针对TAA的特异型抗体Ab3,而Ab2p即为抗独特型疫苗。Ab2p具有模拟抗原及免疫调节的双向作用,能克服机体的免疫耐受,诱导出机体对肿瘤抗原的主动特异性免疫反应。长链多唾液酸(polySA)是位于胚胎神经细胞黏附分子上的侧链,主要是限制SCLC的生长。在抗SCLC相关抗原单克隆抗体2F7的基础上,通过杂交瘤技术筛选出一株高亲和力的抗独特型抗体3F6;同时,利用基因工程技术制备了3F6 ScFv。检测表明3F6和3F6 ScFv具有模拟SCLC细胞膜表面特异抗原的能力,诱导了相应的体液和细胞免疫应答。
3.肽及核酸疫苗肿瘤抗原的提呈必须先在抗原提呈细胞的胞内降解为短肽,与MHC分子结合,最后形成肽-MHC-TCR复合物提呈在细胞表面,使T细胞所识别。肽疫苗主要包括癌基因、抑癌基因突变肽疫苗和病毒相关疫苗。已合成癌基因、抑癌基因突变肽疫苗,构建p21突变肽、p53基因产物、EGFRr突变肽、Her2/neu肽等疫苗,可能对肺癌的防治有一定的价值。核酸疫苗被称为第3代疫苗,包括DNA疫苗和RNA疫苗,由能引起保护性免疫反应的抗原基因片段及其载体构建而成。从患者细胞中提取少量DNA注入患者体内,可高表达相应抗原,被DC摄取并致敏DC后,可激发高效的细胞和体液免疫,引导其他细胞继续产生反应,而且能介导CTL效应,从而抵抗同源肿瘤细胞的接种。
4.癌基因产物作为分子疫苗目前,比较明确的与肺癌有关的基因主要有原癌基因Ras、Myc基因家族及抑癌基因p53、p16、Rb等。这些基因的蛋白质产物具有高度免疫原性,可成为机体免疫系统的靶目标。Yanuck等用突变的p53蛋白免疫肺癌鼠模型,诱导产生出了特异性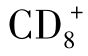 CTL,杀灭突变p53基因表达阳性的肺癌细胞。肿瘤相关抗原MUC-1的疫苗也在研究中,目前正在进行对MSCLCⅢ期患者的试验中。随着基因技术的发展,癌基因产物作为分子疫苗,具有广阔的前景。
CTL,杀灭突变p53基因表达阳性的肺癌细胞。肿瘤相关抗原MUC-1的疫苗也在研究中,目前正在进行对MSCLCⅢ期患者的试验中。随着基因技术的发展,癌基因产物作为分子疫苗,具有广阔的前景。
(三)转基因疫苗
转导细胞因子基因使其表达产物直接作用于免疫细胞,促进其生长、分化,以提高机体抗瘤能力,且某些基因的导入甚至可使局部分泌相关细胞因子,从而杀伤肿瘤细胞。Gvax疫苗是从切除的肿瘤中分离并培养癌细胞,使其分泌粒细胞集落刺激因子(granulocyte colony-stimulatingfa ctor,G-CSF),并在其中添加能刺激免疫系统产生抗体的基因,最后将这些基因修饰过的细胞进行辐射处理,制成的肿瘤疫苗。BLP-25是以抗黏液性相关糖蛋白(MUC-1)和IL-2所构建的一种新的肺癌疫苗。MUC-1是一种表皮糖蛋白,在肺癌等多种肿瘤细胞表面有MUC-1的异常高表达和糖基化,MUC-1还能掩盖肿瘤细胞抗原,逃避免疫细胞的识别。研究表明,BLP-25脂质体疫苗患者易耐受,主要诱导细胞免疫功能,毒性轻微,值得临床深入研究。用逆转录病毒、腺病毒等载体将目的基因导入肿瘤细胞内就形成了基因工程疫苗。例如Niethammer等将编码CEA的基因导入肺癌细胞,以其作为疫苗可使CTL和DC活化,产生抗肺癌作用。此外,编码蛋白质的质粒也可发展为肿瘤疫苗。研究表明,几乎所有SCLC细胞均表达副肿瘤性脑脊髓炎抗原(HuD抗原),抗HuD抗体阳性的SCLC患者预后明显好于抗HuD抗体阴性者。据此,Carpentier等用编码分泌型HuD抗原的质粒免疫同样表达HuD抗原的神经母细胞瘤鼠模型,发现肿瘤生长明显受到抑制。近年来出现了双基因表达质粒,如在构建CEA-DNA质粒的同时,导入B7因子的DNA于同一质粒,则注入的细胞可同时表达CEA和B7因子,提高了抗瘤作用。目前这种双基因表达质粒已进入临床应用。
(四)抗原提呈细胞疫苗
机体的APC主要包括DC、巨噬细胞和B细胞等,其中DC是抗原提呈功能最强、在抗肿瘤免疫治疗中应用最广泛的一类APC。各种形式的肿瘤抗原体外冲击致敏的DC可以诱导机体生成高水平的特异性抗肿瘤免疫。Itoh等应用CEA652(一种分离自CEA的HLA-A24限制性9肽)冲击致敏的DC对肺癌进行免疫治疗,取得了较满意的效果。Naira等用自体同源的肿瘤细胞总RNA转染的DC诱导出了对全部肿瘤抗原均有免疫反应的肿瘤特异性CTL。有研究认为,DC与细胞因子配伍应用可以收到更好的疗效,如体内注射IL-12基因修饰的DC,能促进DC的免疫激发功能;将淋巴细胞趋化因子(Lptn)、粒—巨细胞集落刺激因子(GM-CSF)基因导入正常鼠的DC中,再以肿瘤抗原肽冲击,可诱导更强的CTL。将DC与肺癌细胞融合,利用基因工程技术将肺癌抗原基因、细胞因子基因导入或修饰DC,而进行DC免疫、DC细胞治疗、DC免疫基因治疗等,成为肺癌肿瘤疫苗发展方向之一,该技术已由美国FDA批准开始应用于临床。目前,已经能够从患者外周血中制备大量的DC来供制备疫苗。还有学者进行试验来测试DC捕获肿瘤细胞的能力,同时提供了一个应用经过修饰的腺癌细胞(A549-M1)的体外系统来测试肿瘤抗原的替代品。实验发现外周血单核细胞来源的DC,当其在与处理过的A549细胞或外科手术取出的NSCLC细胞共培养,可以明确的通过电镜或流式细胞仪发现DC摄取肿瘤细胞。更重要的是,DC运载的A549-M1细胞能有效的将肿瘤抗原摄取和递呈给T细胞,从而激发相应的免疫反应。而且还发现由DC运载的灭活的肿瘤细胞比其运载的肿瘤细胞的裂解物更能有效激发机体的抗肿瘤应答。研究发现,腺病毒载体在承载外源基因较其他载体在基因转染方面有优势,包括能够激活未成熟和成熟的DC,能高表达DC,且DC疫苗较少产生抗体,即使没有治疗性的转染也能提高DC的功能。Nemunaitis等在多中心的临床试验中,在Ⅰ/Ⅱ期NSCLC的患者中应用腺病毒载体承载的自身肿瘤细胞源的疫苗来检测其可行性、安全性、有效性。疫苗通过皮下注射每2周1次,共3~6次,在83例患者中67例患者被成功接种,43例患者得到有效免疫,而不良反应仅为局部注射部位的毒性反应,发生率为93%。研究发现,有效免疫后的患者中持久分泌GM-CSG,患者将获得更好的愈后,提示疫苗接种成功对生存率的密切相关性。Mariani等应用表达IL-7的腺病毒转染DC治疗ⅡB期和Ⅳ期NSCLC的临床试验正在进行中。
三、过继免疫治疗
过继性免疫治疗(Adoptive cellular immunotherapy,ACI或AIT)是指向肿瘤患者转输具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤或激发机体免疫反应杀伤肿瘤细胞。用于治疗肺癌的免疫活性细胞主要有淋巴因子激活的杀伤细胞(lymphokine-ac tivatedk illerc ells,LAK)、肿瘤浸润的淋巴细胞(tumor-infiltrating lympbocytes,TIL)、细胞因子激活的杀伤(cytokine-induced killer CIK)细胞等。
LAK细胞目前在ACI中应用最为广泛。1985年,Rosenberg等首次应用LAK/IL-2治疗晚期恶性肿瘤,取得令人鼓舞的效果。1987年,Yasumoto等首次报告使用IL-2胸内注射诱导LAK细胞治疗肺癌性胸水11例,9例有效。肿瘤浸润淋巴细胞(tumor-infiltrating lympbocytes,TIL)是用于ACI的一种新的效应细胞。
TIL抗瘤活性高于LAK细胞,并有一定的靶细胞特异性,能与IL-2有协同作用。1988年Rosenberg等首次用TIL治疗20例转移性黑色素瘤,取得较好效果。肺癌的TIL治疗效果尚不确定,有实验报道肺癌TIL对自体癌细胞具有杀伤活性,如Ratto研究小组用TIL协同大剂量IL-2治疗肺癌,发现Ⅲ期患者生存期明显提高。而另一些实验提示,肺癌TIL细胞对自体癌细胞的杀伤活性较低下。Kim等的研究发现,经IL-2培养的人肺癌组织分离培养的TIL细胞对肺癌细胞均具有不同程度的杀伤活性;而经FasL抗体封闭后的肺腺癌,TIL对其杀伤作用均有所下降。这也为肺癌的免疫逃避提供了一定的理论基础。
CD3AK细胞(anti-CD3McAb activited killer Cells)是由抗CD3单克隆抗体激活的杀伤细胞,具有扩增能力强、体外存活时间长、细胞毒活性高、体内外抗肿瘤效果明显和分泌淋巴因子能力强等优点。高中度等采用CD3AK细胞支气管动脉灌注与化疗药物灌注联合应用治疗中晚期肺癌,比单纯支气管动脉化疗疗效明显提高。
CIK细胞又称为NK细胞样T淋巴细胞,以 细胞为主要效应细胞,其中还包含着相当数量的
细胞为主要效应细胞,其中还包含着相当数量的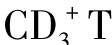 细胞
细胞 细胞和NK细胞。研究表明,与过去的过继免疫疗法LAK细胞、TIL细胞和
细胞和NK细胞。研究表明,与过去的过继免疫疗法LAK细胞、TIL细胞和 AK细胞相比,CIK细胞具有增殖速度快,杀瘤活性高,杀瘤谱广,对多重耐药肿瘤细胞同样敏感、对正常骨髓造血前体细胞毒性小,被认为是新一代过继免疫治疗的首选方案。杨新静等将CIK细胞用于肺癌的治疗研究,研究发现经过体外制备的CIK细胞不仅增殖速度快,而且对肺癌细胞体内外均具有高效的杀伤活性。新近的研究表明,CIK细胞与DC共培养较CIK细胞单独培养繁殖增快,且细胞毒性增强。因此,CIK细胞在肿瘤过继免疫治疗中具有良好的应用前景。但动物实验提示,抑制
AK细胞相比,CIK细胞具有增殖速度快,杀瘤活性高,杀瘤谱广,对多重耐药肿瘤细胞同样敏感、对正常骨髓造血前体细胞毒性小,被认为是新一代过继免疫治疗的首选方案。杨新静等将CIK细胞用于肺癌的治疗研究,研究发现经过体外制备的CIK细胞不仅增殖速度快,而且对肺癌细胞体内外均具有高效的杀伤活性。新近的研究表明,CIK细胞与DC共培养较CIK细胞单独培养繁殖增快,且细胞毒性增强。因此,CIK细胞在肿瘤过继免疫治疗中具有良好的应用前景。但动物实验提示,抑制 的调节性T细胞能显著抑制CIK细胞的增殖,从而抑制CIK发挥抗肿瘤作用。
的调节性T细胞能显著抑制CIK细胞的增殖,从而抑制CIK发挥抗肿瘤作用。
近来,Ebina等将BAK(生物反应调节剂激活的杀伤细胞)疗法应用于NSCLC的治疗。将30例NSCLC患者根据血清中免疫抑制酸性蛋白(immunosuppressive acidic protein,IAP)的水平分成两组,同时给予BAK细胞治疗。具有免疫抑制(IAP>580 mg/ml)的NSCLC患者平均生存期为5.2个月,而具有免疫反应(IAP<580 mg/ml)的NSCLC患者的平均生存期为26.3个月,两者具有显著差异。该研究提示,具有免疫活性的NSCLC患者更适合BAK疗法。BAK细胞治疗可纠正免疫功能低下,有利于延长NSCLC患者的生存期,提高生存质量。
四、细胞因子治疗
细胞因子使免疫效应细胞活性增加,对肿瘤细胞有不同程度的抑制和杀伤作用,可改变肿瘤细胞表面抗原结构,提高肿瘤细胞免疫原性。传统的细胞因子疗法主要是外源性细胞因子输入,常用于肺癌治疗的细胞因子有干扰素-α(IFN-α)、白细胞介素(IL)-2、肿瘤坏死因子-α(TNF-α)、G-CSF、促红细胞生成素(EPO)和血小板生成因子(TPO)等。IFN-α是最早发现的具有抗癌效应的细胞因子。与标准的单一放化疗相比,联合持续低剂量应用IFN-α治疗组中位生存期有显著延长。IL-2有诱导T淋巴细胞、CTL细胞和B细胞的增殖分化,促进多种细胞因子分泌,激活NK细胞、LAK细胞和TIL细胞,增强单核细胞的免疫活性等作用。在肺癌中的应用,可以弥补患者体内IL-2水平不足,延长广泛期NSCLC生存期,控制癌性胸腔积液等治疗。白介素是种类最繁多、应用最广泛、作用最复杂的一类。IL-2和IL-6是人们了解比较清楚、在抗肿瘤方面应用比较成熟的两种白介素。随着研究的深入,不断有其他种类的白介素被发现与肺癌的发生发展有关。Takeuchi等研究发现,IL-12可诱导肺癌患者胸水及外周血中的单核细胞产生明显的杀瘤活性;且在肺癌患者中,经IL-12孵育的胸水单核细胞可产生更多的IFN-γ。IL-18是最新发现的具有抗肿瘤和抗血管生成作用的细胞因子。Lissoni等的研究提示,IL-18的水平与肺癌的转移之间存在一定关系。IL-24是近来发现的一种新白介素,利用腺病毒转染的方法发现其可抑制肺癌细胞的增殖,并可以增强肺癌细胞对放疗的敏感性。TNF-α是由巨噬细胞分泌的一种具有复杂生物活性的细胞因子,它具有直接细胞毒或抑制肿瘤细胞的作用,对肿瘤的免疫治疗具有一定的疗效。G-CSF、EPO和TPO尽管不具备抗肿瘤作用,但在预防和治疗化疗药物所致的骨髓抑制,确保化疗方案的如期进行,减少感染发生率等,有肯定的治疗价值。
五、抗肿瘤抗体及其导向治疗
抗体疗法正成为肺癌的另一研究热点,它已成为肺癌综合治疗的一部分。抗体疗法包含两种机制:一是以生长因子、细胞因子、蛋白激酶C、环氧化酶2(COX-2)的受体等作为肺癌治疗的靶向性位点,运用相应的单克隆抗体与异常表达的癌基因产物结合可以阻断癌细胞的异常信号传导通路,从而阻止癌症的发展;二是利用抗体的导向性,以抗体为载体,将抗癌效应物质聚集在肿瘤区域以杀伤肿瘤。
(一)游离抗体被动或主动免疫治疗
肿瘤特异性抗原及肿瘤相关抗原、独特型决定簇、某些细胞因子的受体、激素及一些癌基因产物可作为肿瘤特异性或相关靶分子,通过免疫学方法、细胞工程和基因工程技术制备抗这些靶分子的抗体,将其注入体内可对肿瘤进行免疫治疗。而抗体的形式以单克隆抗体应用最为广泛,如抗神经节苷酯GM2单克隆抗体(McAb)可有效的抑制GM2阳性肺癌细胞的生长和转移。如在此基础上辅以基因修饰等方法,将进一步增强抗体的抗肿瘤作用。Nokihara等的研究表明,将单核细胞趋化蛋白-1(MCP-1)基因导入肺癌细胞后,可增强抗P糖蛋白单克隆抗体介导的ADCC作用,从而提高抗P糖蛋白单克隆抗体的抗瘤效果。
(二)抗体导向治疗
以肿瘤特异性抗体为载体,将抗癌效应物质浓集在肿瘤病灶处,特异性的杀伤靶细胞,这种细胞毒性物质—抗体结合物称为免疫耦联物或导向药物。目前,抗体疗法正成为肺癌的另一研究热点,已成为肺癌综合治疗的一部分。生长因子、细胞因子、蛋白激酶C、COX-2的受体是肺癌治疗的靶向性位点,运用相应的单克隆抗体与异常表达的癌基因产物结合可以阻断癌细胞的异常信号传导通路,从而阻止癌症的发展,目前临床研究已进入Ⅱ期。表皮生长因子(EGFR)是癌基因cerbB-1的编码糖蛋白,几乎所有SCLC组织中均高度表达,应用EGFR单抗或者是复合的免疫毒素诸如表皮生长因子\白喉毒素免疫治疗肺癌,目前已处于Ⅰ期临床阶段。在两项Ⅱ期临床试验中证实ZD1839的表皮生长因子抑制剂在NSCLC治疗中的良好前景。氨酸激酶的抑制剂已进入了Ⅰ期临床阶段。COX-2在正常组织中几乎测不到,在肺癌中高表达,在肺癌病情的发展中起重要作用,其抑制剂如某些非甾体类抗炎药在治疗中有一定的特异性。包括IMC-C225、OSI-774等类似药物的临床试验在进行中。双特异性抗体(Bispecific Antibody,BsAb)靶向治疗也是目前研究的一个热点。BsAb的一个臂可与肿瘤细胞等抗原结合,而另一个臂可与效应物如前体药物、效应细胞等结合,将效应物直接导向靶细胞。Renner等利用双特异性抗体将CD3AK细胞直接导入肿瘤细胞,将单克隆抗体的高度特异性和CD3AK细胞的杀伤效应联合起来,提高了对肿瘤细胞的杀伤作用。近年来,在抗体导向治疗的基础上,出现了免疫脂质体(Immunoliposome)。免疫脂质体集脂质体的特性和抗体的导向性于一体,借助抗体与细胞表面抗原或受体结合,经吞噬或吞饮进入细胞内,释放出包封的药物杀伤细胞,具有杀伤力强、特异性高、药物效量大等特点。Sugano等以表达于NSCLC细胞表面的整合素B为靶分子,将抗整合素B的特异性抗体的Fab片段共轭连接到负载有抗肺癌药物的脂质体上,结果显示其对肺癌细胞的杀伤作用较未连接抗体的脂质体提高了30倍。
肿瘤免疫治疗是应用各种生物活性制剂来激发调动、调节机体的免疫功能和抗癌能力,变被动抗癌为主动抗癌,具有巨大治疗潜力。近十年来在这方面的研究已经全面展开,但多数结果需要进一步验证。肿瘤的免疫治疗虽还处在初始阶段,但目前已将其与肿瘤手术、化疗、放疗三大疗法并列,成为第四大疗法。肺癌这一对人类威胁最大的恶性肿瘤必然成为免疫治疗研究的主要对象。随着研究的广泛和深入,新的更加安全有效的免疫疗法会不断走进临床实践,成为肺癌综合治疗的重要组成部分。
(宋丽华)
1.黎涛,孙耀昌,徐志飞,等.非小细胞肺癌MAGE-3基因的表达[J].解放军医学杂志,2001,26:201-203.
2.夏敬文,陈小东.肺癌免疫治疗的新进展[J]国外医学:呼吸系统分册,2005,25(2):140-142.
3.李慧,任秀宝,张彭,等.树突状细胞对CIK细胞中 细胞数量及免疫调节作用的影响[J].中华医学杂志,2005,85(44):3 134-3 138.
细胞数量及免疫调节作用的影响[J].中华医学杂志,2005,85(44):3 134-3 138.
4.Pass HI,Kalemkerian G,Bright RK.Novel molecular and immunotherapeutic strategies for lung cancer[J].Chest Surg Clin Nam,2001,11:189-212.
5.Sakamoto J,Teramukai S,Watanabe Y,et al.Meta-analysis of adjuvant immunochemotherapy using OK-432 in patients with resected non-small-cell lung cancer[J].J Immunother,2001,24:250-256.
6.Tokujiro YMD,Ichiro YMD,Hiromisu BMD,et al.Immunologic strategies for the treatment of non-small cell lung cancer[J].Surgery,2002,131(1 Suppl):S232-235.
7.Iwakami SI,Setoguchi Y,et al.Replication-deficient adenovirus-mediated transfer of B7-1(CD80)cDNA induces anti-tumour immunity in isolate human lung cancer[J].Respirology,2001,6:135-144.
8.Itoh T,Ueda Y,Kawashima I,et al.I mmunotherapy of solid cancer using dendritic cells pulsed with the HLA-A24-restricted peptide of carcinoembryonic antigen[J].Cancer Immunol Immunother,2002,51:99-106.
9.Nair SK,Morse M,Boczkowski D,et al.Induction of tumorspecific cytotoxic T lymphocytes in cancer patients by autologous tumor RNA-transfected dendritic cell[J].Ann Surg,2002,235:540-549.
10.Niethammer AG,Primus FJ,Xiang R,et al.An oral DNA vaccine against human carcinoembryonic antigen(CEA)prevents growth and dissemination of Lewis lung carcinoma in CEA transgenic mice[J].Vaccine,2001,20:421-429.
11.Parajuli P,Yanagawa H,Hanibuchi M,et al.Humanized antiganglioside GM2antibodydependent cell-mediated cytotoxicity in mononuclear cells from lung cancer patients[J].Cancer Lett,2001,165:179-184.
12.Sugano M,Egilmez NK,Yokota SJ,et al.Antibody targeting of doxorubicin-loaded liposomes suppresses the growth and metastatic spread of established human lung tumor xenografts in severe combined immunodeficient mice[J].Cancer Res,2000,60,6 942-6 949.
13.Takeuchi E,Yanagawa H,Suzuki Y,et al.IL-12-induced production IL-10 and interferon-gamma by mononuclear cells in lung cancer-associated maligantn pleural effusions[J].Lung Cancer,2002,35:171-177.
14.Simon G,Ginsberg RJ,Ruckdeschel JC.Small-cell lung cancer[J].Chest Surg Clin N Am,2001,11(1):165-188.
15.Almand B,Carbone DP.Biological considerations in lung cancer[J].Cancer Treat Res,2001,105(1):1-30.
16.Bhattacharya-Chatterjee M,Chatterjee SK,Foon KA.The antiidiotype vaccines for immunotherapy[J].Curr Opin Mol Ther,2001,3(1):63-69.
17.Korst RJ,Crystal RG.Active,specific immunotherapy for lung cancer:hurdles and strategies using genetic modification[J].Ann Thorac Surg,2003,76(4):1 319-1 326.
18.Nair SK,Morse M,Boczkowski D,et al.Induction of tumorspecific cytotoxic T lymphocytes in cancer patients by autologous tumor RNA-transfected dendritic cells[J].Ann Surg,2002,235(4):540-549.
19.Zhou Y,McEarchern JA.Dendritic cells efficiently acquire and present antigen derived from lung cancer cells and induce antigen-specific T-cell responses[J].Cancer Immunol Immunother,2003,52(7):413-422.
20.Nemunaitis J,Sterman D.Granulocyte-macrophage colony-stimulating factor gene-modified autologous tumor vaccines in non-small-cell lung cancer[J].J Natl Cancer Inst,2004,96(4):326-331.
21.Hege KM,Carbone DP.Lung cancer vaccines and gene therapy[J].Lung Cancer Volume,2003,41(1):103-113.
22.Spira A,Ettinger DS.Multidisciplinary management of lung cancer[J].N Engl J Med,2004,350(4):379-392.
23.Spiro SG,Porter JC.Lung cancer-where are we today? Current advances in staging and nonsurgical treatment[J].Am J Respir Crit Care Med,2002166(9):1 166-1 196.
24.Langer CJ.Role of targeted therapy in non-small cell lung cancer:hype or hope[J].Expert Rev Anticancer Ther,2003,3(4):443-455.
25.Thomas M.Overview of clinical trials with epidermal growth factor receptor inhibitors in advanced non-small cell lung cancer[J].Semin Oncol Nurs,2002,18(Suppl 4):20-27.
26.Castelao JE,Bart RD 3rd,DiPerna CA,et al.Lung cancer and cyclooxygenase-2[J].Ann Thorac Surg,2003,76(4):1 327-1 335.
27.Riddle J,Lee P,Purdom M.The epidermal growth factor receptor as a novel target for cancer therapy:case studies and clinical implications[J].Semin Oncol Nurs,2002,18(Suppl 4):11-19.
28.Mami-Chouaib F,Echchakir H,Dorothee G,et al.Antitumor cytotoxic T-lymphocyte response in human lung carcinoma:identification of a tumor-associated antigen[J].Immunol Rev,2002,188(1):114-121.
29.Ingo T,Bernd D,Gunther H.Antisense therapy on oncology:new hope for an old idea[J].Lancet,2001,358(9280):489-497.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















