第二十九章 老年肺癌的治疗
肺癌是目前世界上发病率和病死率最高的癌症之一,每年约有50万新增肺癌患者被确诊,其中NSCLC占80%~85%,SCLC占15%~20%。>50%的NSCLC患者在诊断时年龄>65岁,美国的流行病学数据显示,中位年龄为70岁;在英国,肺癌的高发年龄在75~80岁,普通人群中肺癌发病率为69/10万,而在>75岁的人群中发病率可达751/10万。估计在全球范围内,每年50万肺癌患者中超过半数的患者年龄>70岁。值得注意的是在过去10年间,<50岁年龄组肺癌的发生率和病死率降低,而>70岁年龄组肺癌的发生率和病死率升高。因此,老年性肺癌正逐渐成为肿瘤学家必须面对的常见病。
一、老年人肺癌的特点
老年肺癌的发病机制目前认为有以下几点:①致癌累加学说。老年人暴露于致癌因素的时间长,致癌作用的累加容易导致细胞的癌变。大量资料表明,吸烟与肺癌的发生有着剂量—效应关系,长期大量吸烟是导致肺癌发生的一个重要因素;此外,大气污染、职业等致癌因素在人体内累加易导致肿瘤的发生。②老年人器官功能减退,使肿瘤易于发生。如对肿瘤细胞的免疫监视功能下降,不能识别和清除突变的细胞。③老年人多伴有组织细胞的退行性改变,生理机能下降,从而影响器官功能。与肺癌相关密切的是心肺功能,最常见的合并症有心脑血管疾病(23%),慢性阻塞性肺疾病(Chronic obstructivepulmonary disease,COPD)(22%)以及其他肿瘤(18%)。其中,在老年肺癌患者中,心脑血管疾病和COPD的发生率约为其他年龄组肺癌患者的2倍。合并症的存在,很有可能会成为老年肺癌患者治疗方案的选择以及预测生存时间等因素。有资料显示,966例中位年龄>70岁的老年肺癌患者中,合并有COPD和心脑血管疾病的比率分别为7.6%和26.3%,而每一种合并症对生存时间的长短均产生了负面影响,与行为状况和肿瘤分期呈负相关。其病理特点以鳞癌多见,好发于老年男性,长期抽烟史的患者。有研究表明,鳞癌与年龄呈正相关关系,年龄越大,肿瘤的恶性程度越低。一些学者发现,年龄与肺癌的分期呈负相关关系,这种趋势对NSCLC的患者特别明显,在几组SCLC患者中也有报道。老年肺癌患者最常见的首发症状是咳嗽、咳痰伴气促,其中气促为晚期肺癌患者最常见十大主诉之一,呼吸困难伴痰血者占1/3~1/4。这些症状与其他呼吸道疾病十分相似,尤其是老年人多伴有COPD及心血管疾病,咳嗽、咳痰伴气促及呼吸困难均较为常见,缺乏诊断特异性。由于老年患者基础代谢较低,机体储备能力差,与药物代谢关系密切的肝肾功能不佳,从而使药物排泄能力下降,血药浓度偏高,因此在用药过程中需要充分把握药物的剂量,保证治疗的安全性。此外,老年器官组织对多数药物反应敏感,比年轻的患者更容易引起不良反应,药物的效应不仅与血药浓度有关,且与器官组织反应有关,在用药中需要注意过敏这一因素。
二、老年SCLC治疗
目前,局限期SCLC标准治疗为4~6个周期以铂类为基础的化疗联合胸部放疗,同步放化疗疗效优于序贯放化疗,获得临床缓解的患者,应继之以预防性颅脑放疗(PCI)。因为同步放化疗的潜在并发症,功能状态较差的老年患者应考虑序贯放化疗,≥70岁患者的数据显示该疗法神经毒性的发生率和严重度有潜在升高趋势。广泛期SCLC的标准治疗为以铂类为基础的联合化疗。手术在治疗中的具体地位尚未确定。早期病变在放、化疗后给予手术切除(Ⅰ~Ⅱ期)或者化疗合并外科手术和术后放、化疗对生理功能都有很大影响;因此仅有少部分患者会选择这种方式。
回顾性分析显示,与年轻患者相比,标准治疗对老年患者毒性更大。但是SCLC是一个化疗敏感的恶性肿瘤,因此给予单药化疗或减量的联合化疗并不是首选策略。Girling采用口服VP-16 50 mg,每天2次,连续10 d或给以标准联合化疗方案环磷酰胺+阿霉素+长春新碱(CAV)静脉注射,分别治疗了171例(中位年龄67岁)和168例(中位年龄68岁)SCLC患者,两组PS均≥2分,有效率分别为45%和51%,中位生存期(median survival term,MST)分别为130 d和183 d(P<0.05),3~4度中性粒细胞减少发生率分别为14%和12%,治疗相关病死率14%和10%。结果表明,治疗强度较弱的口服单药VP-16,无论在有效率、生存期,还是在不良反应方面均无优势。其主要原因在于对于肿瘤的控制强度较弱,而对化疗相对敏感的SCLC而言,必须首先将肿瘤控制之后,才能改善生活质量和延长生存期。
一般状况良好(PS=0~1)、没有严重伴发疾病的老年SCLC仅占10%~30%。对这些患者可以考虑给以标准的SCLC化疗方案,如卡铂和VP-16组成的CE方案以及由顺铂与VP-16组成的PE方案。由于卡铂的顺应性良好,尤其肾毒性、听力毒性和神经毒性的发生率较低,因此在老年SCLC患者的化疗中比DDP更为常用。一般而言,对老年SCLC采用CE方案的有效率为60%~80%,MST37~46周,3~4度中性粒细胞减少率13%~84%,毒性相关病死率2%~9%。有研究发现,对于一般状况良好的老年SCLC患者,给以足量化疗方案,同时预防性应用粒细胞集落刺激因子可获得良好治疗效果,而且不良反应可以控制,而调整剂量后由于剂量强度的降低,治疗效果较差,所以对PS 0~1的老年SCLC应将获得对肿瘤的良好控制作为优先考虑的目标。
临床Ⅱ期研究显示,对广泛期SCLC多西紫杉醇的有效率为23%,吉西他滨的有效率可达30%。Hainsworth等采用多西紫杉醇+吉西他滨每周应用方案,对广泛期、一般状况较差的老年SCLC患者进行了Ⅱ期临床观察。共40例,年龄>65岁,PS=2分。用药方案:吉西他滨800 mg/m2、多西紫杉醇30 mg/m2,每周1次,连用3周,每4周为1周期。结果33例可评估患者中仅27%出现部分缓解,全部40例患者的MST为4个月,1年生存率为14%。3~4度的骨髓毒性为16%。结论为该方案尽管具有相对良好的耐受性,但疗效较差,目前难以推荐作为SCLC尤其老年SCLC患者的有效方案。Okamoto等报道,卡铂联合伊立替康配合G-CSF支持的方案,具有良好的疗效而且毒性可以耐受。
Pignon等对13个中心的2 140例局限期SCLC患者的荟萃分析,比较了单一化疗与联合放化疗的疗效。结果表明,加用胸部放疗组病死率降低14%,3年生存率从单独化疗组的8.9%提高至14.3%,有统计学意义(P=0.001)。生存期方面的绝对提高随后维持了3~4年。但是在>70岁的患者中未观察到这一疗效。
目前,已有数项联合放化疗治疗老年局限期SCLC的临床试验,以评价强度减弱的治疗方案的疗效和毒性。该方案包括2周期化疗联合剂量减低的放疗,结果显示疗效和毒性均可接受。由于多手段综合治疗的5年生存率可达16%~17%,因此对老年患者推荐综合治疗是可取的,但同时需要注意,综合治疗所致的相关死亡率高达5%~10%。Auperin的meta分析显示,PCI(预防性颅脑放疗)可使3年生存率提高5.4%,并且这种提高与年龄无相关性。临床试验显示,PCI可潜在性的导致神经心理损害和颅脑CT扫描异常。因此,对老年患者尤其是既往存在神经认知障碍的患者,PCI的施行更应谨慎。
表3-29-1 老年局限期SCLC联合化疗联合放疗Ⅱ期试验
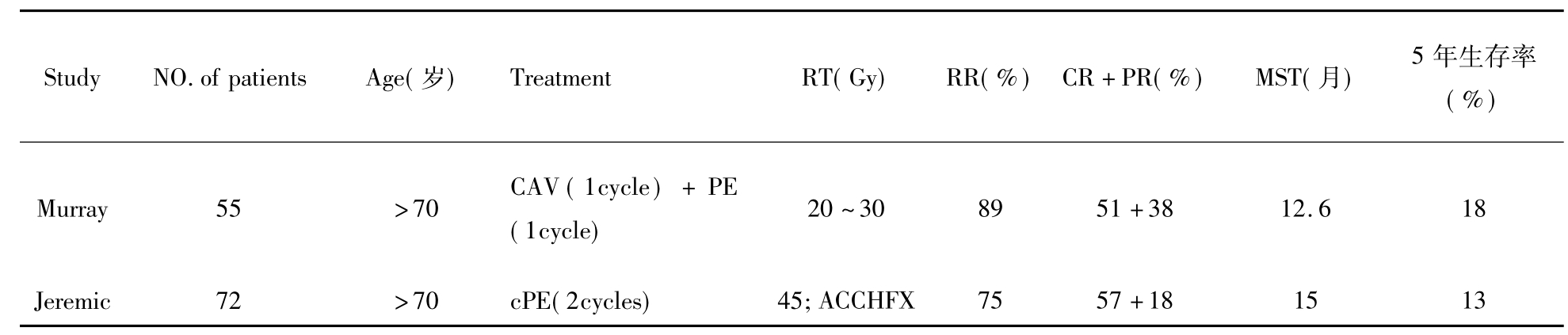
CAV:CTX+ADM+VCR;PE:DDP+VP-16;cPE:CBP+oral+VP-16;ACCHFX:accelerated hyperfractionated radiotherapy.
三、老年NSCLC治疗
(一)外科手术
在肿瘤能够切除和患者状态良好的情况下,外科手术是主要的治疗手段。其最适宜于Ⅰ~Ⅱ期和部分经过选择的ⅢA期NSCLC患者,其中Ⅰ期患者的5年生存率为70%~80%,Ⅱ期患者为50%~60%。
老年患者因常伴有冠心病、高血压、糖尿病、呼吸道等疾病,使剖胸手术风险增加,所以对老年NSCLC的手术治疗过去一直存在争议。随着监护、麻醉技术以及手术技巧的进步,老年人剖胸手术的死亡率明显下降。Bernet等对比年龄≤50岁和年龄≥70岁Ⅰ~ⅢA期NSCLC患者,手术总死亡率分别为2.2%和2.5%,肺叶切除术后的死亡率分别为2.6%和3.8%,5年生存率分别为56%和53%,均无统计学差异。目前认为,老年NSCLC肺切除手术危险性属可接受范围,单纯年龄因素不是老年NSCLC手术治疗的绝对禁忌证。老年NSCLC若不经手术治疗,1年生存率仅为7%。Bernet等报道老年NSCLC手术后5年生存率Ⅰ期达56%,ⅢA期为48%。因此,影响老年NSCLC患者寿命最重要因素是肿瘤而不是年龄。对于一般情况良好、无明显并发症的老年患者,可以耐受手术治疗,且手术后的长期生存与年轻患者相当。英国胸腔协会关于肺癌外科手术的指南中建议,所有的肺癌患者无论其年龄大小,都应该享受同样的治疗方案。
(二)放疗
放射治疗是治疗老年肺癌的有效手段,对于改善患者的生活质量、提高症状缓解率具有积极意义。然而,老年患者肺功能相对较差,且常合并慢性支气管炎、肺气肿等合并症,故对放疗的耐受性较差,进行放疗后易并发放射性肺炎及放射性肺纤维化。所以进行放疗时,应准确定位,防止放疗野过大,单次照射剂量和总剂量不宜过大,尤其对于合并COPD的患者则需更多慎重,有条件的患者尽量采用三维适形放疗(3-Dimen-sional conformal radiation therapy,3D CRT)。
目前,针对老年NSCLC放疗的临床研究甚少。Schild等比较了单纯放疗与放化疗同步治疗老年NSCLC的情况,结果显示接受放化疗同步治疗的老年患者其生存期较放疗组患者有所延长,但毒性明显增加。由于本研究中入选病例主要为老年Ⅲ期NSCLC患者(年龄≥65岁),其治疗强度相对较大,但由此可知老年晚期NSCLC患者接受局部放疗可能对于延长其生存期有一定作用。其条件是对于一般状况较好的老年患者,在充分权衡其疗效与毒性的基础上,才可考虑给予放化疗同步治疗。Semrau等报道了对66例不宜手术的老年NSCLC患者(中位年龄68岁)给予局部常规分割放疗加长春瑞滨与卡铂或顺铂两药联合治疗的研究结果,总有效率为74%,患者1、2、5年生存率分别为53%、24%、8%,其毒性反应为Ⅲ度、Ⅳ度血小板减少(27%)及白细胞减少(42%),26%的患者曾接受输血治疗以纠正贫血,其余不良反应主要为Ⅲ度及Ⅳ度食管炎(5%)、Ⅲ度放射性肺炎(3%)等。遗憾的是本研究并未对患者的分期情况进行分析,另外虽疗效较好,但其治疗不良反应相对较重,所以对于老年晚期NSCLC患者应慎重选择。
(三)化疗
1.新辅助化疗 目前,尚无专为老年性NSCLC新辅助化疗设计的随机试验。法国的一项针对一般人群的随机试验显示在Ⅰ、Ⅱ和ⅢA期NSCLC,术前化疗(丝裂霉素、异环磷酰胺和顺铂)组3、5年生存率比单纯手术组提高了9%~10%,但无统计学意义(P=0.09)。S9900试验是迄今为止评价早期NSCLC新辅助化疗疗效的最大的随机试验之一,超过350例在无进展生存期和总生存期方面受益,由于新辅助化疗所表现出的明显受益使该实验提早结束。术前化疗通常比术后化疗更为安全,因此新辅助化疗可能更适于老年患者,但是对年轻患者可行的新辅助化疗方案能否用于老年人必须经过大规模临床试验检验。
2.单药化疗治疗老年晚期NSCLC 首个专门针对老年晚期NSCLC患者的多中心Ⅲ期随机对照研究是1999年由意大利老年肺癌治疗组进行的ELVIS试验(Elderly Lung Cancer Vinorelbine Italian Study)。研究共计入组191例晚期NSCLC患者(年龄≥70岁),结果显示接受单药长春瑞滨(Vinorelbine,NVB)治疗的患者其生活质量优于最佳支持治疗组,且生存获益(中位生存期分别为28、21周,P=0.03),用药组1年生存率为32%,显著优于支持治疗组的14%。故此认为单药化疗目前是老年晚期NSCLC的标准治疗。
MILES试验是迄今最大的一项针对老年晚期NSCLC的多中心Ⅲ期临床研究,共计入组698例患者。结果显示吉西他滨与长春瑞宾联合治疗组与两单药治疗组相比,客观缓解率(ORR)、肿瘤进展时间(TTP)、中位生存期(MST)及患者生活质量均未显示出优势,且联合用药组其毒性要高于两单药治疗组。由此提示,对于老年晚期NSCLC治疗,单药方案要优于两药联合方案。依据上述两个Ⅲ期临床试验结果,目前较一致认为第三代药物单药化疗是治疗老年晚期NSCLC的合适选择,美国临床肿瘤协会的治疗指南也推荐这种治疗选择。
但是单药化疗哪种药物效果最好,该如何进行选择? 2006年ASCO年会上,Kudoh等报告了其进行的一项Ⅲ期随机对照临床试验(WJTOG9904)研究结果,此项研究比较了多西紫杉醇(DOC)与长春瑞滨(NVB)治疗老年晚期NSCLC的疗效及毒性等,共计入组182例患者。结果显示两组患者中位生存期无明显差异(DOC 14.3个月,NVB 9.9个月;P=0.138),但DOC组的无病生存期(DOC 5.5个月,NVB 3.1个月,P<0.001)、有效率(DOC 22.7%,NVB 9.9%,P=0.019)及一年生存率(DOC 58.6%,NVB 36.7%)均较NVB组好,且患者的疾病相关症状缓解程度同样要优于NVB组。来自意大利的一篇评论文章在评价该项研究时指出,这是第一个前瞻性随机的Ⅲ期临床研究,结果证明在老年晚期NSCLC中一种单药优于另一种单药。但研究中有几个问题值得注意:①标本量太小,以至于两组在中位生存期方面无显著差异;②与文献相比,两组的中位生存时间均较高;③NVB组有较高的中性粒细胞减少;④DOC组中较多的患者接受了二线Iressa治疗(DOC组37.5%,NVB组20.0%),这一点对生存的影响非常重要。但是哪种单药治疗效果更好,仍需大规模的临床试验来证实。鉴于这些第三代药物有相似的活性和疗效,医师在选择时可对应考虑其他问题,如药物的毒性、药物代谢、患者脏器功能及伴发疾病等。今后应设计专门针对老年群体的临床试验,尤其界定患者生物学和实际年龄的工具和方法应在试验中有所体现。
3.非铂类药物联合治疗老年晚期NSCLC 尽管单药治疗可能更适合于老年患者,而且其作为老年NSCLC的一种合理治疗手段被美国临床肿瘤学会所认可,但并非绝对否定非铂类药物间的两药联合方案。Comella等研究了不同治疗方案对患者生存及生活质量的影响,有264例PS相对较差的患者入组,分别给予吉西他滨单药、紫杉醇单药、吉西他滨联合紫杉醇或长春瑞滨联合四种化疗方案。结果显示,联合化疗组患者的中位生存期为9个月,而单药治疗组仅为4个月,而且联合化疗无显著的毒性反应。虽然此研究并非针对老年患者,但由此可以推论对于身体一般状况较好的老年患者其接受两药联合方案化疗也许会从中获益。非铂类药物联合与单药化疗相比,有效率较高,但生存优势的结论还需更多大规模的Ⅲ期临床验证。
4.含铂方案治疗老年晚期NSCLC 铂类是晚期NSCLC一线化疗的基本药物,但由于其较严重的胃肠道反应、肾毒性、中枢神经系统毒性以及治疗时需要水化,由此成为老年患者应用的最大障碍。老年晚期NSCLC患者能否从含铂方案化疗中受益,应由专门针对老年患者所设计的临床试验来验证,然而至今此类研究相对匮乏。目前支持以含铂方案治疗老年晚期NSCLC的证据,仅来源于若干随机临床试验中对老年亚组的回顾性分析,各试验结果基本一致。即老年患者接受含铂方案化疗其客观有效率(ORR)、中位生存期(MST)及药物的毒副反应等与年轻患者相近,然而需要指出的是此类研究中老年患者所占比例较低,均<20%。就铂类药物而言,因顺铂毒性相对较大,老年患者耐受性差,对其接受含顺铂方案化疗目前虽有争议。但无论从个体临床治疗选择还是群体临床研究来讲,治疗老年晚期NSCLC选择卡铂作为含铂方案显示出了更甚趋势。2007年ASCO年会收编的几项以卡铂为基础联合化疗的Ⅱ期临床研究中对卡铂的剂量有所调整,即适当降低用药量或采用每周给药方案,结果提示卡铂联合方案疗效及患者耐受性均较好。二线化疗:JMEI研究的回顾性分析显示,老年与较年轻患者在接受培美曲塞和多烯紫杉醇二线治疗时结果相似,包括毒性与疗效;提示老年患者当PS好时,可以耐受二线化疗。培美曲塞毒性反应方式优于多西紫杉醇;多西紫杉醇的周疗方案可能在不影响疗效的情况下,降低不良反应。
(四)分子靶向治疗
分子靶向治疗是晚期NSCLC的热点治疗,目前已上市的吉非替尼(Gifitibib,Iressa)和厄罗替尼(Erlotinib,Tarceva)是选择性的表皮生长因子受体酪氨酸激酶抑制剂,已被用于晚期NSCLC的二、三线治疗。由于其独特的作用机制,较好的疗效和生活质量以及较低的副作用,其在老年晚期NSCLC和PS较差的患者治疗中具备选择优势。
若干研究的亚组分析表明,吉非替尼单药治疗老年晚期NSCLC疗效及患者耐受性较好。国内一项30例老年晚期NSCLC患者接受吉非替尼单药治疗结果显示,客观缓解率为33.3%,疾病控制率达66.6%,患者中位生存期为17.0个月;另一项国内同类研究入组了63例患者,其结果与此相近,疾病控制率及1年生存率分别为81.0%和53%,患者中位生存期为15.3个月。厄罗替尼在治疗老年晚期NSCLC方面同样显示出其治疗优势。2007年ASCO会议报告了一项埃罗替尼一线治疗老年晚期NSCLC的Ⅱ期临床试验结果,共计80例患者入组(年龄≥70岁)。结果显示,51%的患者临床获益,1年生存率达46%,2年生存率为19%,提示厄罗替尼单药一线治疗从未接受过化疗的老年晚期NSCLC患者有效且耐受性好。
(五)支持治疗
支持治疗在老年肺癌患者治疗中占有重要地位,疾病相关症状能经放疗、化疗或联合化放疗有效缓解。疼痛、抑郁、恶心、体重下降以及便秘等症状通过医学干预可得到改善。除贫血改善可提高生活质量外,目前正在研究血红蛋白对于肺癌患者生存期的影响,这在Ⅲ期患者中尤为相关。在选择最好的抗肿瘤治疗的同时,在老年患者的治疗中不能否定支持治疗的作用。
(六)老年肺癌临床试验的必要性
在对各种NSCLC的试验文献分析时,不难看出缺少专门用于老年人的试验。最近几年的临床试验,老年人和其他年龄组的一起进入,对此有很不一致的意见,因为不同条件的人混在一起,导致庞杂的研究人数和无法解释的研究结果。老年患者具有与生理年龄相关的特征,专门为老年人设计试验课题是临床医生的需要。现在我们每一个肿瘤内科医生,在每一天的工作中都有可能面对老年NSCLC患者,我们的临床决断需要强有力的临床实验数据来支持。2004年6月28日,在美国癌症临床试验协会已有30个Ⅱ~Ⅲ期临床试验注册登记,其中有2个是专门为老年NSCLC设计的。
在现有证据情况下,第三代化疗药的单药治疗应重新推荐给老年NSCLC患者,这与最近美国临床内科学会对老年晚期NSCLC治疗指南是一致的,但从上述观点出发,老年患者用第三代化疗药的单药治疗也应与单用最佳支持治疗进行随机试验;以铂类为基础的联合化疗推荐给合适的老年患者是有一定根据的,但这些患者要有足够好的器官功能,临床随机试验也应进行。
总之,从年轻肺癌患者所获得的临床资料不能想当然的外推到老年患者。与年轻患者相比,老年患者有更多的伴随疾病,因此对强度较大的化疗和放疗耐受性更差。目前,所获得的多数数据是基于既往的年龄非特异的临床试验的回顾性分析。这些年龄非特异性的临床试验在入组病例的选择上不可避免的存在选择偏倚,即倾向于选择一般状况好的老年患者入组。因此,将这些回顾性分析所获得的结论外推到一般的老年性患者时需特别谨慎。所以,必须进行专为老年患者设计的前瞻性试验,才能为老年肺癌患者的治疗提供依据。目前,相关的前瞻性数据仅见于晚期NSCLC。老年肺癌患者的治疗存在两种风险:一是经验主义导致的治疗不足,由此导致治疗效果差,生存期缩短;一是标准治疗方案导致的毒性反应过重,难以耐受。因此,急需Ⅲ期随机试验来规范老年肺癌的治疗。
(王明玉)
1.Stephens RJ,Johnson DH1.Treatment and outcoms for elderly patientswith small cell lung cancer[J].DrugsAging,2000,17(3):229-247.
2.Kurishima K,Satoh H,Ishikawa H,et al.Lung cancer patients with chronic obstructive pulmonary diseases[J].Oncol Rep,2001,8(1):632-651.
3.Kurishima K,Satoh H,Ishikawa H,et al.Lung cancer patients with caridoand cerebrovascular diseases[J].Oncol Rep,2001,8(6):1 251-1 253.
4.Bernet F,Brodbeck R,Guenin MO,et al.Age does not influence early and late tumor-related outcome for bronchogenic carcinoma[J].Ann Thorac Surg,2000,69(3):913-918.
5.Depierre A,Milleron B,Moro-Sibilot D,et al.Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stageⅠ(except T1N0),Ⅱ,and IIIa non-small-cell lung cancer[J].J Clin Oncol,2002,20:247-253.
6.Pisters K,Vallieres E,Bunn P,et al.S9900:A phaseⅢtrial of surgery alone or surgery plus preoperative paclitaxel/carboplatin chemotherapy in early stage non-small cell lung cancer-Preliminary results[J].J Clin Oncol,2005,23:1095.
7.Furuse K,Fukuoka M,Kawahara M,et al.PhaseⅢstudy of concurrent versus sequential thoracic radiotherapy in combination with mitomycin,vindesine,and cisplatin in unresectable stageⅢnon-small cell lung cancer[J].J Clin Oncol,1999,17:2 692-2 699.
8.Curran WJ Jr,Scott CB,Langer CJ,et al.Long-term benefit is observed in a phaseⅢcomparison of sequential vs concurrent chemo-radiation for patients with unresected stageⅢNSCLC:RTOG9410[J].Proc Am Soc Clin Oncol,2003,22:621.
9.Camps C,Artal A,Gomez-Codina J,et al.Age as a prognostic factor in small cell lung cancer(SCLC):Randomized trial of high-dose epirubicin-cisplatin(HDEP)versus etoposide-cisplatin in SCLC-A retrospective analysis[J].Proc Am Soc Clin Oncol,2001,20:280.
10.Carney DN,Grogan L,Smit EF,et al.Single agent oral etoposide for elderly small cell lung caner patient s[J].Semin Oncol,1990,17(suppl 2):49-53.
11.Souhami RL,Spiro SG,Rudd RM,et al.Five-day oral etoposide treatment for advanced small cell lung cancer:randomized comparison with intravenous chemotherapy[J].J Natl Cancer Inst,1997,89(8):577-580.
12.Honecker F,Wedding U,Bokemeyer C,et al.Chemotherapy in elderly patient s with advanced lung cancer.Part I:General aspects and treatment of small cell lung cancer(SCLC)[J].Onkologie,2004,27(5):500-505.
13.Larive S,Bombaron P,Riou R,et al.Carboplatin-etoposide combination in small cell lung cancer patients older than 70 years:A phaseⅡtrial[J].Lung Cancer,2002,35:1-7.
14.Hesketh PJ,Crowley JJ,Burris HA,et al.Evaluation of docetaxel in previously untreated extensive-stage small cell lung cancer.a Southwest Oncology Group PhaseⅡtrial Cancer[J].J Sci Am,1999,5(4):237-241.
15.Eisenhauer E,Gregg R,Ayoub J,et al.Gemcitabine:an active new agent in patients with previously untreated small cell lung cancer:a PhaseⅡtrial of the NCI Canada Clinical Trials Group[J].Proc Am Soc Clin Oncol,1993,12:330.
16.Hainsworth JD,Carrell D,Drengler RL,et al.Weekly combination chemotherapy with docetaxel and gemcitabine as first line treatment for elderly patients and patients with poor performance status who have extensive stage small cell lung carcinoma[J].Cancer,2004,100(11):2 437-2 441.
17.Okamoto H,Naoki K,Narita Y,et al.A combination chemotherapy of carboplatin and irinotecan with granulocyte colony-stimulating factor(G-CSF)support in elderly patients with small cell lung cancer.Lung Cancer,2003,53:197-203.
18.Okamoto H,Watanabe K,Kunikane H,et al.Randomized phaseⅢtrial of carboplatin(C)plus etoposide(E)vs.split doses of cisplatin(P)plus etoposide(E)in elderly or poor-risk patients with extensive disease small cell lung cancer(ED-SCLC):JCOG9702[J].J Clin Oncol,2005,23:623.
19.Pignon JP,Arriagada R,Ihde DC,et al.A meta-analysis of thoracic radiotherapy for small-celllung cancer[J].N Engl J Med,1992,327:1 618-1 624.
20.Youen AR,Zou G,Turrisi AT,et al.Similar outcome of elderly patients in intergroup trial 0096:Cisplatin,etoposide,and thoracic radiotherapy administered once or twice daily in limited stage small cell lung carcinoma[J].Cancer,2000,89:1 953-1 960.
21.Schild SE,Stella PJ,Brooks BJ,et al.Results of combined-modality therapy for limited-stage small cell lung carcinoma in the elderly[J].Cancer,2005,103:2 349-2 354.
22.Murray N,Gratt C,Shah A,et al.Abbreviated treatment for elderly,infirm or noncompliant patients with limited-stage small-cell lung cancer[J].J Clin Oncol 1998,16:3 323-3 328.
23.Jeremic B,Shibamoto Y,Acimovic L,et al.Carboplatin,etoposide and accelerated hyperfractionated radiotherapy for elderly patients with limited small lung carcinoma[J].Cancer,1998,82:836-841.
24.Auperin A,Arriagada R,Pignon JP,et al.Prophylactic cranial irradiation for patients with small-cell lung cancer in complete remission[J].N Engl J Med,1999,341:476-484.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















