原子核结构的建立
在介绍原子核结构之前,我们先来了解一下原子核之父的英国科学家卢瑟福(1871-1939年),是开辟科学新时代的少数几个人之一。1899年,28岁的卢瑟福发现了放射性元素“钍”和新型放射线;1902年他又发现一种原子可以蜕变为另一种原子,否定了原子永远不变的旧观念,荣获1908年诺贝尔化学奖。
1911年,卢瑟福根据α粒子的散射实验(被称为卢瑟福实验),提出了一个类似太阳系结构的原子模型;原子中央是一个带有正电荷的硬核,所有带负电的电子围绕着这个硬核旋转,就像行星绕着太阳转一样。这一理论极大地推动了对原子结构的认识,为后来深入探讨原子结构奠定了基础。
1919年,卢瑟福用放射性元素钋的α粒子轰击氮原子,获得了氮的同位素,第一次实现了元素的人工嬗变。1920年,他还预言中子的存在,认为原子核内部存在某些不带电的粒子,很容易打入原子核内,或者和原子核结合起来,或者在它的强大场内蜕变。12年后,这种中子果然被人们发现,成为轰击原子核的最佳“炮弹”,为原子核链式反应、释放原子能提供了条件。
卢瑟福不仅在科学上作出了重大贡献,还培养了11名诺贝尔奖获得者,是世界上培养诺贝尔奖获得者最多的导师。
卢瑟福也有失误的时候。他曾断言:“就释放能量来说,用原子核来做实验,可以说纯属浪费。”然而就在他死后两年,第一个裂变反应堆在美国建成,这标志着原子能时代的到来。卢瑟福低估了他的发现的作用,但人类永远怀念他。
一、原子的组成
1.组成原子的粒子间的关系可以表示如下:
(1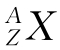 的含义
的含义
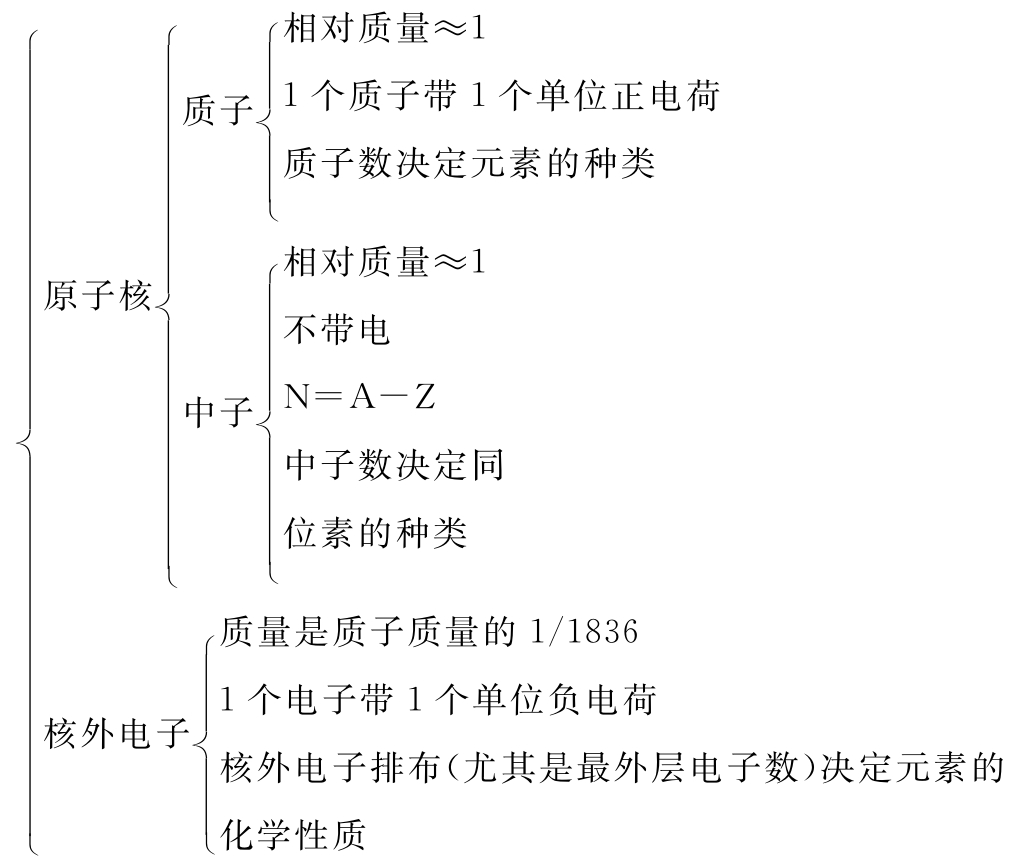
代表一个质量数为A、质子数为Z的原子。
(2)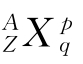 中各个字母的含义
中各个字母的含义
A:质量数;Z:质子数;q:原子个数;p:原子的电荷数。
(3)电性关系
原 子:核电荷数(Z)=核内质子数=核外电子数
阳离子:核电荷数(Z)=核内质子数>核外电子数
核电荷数(Z)=核内质子数+电荷数
阴离子:核电荷数(Z)=核内质子数核外电子数
核电荷数(Z)=核内质子数-电荷数
质子数决定元素的种类;中子数决定元素的同位素。
(4)质量关系
质量数(A)=质子数(Z)+中子数(N)
例1.有aXn-和bYm+两种离子,其电子层结构相同,下列关系式或化学式正确的是( )
A.a-n=b+m B.a+m=b-n
C.氧化物为YOm D.氢化物为HnX或XHn
答案:B
例2.元素 核素 同位素
(1)元素:具有相同核电荷数(即质子数)的一类原子的总称。现在已知有112种元素。
(2)核素:具有一定数目的质子和一定数目的中子的一种原子。
例如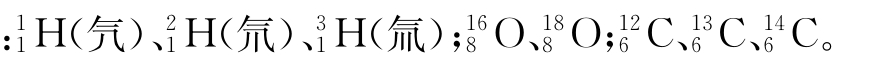
①单一核素元素:Be、Na、P和Al等20多种元素,只存在单一的核素,称为单一核素元素;
②多核素元素:具有多种核素的元素,称为多核素元素。
(3)同位素:质子数相同而中子数不同的同一元素的不同种原子,互称同位素;或同一元素的不同核素之间互称同位素。
综合上述,可有以下结论两同:同质子数,同一元素;两不同:中子数不同,原子不同。
例如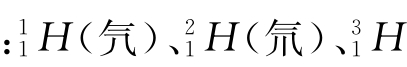 (氚)是氢元素的三种核素,互为同位素
(氚)是氢元素的三种核素,互为同位素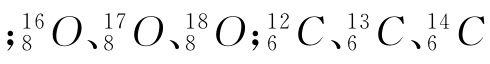 等互为同位素。
等互为同位素。
同种元素的不同核素,质子数相同,在周期表中占同一位置,即同位素。同位素可分为两类:一类是稳定同位素;另一类是放射性同位素。
同位素的特点是天然存在的元素,各同位素在自然界的含量占该元素总量的百分比(称为“丰度”,即原子百分比)基本上是固定的。
同种元素,可以有若干种不同的核素。(元素:112种,同位素:1800种)
同位素是同一元素的不同核素之间的互相称谓,不指具体的原子。
同一种元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物化学性质几乎相同,只是某些物理性质略有差异。同位素构成的化合物是不同的化合物,H2O、D2O、T2O的物理性质不同,化学性质几乎相同。
(4)元素的相对原子质量。
原子质量是指原子的真实质量,也称绝对质量,是经过精密的实验测得的。

近似相对原子质量是指元素的天然同位素的质量数。
同位素相对原子质量是即同位素原子的相对原子质量。例如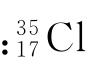 为34.969
为34.969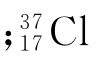 为36.966。
为36.966。
元素相对原子质量(平均相对原子质量)是指该元素各种天然同位素(稳定)原子所占原子个数的百分比(丰度)与各种同位素原子相对原子质量乘积的和,即:
某元素相对原子质量=A×a%+B×b%+……
元素近似相对原子质量是指元素的各种天然同位素的质量数与其丰度乘积之和。
例如:氯元素在自然界有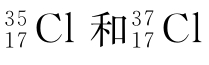 这两种同位素,根据以下数据计算上述各量。
这两种同位素,根据以下数据计算上述各量。

二、原子核外电子的运动状态
(一)原子核模型
1803年,英国科学家道尔顿提出:原子是组成物质的基本的粒子,他们是坚实的、不可再分的实心球。
在19世纪末,放射性元素逐一被发现,它们裂变的事实冲破了原子不能再分的传统观念。1897年英国科学家汤姆逊(1856-1940年)发现原子里有带负电荷的电子。这一切激励着科学家们去探索原子的内在结构。
1904年,英国科学家汤姆逊首先提出葡萄干面包原子模型。他认为既然电子那么小,又那么轻,因此原子带正电部分充斥整个原子,而很小很轻的电子浸泡在正电的气氛中,这正像葡萄干嵌在面包中那样。电子带的负电荷被原子内带正电荷部分抵消,因此原子是电中性的。汤姆逊的原子模型能解释原子是电中性的,还能估计原子半径约为100pm(10-10m),因此它风行10多年,以后意外地被汤姆逊的学生卢瑟福推翻。
卢瑟福(1897-1937年)和盖革(1882-1945年)1911年用α粒子轰击金属箔,并用荧光屏记录粒子散射现象的情况。他发现大部分α粒子按直线透过金属箔,只有极少一部分α粒子被反弹回来或偏转很大角度。这个实验充分说明原子内有很大空间,而正电荷部分集中在原子中心极小的球体内,但却占原子质量的99%以上。因此,他断定汤姆逊的葡萄干面包的原子模型不符实际,同时他果断地提出新的原子模型。1912年,卢瑟福联系太阳系中行星绕太阳旋转情况提出新的原子模型是带正电的原子核在原子正中,占原子质量的绝大部分,正像太阳系中太阳那样;带负电的电子环绕原子核作高速运动。按这个模型可估计原子直径是100pm,电子直径是1fm,原子核直径是0.1~10fm,原子内部有很大空间。
虽然这个模型能成功地解释一些现象,但是它立即遭到全世界大多数科学家反对。因为据经典物理理论,任何作加速运动的电荷都要辐射电磁波,这必然引起两种后果:第一,不断辐射能量,电子将沿螺旋线渐渐趋近原子核,最后落到核上而毁灭。第二,电子不停地、连续地辐射电磁波,电磁波的波长会发生连续的变化;因此,所有的原子都应发射连续光谱。然而事实绝非如此,首先,从未发生过原子毁灭的现象。说明电子不会落到原子核上去。其次,原子在正常情况下不辐射电磁波。即使气体或蒸汽被火焰,或其他方法灼热时有电磁波辐射,但这种辐射通过三棱镜后得到的是线光谱,而不是连续光谱。这些事实使卢瑟福也不知怎样来解释。
正当卢瑟福无计可施时,刚巧来了一位年轻丹麦化学家玻尔(1885-1962年),他坚决支持卢瑟福的新模型,并且引进崭新的量子学说,为原子结构理论谱写出光辉的一页。玻尔理论的要点是:
第一,卢瑟福的新模型是正确的,问题是应指出原子中电子环绕原子核作高速运动时,只能在特定轨道上运动,电子在这样的轨道上运动时不辐射能量。这时电子所处的状态叫基态。
第二,当电子从离核较远的轨道跳到离核较近轨道时,原子放出能量,并以电磁波的形式辐射出来,辐射能量的大小决定于电子跳跃前后两个轨道的半径。由于轨道是不连续的,因此发射的能量也是不连续的。
从上述两点出发,首先揭开氢原子光谱之谜,成功地使巴尔麦(1825-1898年)公式得到完满解释,还轻而易举地算出原子半径。

玻尔理论作为物理和化学一场革命而载入史册。然而,波尔没有认识到宏观物体与微观粒子的本质区别。他的理论还是建立在牛顿力学的基础上的,因此在解释多原子光谱时遇到不可克服的困难。这意味着必须建立新的理论体系。
正当波尔致力于研究电子在原子中的运动状态时,英国卢瑟福及其学生查德威克(1891-1974年)进一步揭开原子核的秘密。
1919年,卢瑟福用α粒子轰击氮核,首次发现质子。
![]()
由此知道原子核中存在质子。他根据该原子质量,提出还存在中子的假说,并预言中子呈电中性,周围不形成电场,不会使周围粒子带电,它的穿透力比α粒子强。
1930年卢瑟福的学生查德威克在卡文迪许实验室用α粒子轰击石蜡时,捕捉到不显电性的中子。至此,原子的构成基本清楚。原子核由带正电的质子和不显电性的中子组成,带负电的电子环绕核作高速运动。
1924年法国科学家德布罗意(de Broglie,1892-1960年)发现微观世界的微粒在不同条件下分别表现为波动和粒子的性质,即有波粒二象性。这一发现表明过去人们在研究微观粒子的运动规律时忽略波动性一面,因而得出的结果不能真实地反映微观粒子的运动规律。纠正了这一偏向后,人们的研究取得很大的成功。其中尤其突出的是薛定谔,他建立波动方程(后来人称薛定谔方程)。在此基础上,迅速发展一门新的学科——量子力学。这是现代研究原子、分子结构的理论基础。
总之,从19世纪末到今天,人们已建立起一整套描述原子内在结构的理论和方法,使化学迅速进入微观领域的研究。
(二)核外电子的运动状态
1.核外电子运动特点
(1)核外电子质量小,体积小,运动空间小;
(2)核外电子运动速率极高(接近光速);
(3)不能准确测定电子在某时刻所处的位置,也无法描述其运动轨迹。

图3 电子的衍射图
2.电子云
电子云是表示电子在核外空间某处出现机会多少的一种形象模型。
在电子衍射实验中,单个电子穿过晶体打到屏幕上,它的落点是不确定的,只能说打中某一点的可能性有多少,但观察组成电子束的所有电子的运动情况,我们发现电子的运动表现出一定的规律。由图(金的电子衍射图像)可见,电子衍射图像是一组明暗交替的同心环,明处表示打到那里的电子多,暗处表示打到那里的电子少。即明亮处是电子出现机会多的地方,暗处是电子出现机会少的地方,机会的多少在数学上叫“概率”。我们在描述核外电子运动时,只能指出它在原子核外空间某处出现的概率大小。电子在核外一定的空间范围内出现,好像带负电的云雾笼罩在原子核的周围,所以,我们形象地称它为“电子云”。
上图表示氢原子的电子云示意图。图中小黑点密度大的地方表示单位体积内电子出现的概率大;小黑点密度小的地方表示单位体积内电子出现的概率小。单位体积内电子出现的概率称为概率密度。
电子云就是用小黑点疏密来表示空间各点概率密度大小的一种图形。
电子云:①表示电子在核外空间某处出现的机会,不代表电子的运动轨迹;②小黑点的疏密表示出现机会的多少。密,机会大;疏,机会小。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














