原子核外电子的分层结构
原子核外电子的排布情况,对于元素的化学性质起着决定性的影响。以原子序数分别为9、10和11的氟、氖和钠元素为例,由于它们原子的最外层电子数分别是7、8和1,因此分别表现出活泼的非金属性、化学惰性及活泼金属性。
那么,对于含有多个电子的原子,这些电子都表现出怎样的运动状态呢?有没有什么规律可循呢?实验测定表明,这些电子能量不等,能量低者,主要在离核较近的区域里运动;能量高者,主要在离核较远的区域里运动。以碳原子为例,核外共有6个电子,其中有4个电子,外界仅给较少的能量,就可使这些电子脱离原子,而另2个电子,则需大得多的能量,才能使它们脱离原子,这就说明碳原子中有4个电子能量较高,2个电子能量较低。现代的实验技术还可测出,碳原子中的6个电子的空间分布为2层,其中4个电子在外层,2个电子在内层。用量子力学的理论来处理多电子原子,同样会得到原子核外电子能量不等、分层排布的结论。解多电子原子的薛定谔方程,可以得到多个描述单个电子空间运动的函数,即“原子轨道”,每个原子轨道有相应的能量、电子云及沿核不同距离处电子出现的几率。这里需要对原子轨道的概念有一个正确的理解,原子轨道描述的是原子中电子的空间运动状态,但不是电子的运动轨迹,更不是原子的运动轨迹。为了避免产生误解,有人建议称这些函数为“原子轨函”,但本书中仍旧用原子轨道这一名称。解薛定谔方程所得到的结论与实验所得的核外电子分层排布的结论是一致的。
从一些实验又发现,原子核外的电子除空间运动外,还有另一种奇特的运动,称作电子的“自旋”。但你不要错误地推测,与地球的“公转”和“自转”一样,电子的自旋也是绕电子自身的某个轴自转。其实我们对电子的自旋运动还知之甚少,仅知它有两种自旋运动形式,我们就分别称它们为“顺旋”和“逆旋”吧。
原子核外的电子层,按距核由近到远的顺序,分别叫第一层、第二层、……、第七层,或称之为K、L、M、N、O、P、Q层。从量子力学处理的结果知,每一层所含的原子轨道数为n2个,如第一层仅1个原子轨道,第二层有4个原子轨道,第三层有9个原子轨道等。对于处在同一层的原子轨道中的电子能量相近,但较精细的研究表明,同一层的原子轨道又可分成一个或几个亚层,不同亚层间的能量差别很小,按能量由低到高的顺序,分别用s、p、d、f等符号来表示这些亚层。如第一层仅有1个原子轨道,用1s表示这个原子轨道;第二共有4个原子轨道,其中有1个2s轨道和3个2p轨道;第三层共有9个原子轨道,其中有1个3s轨道、3个3p轨道和5个3d轨道等。
原子核外电子在各层中的分布有一定的规律可循。第一条规律叫做利不相容原理,其内容可通俗地理解为处在同一原子轨道中的电子如果自旋方向相同时,则彼此间排斥作用极大,因此在同一原子轨道中不能相容。因电子仅具有两种自旋状态,所以每个原子轨道中最多只能容纳2个电子,且自旋方向相反。由这一规律自然得出每个电子层最多只能容纳2n2个电子。第二条规律叫能量最低原理,即通常状况下电子总是尽先占据能量低的原子轨道,在不违背泡利原理的前提下,按照能量由低到高的顺序填入原子轨道。如前面谈到的碳原子,第一层有2个电子,第二层有4个电子,其中2个电子为2s电子,另2个为2p电子,整个碳原子的电子排布可以写成1s22s22p2。对于钾原子,核外共19个电子,第一层、第二层共填入10个电子,第三层的s亚层和p亚层又填八8个电子,但最后1个电子填入的不是3d轨道,而是第四层的4s轨道。因经研究表明,对于钾原子,其4s轨道的能量比3d轨道的能量还低。这种外层中的某些亚层比相邻内层的某些亚层能量还低的现象叫做“能级交错”。正是由于能级交错,受能量最低原理的支配,才使原子核外的电子排布,最外层最多不超过8个电子。与之类似,次外层和倒数第三层的电子数最多为18和32个。作为能量最低原理的一个推论,从光谱实验中发现:“在同一亚层中的电子,总是尽可能分占亚层内不同的原子轨道,且自旋方向相同。”因这种排布方式可使自旋方向相同的电子彼此远离,排斥减弱,从而使原子的能量低,这个规律叫洪特规则。以氮原子在稳定的能量状态下的电子排布为例,可表示为 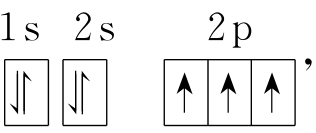 排布在2p亚层中的3个电子,分占了3个2p原子轨道,且彼此自旋方向相同。上面讲的原子核外电子的排布规则,是原子核外电子排布时起支配作用的本质原因,由此推出的对各个电子层中填充电子个数的限制,与中学化学课本中讲述的完全一致,但这3条规则是对于原子核外电子排布的更本质的揭示。
排布在2p亚层中的3个电子,分占了3个2p原子轨道,且彼此自旋方向相同。上面讲的原子核外电子的排布规则,是原子核外电子排布时起支配作用的本质原因,由此推出的对各个电子层中填充电子个数的限制,与中学化学课本中讲述的完全一致,但这3条规则是对于原子核外电子排布的更本质的揭示。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















