7.4.1 甲藻Fe-SOD的前导序列与在多细胞器中的定向转运分析
活性氧中间体(ROS)如 ,HO·以及H2O2是氧化代谢的正常副产物。尽管一些ROS可能是重要的信号分子,但是大多ROS是有毒的,能够引起DNA、蛋白质和脂质的严重损伤。为了减少ROS的损伤,需氧细胞逐渐形成了两种抗氧剂防卫系统:非酶促和酶促体系。前者的主要成分是维生素A和C、谷胱甘肽、类黄酮、生物碱和类胡萝卜素;后者主要是酶,如过氧化氢酶、超氧化物歧化酶和过氧化物酶。ROS的第一道防线是SODs,这些酶催化
,HO·以及H2O2是氧化代谢的正常副产物。尽管一些ROS可能是重要的信号分子,但是大多ROS是有毒的,能够引起DNA、蛋白质和脂质的严重损伤。为了减少ROS的损伤,需氧细胞逐渐形成了两种抗氧剂防卫系统:非酶促和酶促体系。前者的主要成分是维生素A和C、谷胱甘肽、类黄酮、生物碱和类胡萝卜素;后者主要是酶,如过氧化氢酶、超氧化物歧化酶和过氧化物酶。ROS的第一道防线是SODs,这些酶催化 歧化成H2O2和O2。主要有三种SOD,在其活性位点上,第一类SOD主要利用Cu和Zn,第二类主要利用Mn,第三类主要利用Fe。Cu,Zn-SODs主要发现在细胞溶胶和细胞核中,Mn-SODs是线粒体的特性,而Fe-SODs主要位于质体。用缺乏SOD的突变体进行实验证明了在好氧环境中,对于所有类型细胞的正常功能,这些酶都是必需的。
歧化成H2O2和O2。主要有三种SOD,在其活性位点上,第一类SOD主要利用Cu和Zn,第二类主要利用Mn,第三类主要利用Fe。Cu,Zn-SODs主要发现在细胞溶胶和细胞核中,Mn-SODs是线粒体的特性,而Fe-SODs主要位于质体。用缺乏SOD的突变体进行实验证明了在好氧环境中,对于所有类型细胞的正常功能,这些酶都是必需的。
在真核细胞中,ROS大多由线粒体、质体和过氧化物酶体产生。尽管每个器官都有自己的抗氧化系统,但是系统的许多组成都是相同的,因此有理由认为至少一些抗氧剂酶是由单基因编码,但是能定向到两个或三个ROS产生器官。酵母的过氧化氢酶A就是这种酶的一个很好的例子。这种蛋白含有两种引导信号,其允许蛋白进入线粒体和过氧化物酶体;另一个定向抗氧剂酶是从高等植物中获得的谷胱甘肽还原酶,这种蛋白有一个模糊的N-末端引导信号,它负责将蛋白质转运进质体和线粒体。
由甲藻的Lingulodinin polyedrum核基因组编码的Fe-SODs似乎可以定向到三种ROS产生器官,有效的实验数据表明这种酶是进入质体中的,它也可以定向到线粒体和过氧化物酶体中。
定向到甲藻的质体中的蛋白Fe-SODs(LpFe-SOD)与Ⅱ类甲藻质体蛋白相似,Lp Fe-SOD有一个二重的前导序列。这个序列含有一个信号肽其后紧跟着一个转运肽。生物信息学分析表明信号肽是非典型的,但是这整个序列可能是线粒体的引导信号。在具有复杂质体的藻类中,LpFe-SOD可能是一新的蛋白种类。这种蛋白能定向到质体和线粒体。除了模糊的N-末端引导信号,LpFe-SOD在C-末端有一个潜在的Ⅰ型过氧化物酶体引导信号(PTS1)。根据这个歧化酶的过氧化物酶体的定位,它的mRNA含有两个AUG密码子,第一个起始密码子相较于第二个起始密码子位于较弱的寡核苷酸序列,这表明质体/线粒体定向以及过氧化物酶体定向同工型的合成是通过所谓的渗漏扫描,而且研究结果表明这两个同工型是由一个位于第一和第二两个起始密码子之间的发夹结构调节的。
7.4.1.1 核编码蛋白进入甲藻质体的典型的运输机制
甲藻是一类单细胞真核生物的多样群体。它是海洋和淡水浮游植物的主要组成之一。大约一半的甲藻物种都是具有光合作用的,并且有许多不同种类的质体。最广泛的是所谓的多甲藻黄素质体。它由三层膜包围着,包含辅助色素、叶绿素C,还有类胡萝卜素,因此而得名。对甲藻黄素质体的进化起源仍有争议,大多数研究者认为它起源于一个红藻门内共生体。人们假定多甲藻黄素质体直接从相同的次级内共生体进化而来。然而最新的关于质体基因的系统发育研究表明多甲藻黄素质体是由附着植物藻类获得的。
多甲藻黄素质体有一个特殊的基因组。几乎所有的甲藻质体蛋白(约2 000~3 000)都是在核基因组中被编码的,这些蛋白有复杂的N-末端引导信号,这个引导信号由两个结构域组成。
第一个结构域有信号肽的特性,能使其共翻译进入内质网,而第二个结构域类似转运肽,负责翻译后进入发光质体和叶绿体的初级质体。值得注意的是这种二重前导序列也是其他具有复杂质体的藻类的特性,但是在真核藻类中,甲藻是例外的,包含两种质体转运肽,第一种是一种转运肽序列后紧跟着一个疏水结构域,这个结构域是一个终止转运序列,第二种只有转运肽,因此第一种甲藻质体蛋白包含三重前导序列(信号肽、转运肽和终止转运序列),而第二种只有两种前导序列(信号肽、转运肽)。
7.4.1.2 Lp Fe-SOD的N-端引导信号肽的特点
最初通过制定疏水性图描述了LpSOD N-末端的引导信号,有两个疏水性区域,其周围环绕着一个富含羟基化的残基(S,T,Y)和碱性残基(H,K,R)(图7-19)。这个疏水性图与定向到多甲藻黄素质体的其他蛋白相似,尤其是属于Ⅰ类的蛋白。这表明LpSOD前导序列的第一个结构域是作为一个信号肽,而第二个是一个转运肽,第三个是作为一个终止转运序列。然而每个结构域的进一步检验揭示了有趣的特性:LpSOD的N-末端延伸使其成为一个奇特的引导信号。
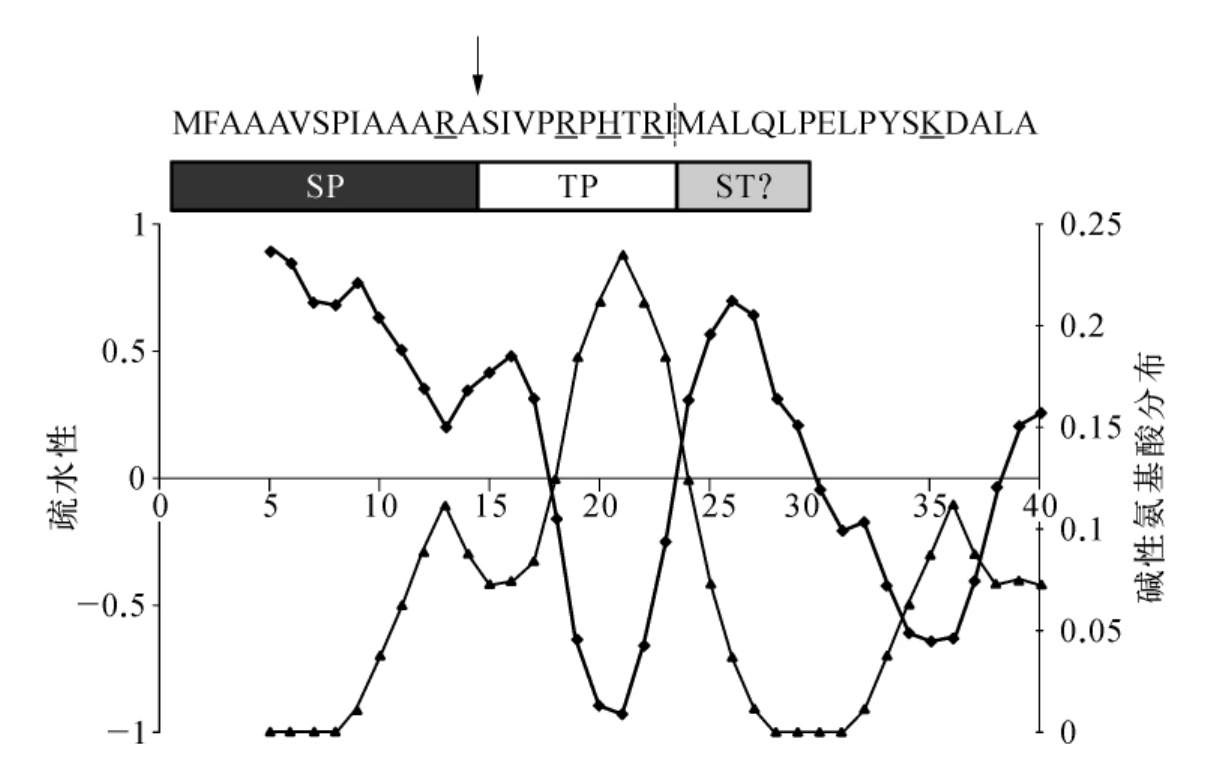
图7-19 LpSOD N-端延伸的结构
(摘自Andrzej Body,et al.Arch.Microbiol.,2007)
在这个区域有两个不同的引导功能域:信号肽和转运肽。箭头表示SP的分裂点,位于有独特的AXA模块后。垂直的破折号将前导序列从成熟蛋白中分离出来。下面画线的是碱性残基(H,K,R),而羟基化的残基用粗线表示。在位置特点图中粗线表示亲水性,而细线表示碱性残基的分类。
A.类似信号肽的结构域
为了确定LpSOD的第一个疏水结构域可能作为一个信号肽起作用(图7-19),运用了预知不同种N-端引导信号程序(如TargetP,iPSORT,Predotar)和信号肽的鉴定程序(如PrediSi,SIGFIND,SignalP-HMM)。分析出现了意外的结果,过去用于发现不同N-末端引导信号的六种软件工具,都没有预测到一个信号肽,相反的,预测信号肽的程序给出了不一致的结果,其中三种即DetecSig in ConPredⅡ,PrediSi和SignalPNN都没有发现一个信号肽,在EMBOS程序包中Sigcleave鉴定了一个信号肽,但是在低于3.5分的最佳效果下,其他四种程序发现了一个信号肽(如SIGFIND),大多都在相同的低分下,每一种软件工具在14和15位氨基酸中间预测到一个裂点。这个位点在AXA模块前,AXA模块是由信号肽酶识别的。组合的结果表明LpSOD N-端延伸的第一个疏水结构域代表一个非常奇特的信号肽。
LpSOD信号肽的特点是它的内质网引导信号,这个特点表明LpSOD可能翻译以后而不是共翻译进入多甲藻黄素质体,蛋白质进入高等植物质体的最新研究证明了除了普通的翻译后引导信号,也出现了一个共翻译引导途径。两种不同的引导系统同时在多甲藻黄素质体中运行。目前,这种可能性没有被排除掉,然而,另一个可供选择的假说认为Lp SOD不仅进入质体而且进入另一个器官,线粒体可能是一个候选器官。线粒体转运肽在许多情况下与质体转运肽很相似,这表明,甲藻SOD可能在信号肽的修饰或变性后进入线粒体。
B.类似转运肽的结构域
AXA模体的出现表明类似信号肽的结构域在LpSOD共翻译进入ER的过程中被分开,因此,这个9个氨基酸亲水结构域(残基15~24)(见图7-19)负责穿过两个内层质体膜的蛋白通道。正如已经表明的甲藻SOD不仅定向于质体,而且定向于线粒体。如果是这样,它的类似转运肽的结构域的修饰可能是特定选择的去改变线粒体运输。
C.类似终止转运结构域
LpSOD的第二个疏水结构域只有6个氨基酸(位于24~30)构成(图7-19),其中五个位于成熟蛋白中,这明显与经典的转运膜结构域的长度形成对比,经典的转运膜结构域是由20个α-螺旋的残基构成。Kurolwa等人证明可终止转运结构域可能是由7个氨基酸残基构成,然而,在短的终止转运结构域的情况下,所有残基必须是高度疏水的,其后必须跟着带正电荷的氨基酸将蛋白锚定于膜上。据此,LpSOD的第二个疏水区域可能作为一个终止转运序列是可疑的。这个结构域只有五个疏水残基,它们被一个极性谷氨酰胺分开。此外,只有一个正电荷残基存在于它们的邻近区域。
7.4.1.3 Lp Fe-SOD的序列特点与Fe-SOD的多质体定位
A.LpFe-SOD的前导序列的特点
LpSOD的前导序列只有25个氨基酸构成(见图7-19),这明显与属于Ⅰ类和Ⅱ类的甲藻质体蛋白N-末端突出端的长度形成对照,Ⅰ类蛋白的前导序列平均长度为66个残基,而Ⅱ类蛋白是71个残基,Ⅰ类蛋白中最短的序列(49个氨基酸)是在ATP合酶的亚基C中发现的,在Ⅱ类蛋白中,最短的前导序列(40个氨基酸)存在于β-酮酯酰还原酶。
LpSOD类似信号肽的结构域只包含14个氨基酸(见图7-19),是目前为止甲藻质体蛋白最短的信号肽,在Ⅰ类和Ⅱ类蛋白中的信号肽的平均长度是24个残基。在Ⅰ类蛋白中,最短的是三磷酸甘油醛脱氢酶中的16个氨基酸的信号肽。在Ⅱ类蛋白中,最短的序列是在碳酸脱水酶中发现的15个氨基酸的信号肽,尽管这些短的序列在总长度上与LpSOD信号肽相似,但是通过预测信号肽和其他各种N-末端引导信号的程序可知,它们有较强的ER引导信号。这些数据支持假说:LpSOD有一个具有反常内质网引导信号的特殊信号肽。
B.LpFe-SOD的N-末端延伸作为线粒体的引导信号
考虑到LpSOD N-末端突出的不同寻常的特点及其反常的ER引导信号,认为整个前导序列是作为一个单个的引导信号,能允许这个歧化酶进入线粒体。这个假说可由以下几个证据支持:第一,精氨酸存在于甲硫氨酸后有两个位点,这段是LpSOD成熟部分起始信号。这个序列模型由线粒体加工肽酶识别。第二,the apicomplexanc Toxoplasma gondii和恶性疟原虫,与甲藻密切相关,包含一个线粒体定向Fe-SOD,这个Fe-SOD配备有一个二重前导序列,这个序列由一个信号肽其后紧跟着一个类似线粒体引导信号的亲水结构域构成。第三,线粒体含有高浓度的超氧化物歧化酶,这些酶不仅定向到线粒体基质而且定向到多甲藻黄素质体空间。
支持LpSOD引导到线粒体的证据来自它的前导序列的氨基酸位置。在表7-4中,将它的前导序列与Ⅱ类蛋白的15个甲藻前导序列,含有信号肽的两个甲藻前导序列,两个来自the apicomplexanc Toxoplasma gondii和恶性疟原虫的线粒体二重前导序列,恶性疟原虫的经典线粒体前导序列和其他真核比较,像apicomplexanc的二重前导序列,恶性疟原虫和其他真核的已知线粒体蛋白,LpSOD前导序列也富含碱性残基,不含酸性残基,像线粒体前导序列通常不含酸性碱基。与LpSOD前导序列相比,带有信号肽的甲藻前导序列很少含碱性残基,Ⅱ类蛋白的前导序列平均的碱性残基比线粒体序列少。
表7-4 不同种质体和线粒体前导序列酸性和碱性残基的百分比

pt—质体;mt—线粒体。
①由Patron等人公布的平均超过15个的前导序列;
②Patron等人公布的带有短信号肽的碳酸酐的前导序列;
③Patron等人公布的带有短信号肽的3-磷酸甘油脱氢酶的前导序列;这个前导序列只分析了信号肽和转运肽而没有分析跨膜区;
④定向到线粒体The apicomliexan二重前导序列;
⑤Bender等人公布的40前导序列的数据;
⑥Bender等人公布的282样本前导序列的数据。
(摘自Andrzej Body,et al.Arch.Microbiol.,2007)
上述分析表明LpSOD定向到线粒体,但是没有表明最终进入线粒体的亚结构,在第二个甲硫氨酸上有2个位置出现精氨酸表明酶进入线粒体基质。它的N-末端引导信号由线粒体加工肽酶分开。然而,还有另一假说,即LpSOD定向到多甲藻黄素质体,引导蛋白进入多甲藻黄素质体比进入线粒体基质简单得多,因为前者不需要引导信号。
C.LpFe-SOD在具有复杂质体的甲藻中可能代表一类新的蛋白
获得的证据表明LpSOD在甲藻中代表一种新的蛋白,这类蛋白的特点是连接着一个信号转运肽序列和一个弱的ER引导信号,这使它们不仅可以进入质体也可以进入线粒体。在信号肽中,标准ER引导序列的偏差将减少LpSOD和信号识别颗粒相互作用的可能性,这个序列将与一个可供选择的引导复合物相连,能使甲藻超氧化物歧化酶传递到线粒体中(见图7-20)。与这个假说一致,NAC能与SRP竞争,将结合蛋白引导进入线粒体。
在高等植物中,描述了线粒体/质体定向蛋白的类似物,它的鉴别特点是一个模糊的N-末端引导信号,能使它们进入质体和线粒体。线粒体/质体定向蛋白的假说种类的典型不仅出现在甲藻中,而且存在于具有复杂质体的其他藻类中,当更多序列变成有效序列时,这是可能的。
D.LpFe-SOD定向到过氧化物酶体
当描绘L.polyedrumFe-SOD的引导信号时,Okamoto等人只详核了N-末端引导信号,然而,这个蛋白质还含有一个潜在的引导信号,它的C-末端有一个SKL三肽,代表一个保守的PTS1,表明L.polyedrumFe-SOD也可能定向到过氧化物酶体。过氧化物酶体产生大量的ROS变得合乎情理。不同种SOD包括Fe-SOD能清除ROS。
通过预测,LpSOD的mRNA包含两个符合读框的AUG密码子(见图7-20),第一个称为AUG1位于cDNA序列的9~11位置,编码甲硫氨酸起始N-末端引导信号;第二个潜在的起始密码子由在成熟LpSOD蛋白中起始核苷酸81~83编码,这个位置的AUG2是巧合的,不是必须作为一个翻译的另路起点。只有当AUG位于一个特定的寡核苷酸前后,40S核糖体才能识别它作为起始密码子。-3位置的A和+4位置的G是提供翻译起始的关键核苷酸。在AUG密码子中,+1位置是A。有趣的是,围绕AUG1的核苷酸序列表明它位于一个很弱的序列前后,每一个关键位置都由U代替A或G(见图7-20),相反,AUG2在一个强的起始序列前后,嘌呤位于-3位置和+4位置(见图7-20),并且,-3位置由A占据。因此,AUG2位于较强的序列前后,这些数据与AUG2是一个另路翻译起始位点完全一致。

图7-20 在L.polyedrum细胞中,Fe-SOD引导的假说的模型
(摘自Andrzej Body,et al.Arch.Microbiol.,2007)
L.polyedrumFe-SOD的mRNA包含两个框内的AUG起始密码子和一个位于第一个起始密码子下游的可能存在的发夹结构。开始于第一个起始密码子上的翻译能合成更长的同工型。这个同工型是一个由信号肽和转运肽构成的二重前导序列,因为第一个起始密码子代表一个弱的ER引导信号,因此在SRP和NAC之间存在竞争,如果新合成的L.polyedrumFe-SOD与SRP连接,它就能进入质体,在这个途径中第一个引导步骤包括共翻译进入内质网,在这个运输过程中,信号肽由信号肽酶除掉。在接下来的小泡引导步骤,被运输的蛋白进入质体,但是这个步骤是否涉及高尔基体还不清楚。源自ER(GA)的小泡质体外层膜融合后,在Toc/Tic复合物的帮助下,L.polyedrumFe-SOD被转运穿过内层膜,到达基质后,转运肽被基质加工肽酶去除,如果这个新合成的L.polyedrumFe-SOD与NAC相连,它被运输进线粒体。这个运输可能发生在翻译后或共翻译,到达线粒体基质后,二重引导信号被线粒体加工肽酶去除。在第二个起始密码子上开始翻译使得较短的同工型的合成。这个短的同工型缺乏N-末端引导信号,但是包含C-末端Ⅰ型过氧化物酶体引导信号。在胞质溶胶中翻译后,L.polyedrumFe-SOD与Pex5受体结合,然后这个Fe-SOD/Pex5复合物传递进入过氧化物酶体。
7.4.1.5 Lp Fe-SOD同工酶
A.渗漏扫描、发夹结构以及LpFe-SOD质体/线粒体定向同工型的合成
LpSOD的过氧化物酶体定向同工型可能是由所谓渗漏扫描形成的。在40S核糖体的mRNA扫描过程中,如果AUG1被绕过,翻译就从AUG2开始,这样导致一个过氧化物酶体同工型的合成。因为第一个起始密码子位于一个较弱的位置,因而,在几乎所有情况下,它很容易被绕过,故它不可能合成质体或线粒体定向同工型,由此可知LpSOD转录物具有使翻译从AUG1开始的特点。
使核糖体从位于较弱位置的AUG开始翻译的一条途径是在这样一个密码子的下游有一个发夹结构,这个结构通过40S核糖体终止mRNA扫描,它能增强弱的起始密码子被识别的可能性。在Kozak的经典论文中,它证明了发夹结构的效率依赖于它与第一个起始密码子相比的位置。效率最强的发夹结构位置距第一个AUG密码子14个核苷酸位置,然而,这个位置不能合成另路同工型,因为在所有情况下,蛋白合成起始位于第一个起始密码子。发夹结构离最佳位置越远,第一个起始密码子越容易被越过,而使蛋白合成在第二个起始密码子开始,这会导致大量的同工型产物。
关于LpSOD的mRNA的AUG1和AUG2的核苷酸的分析表明它们有能力形成一个稳定的发夹结构。EMBOSS3.0.0程序包中的回文结构程序能找出回文序列的位点,并且,所有的核苷酸都是胞嘧啶和鸟嘌呤。这表明预测的发夹结构的高稳定性。ViennaRNA程序包中RNAfold和RNA结构4.2程序预测到这个区域的一个带有-20.2kcal/mol的自由能的稳定的二级结构(见图7-20),尽管发夹结构的存在和准确的位置能凭经验决定,但EMBOSS程序包中的回文结构程序表明它位于距AUG1只有6nt的位置。这个位置是两个LpSOD同工型合成的最佳位置,如果发夹结构离第一个AUG密码子越远,它越能限制过氧化物酶体定向同工型的合成。
B.在甲藻中存在几种Fe-SOD同工型
详细的生物信息学分析表明LpSOD转录物编码质体/线粒体定向同工型以及过氧化物酶体定性同工型(见图7-20),Okamot等人电泳分析了L.polyedrum细胞的粗提取物证明了两个同工型的可能性,在电泳图谱中,Fe-SODs不是由几条条带表示,它们中的一条与质体/线粒体同工型,过氧化物酶体同工型定向一致是可能的。
甲藻是一类有待研究的原生生物,仍然存在许多问题。无论是关于Ⅱ类质体蛋白的运输机制还是质体蛋白的引导进入质体以外的其他器官,如线粒体或过氧化物酶体。直到现在,无论是甲藻或其他具有复杂质体的藻类,还没有蛋白具有定向到两个或三个器官的特性,Lp SOD是这种蛋白的第一个候选者。尽管还没有实验数据确定这种蛋白的双重(三重)引导,但是综合的生物信息学分析表明甲藻超氧化物歧化酶不仅可以定向到质体而且可以定向到线粒体和过氧化物酶体。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















