原子论的争论
原子论的争论
1.盖·吕萨克与道尔顿的争论
1808年即原子论发表的那一年,法国物理学家盖·吕萨克发现了“气体反应体积简比定律”。
盖·吕萨克发现,2体积氢气和1体积氧气化合生成2体积水蒸气,1体积氮气和3体积氢气化合生成2体积氨气……他联系刚发表的原子论,认为同温同压下,相同体积的不同气体(无论是元素还是化合物)中含有相同数目的原子(同道尔顿一样,他将单质原子和化合物分子都称为原子)。他认为这是对道尔顿原子学说的支持,但道尔顿本人却极力反对。道尔顿的理由是,氧气与氢气化合时,如果认为:
1体积氧气+2体积氢气→2体积水蒸气
那就相当于:
1个氧原子+2个氢原子→2个水原子
这样岂不是每个氧原子分成了两半,分别进入到1个水原子中去了!这与原子在化学反应中不可再分相矛盾。道尔顿认为这是对原子论的直接挑战,他动手做了一系列实验,想证明盖·吕萨克是错误的,结果使人们看到他的实验技术远逊于盖·吕萨克。
在这场争论中,贝采里乌斯倾向于支持盖·吕萨克。1812年他写信给道尔顿:“您通常那种形式的学说(指原子论)有几点应该修改。例如您反对盖·吕萨克关于彼此化合的气体体积的实验的那部分就是这样的。我最倾向于认为,这些实验乃是原子论正确性的出色证明。”由于氢气和氧气反应的体积比为2∶1,贝采里乌斯认为水的化学式是H2O而不是道尔顿认为的HO,从而得出了H、O的正确原子量。
表4-1给出了贝采里乌斯三次发表的原子量的摘录,为方便比较已做过换算,将原来的O=100标准改为O=16.00标准。
表4-1 贝采里乌斯发表的原子量值(摘录)
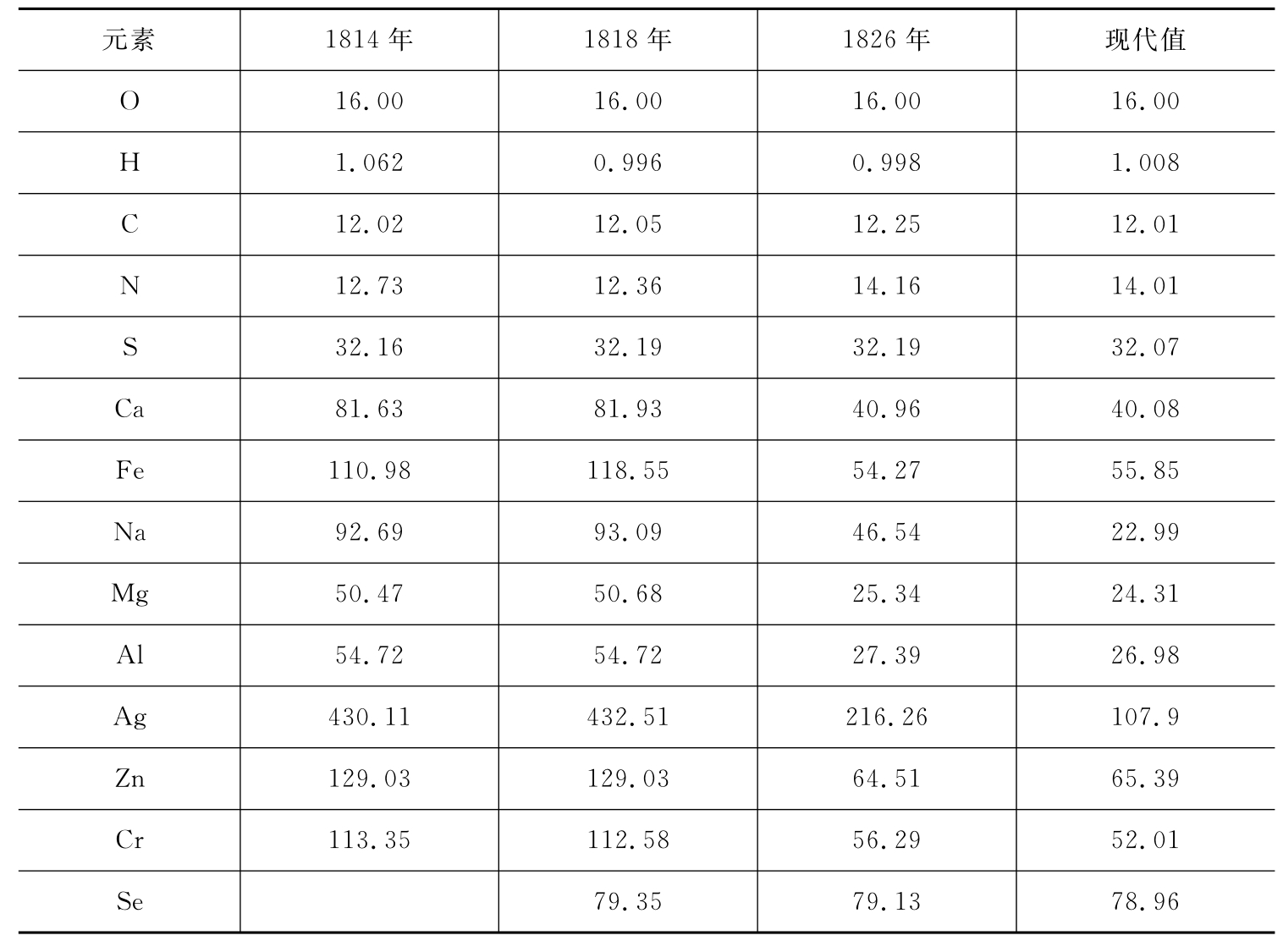
19世纪初期还没有元素周期律等化学理论的指引,实验仪器也相当简陋(见图4-1)。但是从表中可见,他1826年发表的原子量多数已与现代值十分接近,当时能得到这样的结果实在令人惊叹。
贝采里乌斯在确定化合物的化学式时,首先利用了下列定律:定组成定律、倍比定律、原子热容定律、同晶形定律、气体反应体积简比定律以及他创立的电化二元论等。但是仅运用这些定律中的几项尚不能确定化学式,必须综合运用当时已知的全部化学理论和知识作统一的认识贯穿,才能推断出正确的化学式。
原子量测定结果和各种研究方法为原子论奠定了坚实的实验基础,也为元素周期律的发现做好了充分准备。矿物分析,以前主要依靠外观物理性质进行分析,贝采里乌斯将这些化学理论用于矿物分析,创造了以元素和组成分析为主的化学分析方法,并以此为手段精确分析了大约2 000种化合物和矿物的组成。这在化学家和矿物学家中产生了广泛影响,“增加了化学的威容”,促使化学成长为一门基础科学。
图4-1 19世纪的定量分析实验设施
今天看来,这些理论、方法或手段都很明晰,但在当时,由于贝采里乌斯两次修改原子量,原子热容定律又有所反复,致使许多人不再信任原子量,转而求助于“当量值”。1833年法拉第电化学当量定律的发现更助长了这一势头,致使贝采里乌斯出色的第三张原子量表此后数十年淡出化学文献,直到40多年后,人们才惊奇地重新发现了贝采里乌斯的第三张原子量表,这其中该有很多值得回味的道理。
2.分子论与电化二元论
对盖·吕萨克的气体反应体积简比定律提出合理解释的是意大利物理学家阿弗加德罗。1811年,他在法国《物理杂志》发表一篇经典论文《论测定物体中原子相对重量及其化合物中数目比例的一种方法》,论述原子量的测定、化学式的确立等。他以物理学家的思辨指出,若假设“分子”存在、单质分子中含有偶数个原子,则水的生成可表示为:
1个氧分子(O2)+2个氢分子(H2)→2个水分子(H2O)
这样就不会出现氧原子一分为二的情况。他总结的阿弗加德罗定律现在仍在广泛使用:“同温同压下,相同体积的任何气体含有相同数目的分子。”
分子假说没有顾及当时盛行的电化二元论,因此不被人们接受:两个相同的原子,具有相同的电性质,同性相斥,怎么能结合在一起形成稳定的“分子”?阿弗加德罗的分子假说在此后40多年间几乎无人问津,直到1856年阿弗加德罗去世。
后来,有机化学中发现了很多取代反应,贝采里乌斯的电化二元论受到很大冲击。1839年,法国化学家杜马(1800~1884)发现三氯代醋酸与醋酸的性质相似,于是杜马对电化二元论发起了“略带醋酸味”的攻击。他写道:“贝采里乌斯希望氢永远是正电的,氯永远是负电的,当我们看到它们彼此取代并起着相同的作用时,他仍然这样希望。”
尽管贝采里乌斯竭力从理论上对这一事实进行解释,却再也不能挽救他苦心构建的、在当时的无机化学中起着系统和分类作用的电化二元论的颓势。电化二元论的突破为阿弗加德罗分子论的复出开辟了道路。
3.原子量测定之辩
阿弗加德罗的同胞、化学家康尼查罗既了解原子论的危机,也认识到分子论的意义。他指出:“分子假说不仅可以用来测定分子量,而且可以用来测定原子量。”以氢原子量测定为例,康尼查罗测得了表4-2的数据。
根据阿弗加德罗的分子假说,这些气体在同温同压下均为1升,因而含有相同的分子数(设为N)。如果一个分子中只含一个氢原子,则这1升气体中氢原子数为N;如果一个分子中含有两个氢原子,则这1升气体中氢原子数为2 N;依此类推。从表中可以看出,氯化氢、氰化氢、氟化氢每个分子中各含一个氢原子,所以N个氢原子的质量是0.0412g。
表4-2 1升气体中氢的质量(25℃、1atm)
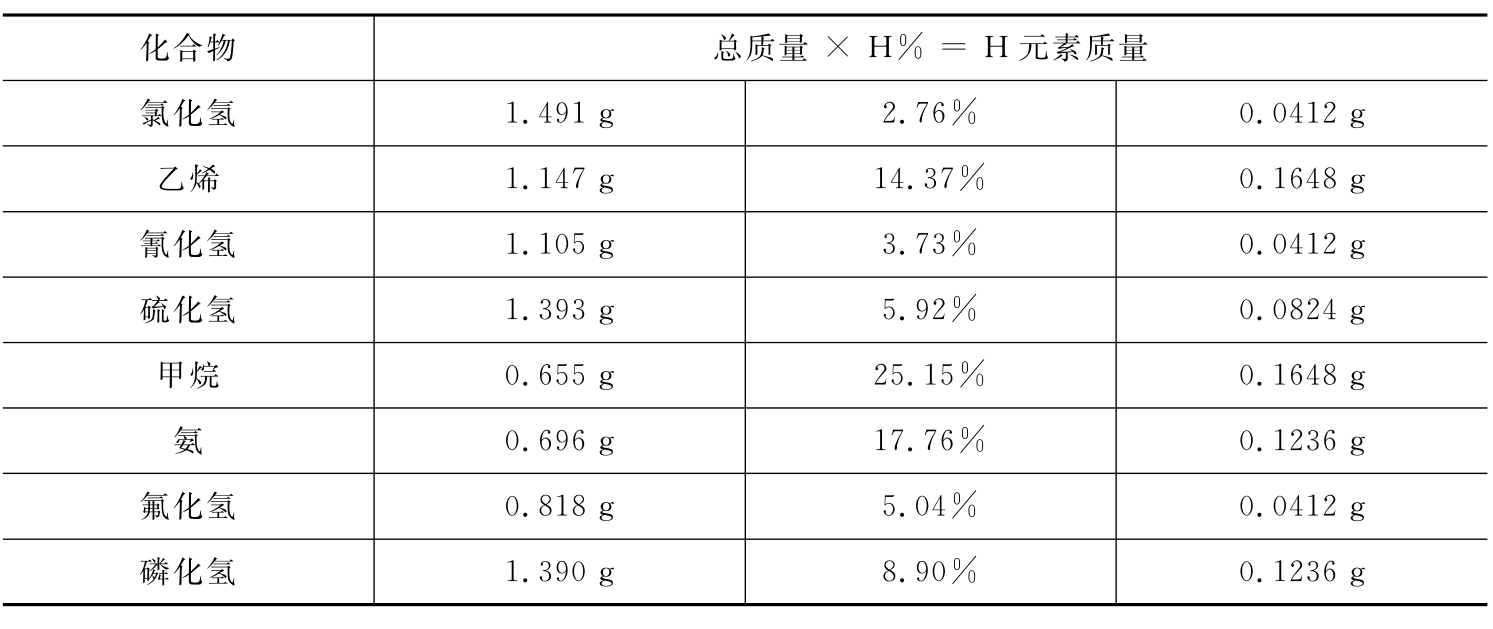
再根据1升氧的气态化合物的类似表格,找出氧的最小质量0.654g,即N个氧原子的质量是0.654g。由此可知氢原子与氧原子的质量比是0.0412∶0.654=1∶16。
康尼查罗用一系列挥发性化合物测定了氢、氧、碳、铜、铅、铬、铁、汞、银、金、锌、锰、锡、铂等元素的原子量。1860年,他在卡尔斯鲁厄化学会议上介绍了阿弗加德罗分子论和自己在此基础上的原子量测定方法,但没有引起大家的注意。机智的康尼查罗在代表们离开大会时,向他们散发了自己的论文。在当时较为漫长的归途中,许多科学家研读了他的论文。正如德国化学家迈耶尔后来回忆:“这本篇幅不大的论文对于大家争论中最重要的各点照耀得如此清楚,使我感到惊奇。代表大会的许多成员也会有同样的感受。于是辩论的热潮消退了,昔日贝采里乌斯的原子量又流行起来。阿弗加德罗定律和杜隆、培蒂的原子热容定律之间表面上的矛盾一经康尼查罗解释清楚之后,两者都能普遍应用;作为元素化学基本量的原子量就被建立在坚固的基础之上,没有这个基础,原子结合的理论绝不可能发展起来。”
1864年,迈耶尔出版著名的《现代化学原理》,更多的人正是从这本书中接受了阿弗加德罗分子假说和康尼查罗的论证。
以上可见,早期原子量的测定与科学的原子—分子论的发展与巩固休戚相关。康尼查罗在以其原子量测定新方法重振分子论时,并没有忘记为原子量测定作出巨大努力的贝采里乌斯,他在《关于原子、粒子和当量的概念与各种化学式系统的发展概论》一文中指出:“贝采里乌斯从1807年开始的和从1809年以更大力量继续进行的勤奋而恒久的研究,对于原子论的进一步发展和把它应用于化学的各部门来说,做得正当其时。在这方面,这位瑞典化学家比他所有同时代的人做得都多。”
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














