温伯格和他同事的研究是从克隆于噬菌体的人膀胱癌细胞株EJ的癌基因开始的。限制性内切酶的酶谱分析、NIH3T3细胞的转化活性测试和印迹杂交都表明,EJ细胞癌基因(EJ-onc)的转化活性段在一个23 kb的Eco R Ⅰ片段上,它和源于大鼠肉瘤病毒的癌基因v-Ha-ras是同源的。进一步的转化活性分析又进一步把活性片段定位于上述片段中的一个6.6 kb的Bam H Ⅰ片段。这段DNA具有很高的转化活性,每微克这种DNA能在NIH3T3细胞单层上诱发5×104个转化细胞克隆。与此相反,来源于正常膀胱上皮细胞的同源DNA,原癌基因c-Ha-ras的6.6kb Bam HⅠ片段却完全没有转化活性(图8-3)。为了找出这两段功能截然不同的DNA的结构基础,温伯格等用Xho Ⅰ、Sac Ⅰ 、BstEⅡ 、Xma Ⅰ和Kpn Ⅰ等多种内切酶处理EJ-onc 6.6 kb片段和c-Ha-ras 6.6 kb片段,竟找不出任何区别。为什么功能如此不同的两段DNA结构竟会如此相似呢?
答案可能有两个:①EJ-onc和c-Ha-ras的结构是一样的,只是在膀胱癌细胞中表达的程度大大超出了它在正常的膀胱上皮细胞中的表达程度,这是一种表达量的差别,一种量的差异;②EJ-onc和c-Ha-ras之间存在尚未查出的结构差异,即存在某种质的差别。

图8-3 EJ-onc和c-Ha-ras转化活性和致瘤活性的差异
以EJ-onc DNA制备的探针可探测细胞中转录自EJ-onc的mRNA,这是一段长度为1.2 kb的RNA分子。分析表明膀胱癌和正常膀胱上皮细胞中的这种特征性mRNA分子的含量水平是相近的。
是不是EJ-onc和c-Ha-ras的细胞表达背景不同造成了功能差异呢?如果将这两段DNA都转入同一细胞株,使它们在相同的细胞背景下行使功能,就可弄清上述问题。温伯格等做了EJoonc和c-Ha-ras这两个非选择性DNA片段和标志性选择基因霉酚酸抗性基因(MR)的协同转移实验。即将EJoonc的DNA和MRDNA一起转染NIH3T3细胞,然后在含霉酚酸的培养基上选出抗性细胞,再提取并测定其DNA的转化活性。结果发现75%的抗性细胞DNA有恶性转化活性。相反,用对照DNA c-a-ras做的同样实验表明,没有一个抗性细胞的DNA有转化活性。
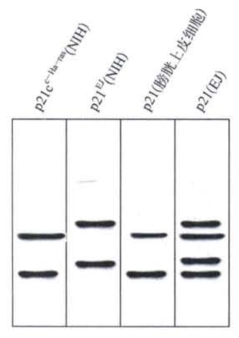
图8-4 各种不同来源的p21蛋白的电泳图谱
接着又从转入了上述DNA片段的NIH3T3细胞中分离出EJ-onc的6.6 kb Bam H Ⅰ片段和c-Ha-ras的6.6 kb Bam H Ⅰ片段,分别注射裸鼠,结果前者5/5致瘤,后者为0/5。最后又对NIH3T3背景上两段基因的转录产物和翻译产物做了定量分析,两者的1.2 kb的mRNA含量相近。其编码的一种分子量为21 000的蛋白质p21的含量也相近。这一系列的研究清楚地表明,无论是基因表达的数量差异还是基因表达的背景不同,都不能说明膀胱癌的发病机制。实验研究反复提示我们的是癌基因EJ-onc编码的特异性转化蛋白p21EJ,有可能引起细胞的恶性转化和裸鼠致瘤,而c-H-ras编码的p21 c-Ha-ras既无转化潜能又无致瘤能力。
在分析从NIH3T3提取的p21EJ和p2 1Ha-ras时,发现它们各有两条与p21蛋白相关的电泳带。还发现p21 EJ的两条带都比p2 1c-Ha-ras的相应电泳带走得慢些(图8-4)。因为没有检出两者在磷酸化程度上有任何差别,所以电泳特性上的差异可能反映了两种p21蛋白的结构不同或构型不同。如果对膀胱癌EJ细胞和正常膀胱上皮细胞的相应蛋白质做类似的比较,则可发现正常细胞中的两条p21蛋白电泳带和来自NIH3T3的p21c-Ha-ras相同,而EJ细胞则出现4条p21蛋白电泳带,其中两条和p21EJ相当,其余两条和p21c-Ha-ras相当。这就表明了在EJ细胞中有两种基因表达产物,在分子水平上看EJ-onc和等位基因c-Ha-ras是等显性的,在导致细胞恶性转化和裸鼠致瘤这两个性状上EJ-onc基因对c-Ha-ras呈显性。
为了在DNA分子一级结构上探寻两种p21蛋白结构和功能差异的原因,温伯格等用DNA重组技术,把6.6 kb的Bam H Ⅰ片段的不同酶切片段的重组分子,即一系列由来自EJ-onc和c-Ha-ras不同的内切酶片段拼接而成的6.6 kb片段,一一组入载体质粒pBR322,扩增后做转化活性测定和致瘤性测定(图8-5)。经过周密的设计和精细的实验分析,终于找出了一段造成转化活性差异的关键性片段:包含了外显子1的一段长度为350 bp的Xma Ⅰ~Kpn Ⅰ片段。
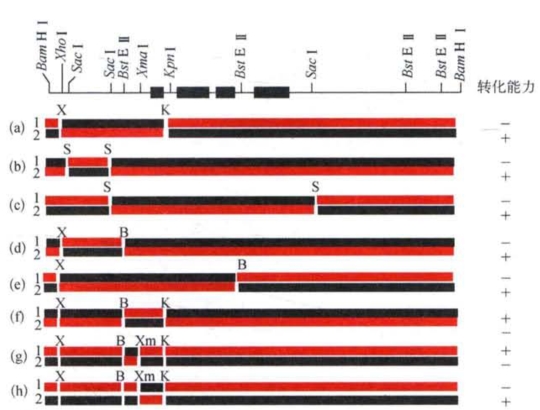
图8-5 EJ-one和c-Ha-ras分子克隆重组体的结构和转染实验结果(改自C.J.Tabin等)
图中第一行为6.6 kb的Bam H Ⅰ片段的内切酶酶谱图,其中黑框为编码外显子的区域。以下为一一对应的各组重组体,其中红线是源于EJ-one的片段,黑线为源于c-Ha-ras的片段。所有重组分子载体均在大肠杆菌的HB 101菌株中扩增。各组转染NIH3T3细胞的DNA量均为20 ng。转染14 d后观察转化细胞集落数。
接着温伯格等又用双脱氧核苷酸测序法和Maxam-Gilbert测序法对Xma Ⅰ~Kpn Ⅰ片段做核苷酸序列分析。终于发现EJoonc和c-Ha-ras在编码外显子1区段的唯一区别,是从Xma Ⅰ切点开始计数的第60位核苷酸由c-Ha-ras中的G(鸟嘌呤)突变成了EJ-onc中的T(胸腺嘧啶)。这个核苷酸属第一个外显子的第12个密码子,从G变为T导致p21蛋白中的甘氨酸变成了缬氨酸(图8-6)。
整个实验有几点值得注意和讨论的地方。
(1)6.6 kb Bam H Ⅰ片段在数量上只相当于整个基因组DNA的百万分之一,检出这段有转化活性的DNA片段实际是把研究目标缩小了106倍。这和病毒癌基因的研究、Alu重复序列的研究,以及DNA重组技术的进步是直接相关的,特别是病毒癌基因的克隆使人类癌基因的发现至少提前了10年。
(2)DNA分子中核苷酸序列的改变并不一定是癌变的前奏,它有可能仅仅是一种结构多态现象,不一定有特殊的生物学意义。问题的关键是这套实验进一步把这种结构变化和功能异常联系起来,整个实验的精髓是自始至终把转化活性作为探寻结构变异的生物学“向导”。
(3)从G→T的结构变化还引入了限制性内切酶谱的多态性,即失去了HpaⅡ和Msp Ⅰ的切割序列C CGG。这种由基因结构引起的限制性片段长度多态性(restriction fragment length polymorphism,RFLP)可以作为识别转化基因的分子标记。
CGG。这种由基因结构引起的限制性片段长度多态性(restriction fragment length polymorphism,RFLP)可以作为识别转化基因的分子标记。

图8-6 人膀胱癌EJ株的癌基因和正常膀胱上皮细胞中原癌基因之间的结构及其蛋白产物比较
(4)从蛋白质结构看,甘氨酸往往是多肽链中所有氨基酸残基所占位点中最易被弯曲和折叠的无侧链氮基酸,发生于甘氨酸密码子的替代突变极有可能引起蛋白质构型的改变。这可能是导致p21蛋白功能发生有病理意义的重大改变的原因。
长期以来,致癌是一个非常复杂的生物学过程已经成了公认的科学常识。所以,许多人是难以接受仅仅一对碱基的替代就会导致细胞恶性转化的新发现。当时有人提出了一个挑战性的问题:难道一对碱基的改变就足以使正常细胞变为癌细胞吗?温伯格的回答也是挑战性的:像镰状细胞贫血这样的致命遗传病,不也是由一对碱基的改变造成的吗?所以问题的核心不是“一对碱基的改变”,而是“这对碱基的改变”。
迄今为止,已经发现人的膀胱癌、肺癌、结肠癌细胞中的原癌基因c-ras都发生了点突变,并发现ras基因恶性激活有两个突变热点:一个是第一个外显子的第12号密码子;另一个是第二个外显子的第61号密码子(表8-3)。表中c-H-ras是人基因组中和Harvey小鼠肉瘤病毒株的v-ras基因同源的原癌基因,c-K-ras则和Kirsten株的v-ras同源,至于表中出现的N-ras,它和H-ras与K-ras都有结构同源性,但在逆病毒中没有发现有相应的同源序列。这些资料雄辩地证明恶性转化的确有可能起源于一个点突变。
表8-3 引起转化活性的人ras基因突变

(续表)

1984年,巴瓦西德领导的实验室为我们提供了一个体细胞突变致癌学说的临床证据。图8-7所列的LC-10细胞是来源于一位66岁男性肺癌患者的癌细胞株。患者是从意大利米兰的一家医院转入美国国立癌症研究所的,患者平时抽烟严重,但尚未经过化疗。经检查诊断为中等分化的鳞状上皮细胞癌,位于右肺上部,占位大小为7cm×7cm,已浸润胸膜,但未查出任何转移灶。NIH3T3转化实验证明LC-10细胞的DNA有转化活性,经它转化的NIH3T3细胞的DNA也有转化活性。分子杂交分析表明LC-10细胞有活化的K-ras基因,用诊断性内切酶Sac Ⅰ切割和印迹杂交分析发现了特征性的8.2 kb和5.8 kb两个片段。而正常细胞中的非活化K-ras基因用Sac Ⅰ切割则只出现单一的14 kb片段,这是因为活化K-ras的第一外显子的第12号密码子由原癌基因中的GGT变成了GCT,从而在第10、11和12号密码子段增加了一个新的Sac Ⅰ切点:GAGC↓T。值得注意的是患者正常组织细胞中的DNA,包括血液淋巴细胞、气管上皮细胞和实质器官细胞的DNA,都只出现正常的14 kb片段(图8-7),表明同一患者的正常细胞都没有发生G到C的突变,取自正常细胞的DNA也都没有转化活性。这个病例有力地证明LC-10细胞的K-ras基因的恶性激活是由基因突变造成的,这种由突变造成的癌基因活化是和细胞的恶变直接相关的。有关这个病例的系统研究无可辩驳地证明,体细胞突变是致癌的一种基本途径。
1986年,哈佛大学的库珀(G.Cooper)等用基因定点诱变技术证明,含有第61位密码子的17种不同变异的H-ras基因具有使细胞发生恶性转化的活性。当然所有的实验结果并不意味着体细胞突变是癌症发生的唯一途径,也不意味着突变对癌变过程来讲是一个充分和足够的前提条件。这个例子还提示环境因素和生活习惯可能是癌症发生的重要诱因。

图8-7 肺鳞状上皮细胞癌患者的癌细胞和正常组织细胞的K-ras基因的结构差异(改自E.Santos)
A,正常细胞;B,LC-10细胞;C,LC-10 DNA转化的NIH3T3细胞;D、E、F分别为患者的血液淋巴细胞、气管上皮细胞和实质器官细胞。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















