在一个相当长的时期里,人们把自发突变归之于环境中自然存在的辐射本底和环境诱变剂。然而,深入的研究表明这种看法是不完全的。图3-5清楚地表明自然本底中的诱变因子是远不能说明自发突变率的。现在的看法是绝大多数的自发突变起源于细胞内部的一些生命活动过程,如DNA复制中出现的误差和遗传重组过程中的误差,这些误差的产生是和酶的活动有关的。
DNA复制是非常精确的。细菌的DNA多聚酶同时具备聚合功能和核酸链从3′端至5′端的外切功能,它可以切除已参入到合成链3′端,但与样板链不互补的错配碱基。这种复制中的校正(proof-reading)能大大减少新合成的DNA分子的错配率,从而提高DNA复制合成的精确程度。根据计算,这种校正功能可以把复制的错误减少到10-10/碱基对,即每复制1010个碱基对,只发生一次与样板链不互补的错配碱基的参入。细菌的基因组含3×106个碱基对,整个基因组复制一次发生错误的概率是3×10-4。假设细菌基因的平均大小为103个碱基对,则可推算出细菌在一个增殖世代中,每个基因的突变率平均为10-7左右。值得注意的是大多数自发突变是难以检测的“沉默”突变。所以,对于细菌的多数可检突变来讲,自发突变率会低于10-7。

图3-5 图示辐射本底不能说明果蝇的自发突变水平(引自R.C.von Borstel)
实验表明用剂量相当高的辐射处理时,诱发突变和辐射剂量呈直线相关。将该直线外推到自然的本底水平,只能说明自发突变中很小的一部分。
在大肠杆菌中已发现一些能增加自发突变率的突变型。如携带了与DNA复制有关的pol A和pol C基因突变的细胞的自发突变率会升高100倍,甚至更高。这种基因称为增变基因(mutatorgene)。与此相反,抗增变基因(anti-mutatorgene)突变的作用是降低自发突变率。有趣的是,增变基因和抗增变基因往往都是编码DNA多聚酶的结构基因,或者与DNA多聚酶协同参与复制的蛋白因子的结构基因的突变。
除了DNA多聚酶结构变异外,复制过程中的碱基错配(mismatch)、跳格(slipped)也是增高自发突变率的原因。此外,DNA分子水平的重组差误则会造成一个或几个碱基的重复和缺失,这种现象特别容易发生在序列相同或相似的DNA片段间的重组过程中。基因重组是由重组酶来催化的,所以重组酶结构的变异也会影响基因的自发突变率。总之,种种与DNA复制和基因重组过程有关的酶和蛋白质对维持生物一定的基因自发突变率是十分重要的,甚至是对物种的生存起着某种决定性作用的。
从理论上讲,一个生物种群的自发突变率是受到自然选择作用的,这种作用必定反映在种群的基因组结构上。也就是说自发突变率是由整个基因组来调节和控制的。我们观察到的物种或种群的基因自发突变率是群体基因组稳定程度的一个数量指标,它取决于某种平衡。这种平衡条件下的基因自发突变率既能使物种或种群保持演化弹性(evolutionary flexibility),又不致有危及种群发展的过高的突变率。
研究自发突变是必要的,但它的发生是一个小概率事件,当人们发现它时,突变过程已经完成了,也就很难找到有效的方法来确定其发生的时间、空间,及其影响因素。与自发突变相反,诱发突变是人类对生物体突变过程的某种干预,这种干预往往是了解、掌握和改变自然变化的出发点。诱发突变为我们研究突变机制创造了条件,诱变可以是一个可控的实验研究过程。
诱发基因突变的诱变剂可以是紫外线或电离辐射这样的物理因素,也可以是氮芥或亚硝酸这样的化学因素。下面我们以了解得比较清楚的紫外线诱发的突变过程为例来看看诱变研究在揭示突变本质中的独特作用。
紫外线是一种强杀菌剂,它在暗环境下的杀菌效率与剂量成正比。但是,如果让经过紫外线处理的细菌群体暴露于可见光,会有许多细菌存活下来。这里有两个值得注意的问题:①表明细菌有某种能为可见光激活的损伤修复系统,可以修复紫外线引起的损伤;②提示紫外线引起的细菌损伤本身或许并不一定是致死的。 微生物学的研究告诉我们,杀菌最有效的紫外线波段是260 nm,即DNA的吸收峰段。这就暗示我们紫外线诱变和杀菌作用的靶分子是DNA。研究表明,经紫外线处理的DNA会发生多种结构变异,其中最常见的是胸腺啶双聚体。对野生型细菌来讲,用强度为0.1 μJ/mm2紫外线处理,可在每个细菌基因组中产生6个胸腺 啶双聚体,双聚体中的2个嘧碱是以共价键牢固相连的。这是在一个DNA单链上,相邻的嘧啶通过化学共价键相连接的例子,其结果是引起DNA螺旋结构变形,并使胸腺嘧 啶与互补链上的腺嘌呤之间的氢键断裂。大肠杆菌的光复活基因phr(photoreactivation)编码的光裂合酶(photolyase)在可见光存在的条件下,可以识别双聚体引起的结构变形,并以可见光为能源把共价结合的嘧啶双聚体重新单体化,使紫外线引起的DNA结构损伤得以恢复,这个过程就是光修复,又叫光复活。细胞的光修复是一种无误修复(error-free repair)(图3-6)。
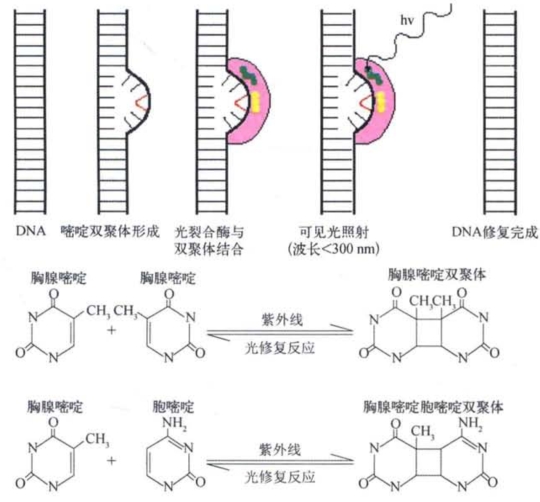
图3-6 嘧啶双聚体的形成和修复反应
除了光修复之外,细胞中还存在着暗修复系统。在研究紫外线对大肠杆菌的诱变作用时,曾经发现一种对紫外线特别敏感的突变型细菌。这种突变型菌在没有可见光的条件下,紫外线会诱发产生比野生型菌多得多的突变型细菌。这暗示野生型细菌在无可见光的条件下也具有某种修复功能,而上述对紫外线特别敏感的突变型菌实际上是某种暗修复功能的缺陷突变。这种突变称为紫外线修复(UV repair,uvr)缺陷突变,已知的这类酶有uvrA、uvrB和uvrC等。生物化学的研究证实,在黑暗环境中,野生型细菌的uvrA+和uvrB+、uvrC+一起编码的紫外线核酸内切酶(UV endonuclease)能在嘧啶双聚体所在的多核苷酸链的5′端上游8个碱基处切开磷酸二酯键,随之细胞中的核酸外切酶会依次切除受损链的单核苷酸,直至嘧啶双聚体3′端的第4或第5个核苷酸,使受损链出现12个左右核苷酸的缺口,然后DNA合成酶以互补链的相应片段为模板合成新的DNA链,最后由DNA连接酶连接修复后的链。突变型uvrA的功能缺陷发生于暗修复(又称切补修复)的第一步,即DNA单链切口形成阶段。整个切补修复涉及与切割、聚合和连接有关的多种酶系。切补修复是第二类DNA损伤修复系统(图3-7)。
在哺乳动物和人类中也存在着切补修复系统,它也是通过人类中的uvrA突变而发现的。最典型的例子是人着色性干皮症(xeroderma pigmentosum,XP)患者。取自XP患者的细胞对紫外线是高度敏感的,暴露于日光的皮肤易患皮肤癌。研究表明,各种XP患者细胞的缺陷都和uvr4、uvrB、uvrC等基因有关,已发现缺陷突变可分9个互补群,说明切补修复在人细胞中是一个多步骤的复杂反应。
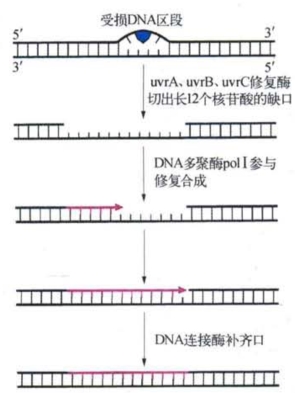
图3-7 切补修复过程示意
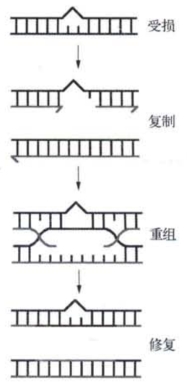
图3-8 单链受损时的重组修复示意
不久,又发现了第三种DNA损伤修复系统。人们发现大肠杆菌的重组缺陷突变型recA不但不能产生重组子,同时也是紫外线敏感的。这表明,某种损伤修复过程是和重组密切相关的(图3-8)。这种重组修复常常发生于正处于复制中的受损DNA分子,它虽然不能消除损伤,却能使DNA复制得以继续进行,并通过复制来降低受损DNA分子的相对数量,保存下来的受损部位将有可能通过后续的切补修复完全修复。图3-9形象地表明了DNA聚合酶、DNA修复酶和DNA重组酶缺陷突变型细菌对紫外线的敏感性。
在通常情况下,细胞以上述几种途径修复了大多数由物理或化学诱变剂引起的损伤,同时在修复过程中也会因错配、不等重组、合成差误而发生基因突变。然而,我们不妨设想一下,如果由于紫外线剂量过大,细胞的DNA分子上出现非常多的损伤,比如到了DNA双链分子的两股链在很短的距离内各出现一个嘧啶双聚体,从而使切补修复或重组修复过程中的DNA合成失去适当的模板,这时细胞会发生什么变化呢?显然,细胞因修复受阻而造成嘧啶双聚体等损伤结构迅速积累,细胞逐渐进入岌岌可危的境地。为了继续生存下去,细胞会动用一种由受损DNA片段诱导的紧急修复系统——SOS系统。与前面讨论的几种由组成酶来修复的过程不同,SOS系统是一个可诱导的系统,它为我们深入研究DNA损伤、修复和突变提供了难得的实验模型。
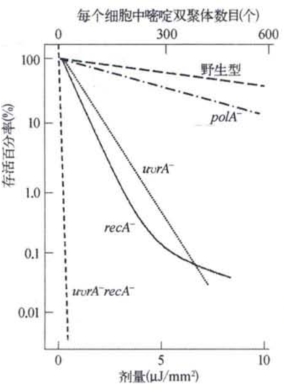
图3-9 多种修复酶缺陷突变型细菌对紫外线的敏感性(引自A.Sanca)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















