早在1948年J.莱德伯格就用伊红亚甲蓝琼脂培养基(EMB培养基,内含伊红黄、甲基蓝和乳糖)分离到许多不能发酵乳糖的突变菌Lacˉ。能够发酵乳糖的野生型菌Lac+在EMB培养基上生成的菌落呈暗红色,Lacˉ突变菌的菌落呈灰白色,这是很好的实验系统,它把一个生化性状转变为很容易识别的形态性状。但是,分析表明不能发酵乳糖的细菌,即表型为Lacˉ的细菌的遗传基础不一定是相同的。有些Lacˉ突变是由于β半乳糖苷酶的缺陷,称为LacZˉ突变。LacZˉ突变菌不能像Lac+菌那样使产色性底物O-硝基苯酚-β-半乳糖苷水解后产生O-硝基苯酚。但有些Lacˉ菌能水解这种产色性底物,说明这些细菌不是Zˉ突变菌。进一步分析表明Lacˉ可能起源于三种不同的基因突变:
LacZˉ,β半乳糖苷酶缺陷突变;
LacYˉ,半乳糖透性酶缺陷突变;
LaaAˉ半乳糖苷乙酰转移酶缺陷突变。
当然,在实验过程中也分离到了一些双重或三重突变型细菌。
不久,J.莱德伯格又发现了一种新的突变型,它不是乳糖发酵缺陷菌,而是有关乳糖发酵的三种酶的合成不再依赖于诱导物的存在。显而易见,这不是编码这三种酶的结构基因的突变,而是酶合成调控中十分重要的“诱导(induction)”特性的改变。从这种突变型细菌分离到的与乳糖发酵有关的三种酶的结构和功能都是正常的。这种突变菌定名为LacIˉ,它并不是编码酶的结构基因(structuregene)发生了突变,而是调节结构基因表达的基因发生了突变,所以它是调节基因(regulatorgene)突变菌,这种突变使细菌失去了“诱导”表型,原来的诱导酶成了组成酶,是一种组成型突变。
对于LacIˉ的性质也可以有两种可能的假设:一是LacIˉ突变细胞内有一种“固有的诱导物”;二是细胞内缺乏一种“活性抑制物”。为了解决这又一个“二中择一”的问题,帕迪(A.Pardee)、雅各布和莫诺一起做了一个判断性实验。
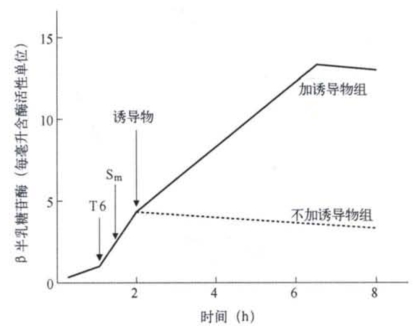
图1-27 在E.coli Lacl+Z+SmsT6sHfr与LaclˉZˉ SmrT6rFˉ杂交实验中,受体菌产生的部分合子的β半乳糖苷酶的合成和诱导物存在的关系(改自G.S.Stent)
接合前和接合期内培养基中不含诱导物,在供体LacI+Z+基因进入受体细胞后分别加入噬菌体T6和链霉素(Sm)以杀死供体细胞。不加诱导物的为对照组,实验组在供体细胞被杀死后加入诱导物。
他们用LacI+Z+细菌和LacIˉZˉ细菌做杂交实验(关于细菌杂交的本质、性因子F的结构和特性,以及高频F转导性质等都将在第2章中详细讨论。这里需要了解的是,F因子是一个能整合于细菌的环状DNA分子,并使环状DNA断裂,进而从供体细胞转移至受体细胞)。整个实验过程如图1-27所示,先将生长于无诱导物的培养基上的LacI+Z+Hfr(供体菌)和生长于同样培养基上的LacIˉZFˉ(受体菌)做接合杂交实验,观察杂交细胞是否有Z基因编码的酶产生。杂交前,培养基上没有诱导物,所以Lac I +Z+H fr菌不能产生酶,而LacIˉZˉFˉ突变菌虽是组成型突变,但因Zˉ突变而失去产生β半乳糖苷酶的能力。在杂交结合发生后1 h,Hfr菌的Z+基因进入Fˉ细胞,酶的合成就开始了,很快I+基因也进入Fˉ细胞,酶的诱导被阻抑而停止β半乳糖苷酶的合成;如果在这时加入诱导物,酶的合成又会迅速恢复,表明酶的合成又变为诱导型的了,即酶的合成又以诱导物的存在为前提了。
怎样用这个实验来回答刚才提出的“二中择一”问题?如果说LacIˉ细胞中有“固有的诱导物”,那么当Z+基因进入LacIˉ细胞后就应使β半乳糖苷酶的合成转为组成型。事实上,由于I+基因的进入而阻抑了Z+基因的表达。因此,莫诺等认为LacI+基因的产物是一种“能抑制遗传信息从结构基因传给蛋白质”的阻遏物。起先他们认为I+基因产生的阻遏物是一种RNA分子,后来因发现了LacI基因的温度敏感突变和琥珀型无义突变菌,才提出阻遏物是一种蛋白质。直到1967年,美国哈佛大学的吉尔伯特(W.Gilbert)和米勒希尔(B.Müller-Hill)才用实验证实I+基因的产物是一种阻遏蛋白。
要搞清阻遏物的性质,最好的办法是分离纯化并研究它的结构。但是大肠杆菌细胞中的阻遏物数量非常少,一般情况下,每个细胞只有10个分子,约占细胞蛋白总量的0.001%,提取这样微量的蛋白质几乎是不可能的。吉尔伯特和米勒希尔用两种方法来增加细胞中阻遏物的含量:一是选出一种LacIsq突变菌,这是调控I基因表达的突变型,这种突变使I基因表达加强,LacIsq细胞中阻遏物含量也因而增加;二是用噬菌体将Lac区段转导入LacIsq细胞,增加细胞内I基因的拷贝数。综合这两项措施,细胞中阻遏物的含量可达20 000个分子,占细胞蛋白总量的2%,为提取和纯化阻遏物创造了条件。
吉尔伯特和米勒希尔在上述细胞的提取液中,加入35S标记的IPTG,使之与阻遏物结合。然后把与IPTG结合且具有放射性的蛋白质分离纯化,并做分子量测定和动力学研究。结果表明阻遏物是一个分子量为37000的四聚体,每个单体有一个诱导物的结合位点,它和IPTG的解离常数为10-6 mol/L。
关于诱导现象还有一点必须注意,诱导物诱导细胞产生的不一定是有活性的酶。当细胞的β半乳糖苷酶基因发生突变后,很可能会合成一种没有酶的活性、却又能和β半乳糖苷r酶的抗体起反应的肽链,称为交叉反应物质(crossreaction material,CRM)。实验研究表明,当用诱导物IPTG处理大肠杆菌Lac Zˉ突变菌时,细胞会被诱导合成大量的CRM。所以在诱导过程中诱导物可以不是诱导酶作用的底物,诱导物诱导产生的也不一定是有活性的酶蛋白。这两种反应在化学上是“无故”或“无效”事件,但具有极为重要的生理学意义,它是生物机体在各种信号分子调节下成为自主、自律功能体的基础。活细胞并不完全服从化学规律。
在阐明LacI基因的产物(阻遏蛋白)性质的同时,人们还会提出一个新的问题:在没有诱导物时,阻遏蛋白是怎样同时抑制编码与乳糖发酵和利用有关的三种酶的结构基因表达的?或者说,阻遏蛋白的多效阻遏作用的靶标是什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















