2)命名法
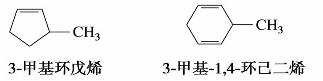
环烷烃的命名是在碳原子数相应的烷烃名称的前面加上“环”字,称为环某烷。环上有支链时,一般把支链作为取代基,环烷烃为母体。当环上有两个或者两个以上的烷基时,用1,2,3,…阿拉伯数字将环上的碳原子进行编号,并从简单的烷基开始,应使烷基的编号具有最小位次。例如:

环烯烃和环炔烃的命名是在相应的烯烃、炔烃名称前冠以“环”字,编号从不饱和碳原子开始,并通过不饱和键,使不饱和键和烷基的编号具有最小位次。例如:
练习3.2
1.请写出符合分子式为C5H10的环烷烃的各种同分异构体,并加以命名。
2.命名下列化合物或写出结构式。

螺环烃的命名是按环上碳原子总数称为“螺[ ]某烷”,方括号中分别用阿拉伯数字标出两个碳环上除螺原子外的碳原子数目,顺序是从小环到大环,数字之间用圆点“.”隔开。有取代基时,要将螺环编号,编号从小环邻接螺原子的碳原子开始,先编小环,通过螺原子绕到大环。例如:

桥环烃的命名根据组成桥环烃的环数用二环或三环…作为词头。词头后的方括号内按由多到少的次序用阿拉伯数字注明各桥所含碳原子数(要把桥头碳原子除外),各数之间用圆点分开。最后用相当于环上全部碳原子数的链烃名称作为词尾。环上如有取代基,可将环编号:从一个“桥头”开始,沿最长“桥”经第2个“桥头”到次长“桥”,再回到第1个“桥头”,最短的“桥”最后编号。例如:

练习3.3
1.两个碳环共用一个碳原子的环烃叫( ),共用的碳原子叫( )。
2.共用两个或以上碳原子的多环脂环烃叫( ),共用的碳原子叫( )。
3.命名下列螺环烃和桥环烃。
![]()
3.1.2 脂环烃的稳定性
脂环烃的稳定性与环的大小有关。三碳环结构最不稳定,四碳环比三碳环稍稳定,五碳环和六碳环都比较稳定,七碳环以上稳定性下降。
1885年拜耳(A.Von Baeyer)提出“张力”学说来解释这一现象。按照杂化轨道理论,环烷烃环上碳原子采用sp3杂化,相邻两个碳原子分别提供一个sp3杂化轨道形成C—Cσ键。但这种重叠不是直线的,C—C键是弯曲的,形似香蕉,如图3.1所示。

图3.1 环丙烷分子中碳—碳弯曲键
环丙烷中碳碳连接的直线之间的夹角为60°,这与环丙烷中C—C弯曲键之间的键角105.5°产生了偏差。环上碳原子是将sp3杂化轨道扭偏一定角度,产生了环张力,这种环称为张力环。环丙烷环张力大,最不稳定,易开环加成;而环丁烷环张力较小,比环丙烷稍稳定,不易开环加成。
环戊烷和环己烷,虽然成环的碳原子不完全在同一平面上,但C—C键之间的键角均接近109.5°,基本不存在张力,为无张力环,环较稳定,较难开环加成,而以环的取代反应为主。环戊烷碳骨架常以信封式结构存在,环己烷碳骨架常以船式或椅式结构存在,如图3.2所示。
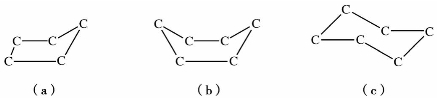
图3.2 环戊烷和环己烷的碳骨架结构
(a)信封式;(b)船式;(c)椅式
3.1.3 环烷烃的物理性质
常温下环丙烷、环丁烷为气体,环戊烷、环己烷为液体,高级的环烷烃为固体。
环烷烃不溶于水,相对密度小于1g/cm3,与其相应碳原子数的烷烃相比,相对密度大约20%,熔点、沸点也较高,沸点高出10~20℃。
3.1.4 环烷烃的化学性质
1)开环加成反应
(1)加氢
在催化剂如铂、镍等的存在下,环烷烃可以开环加氢,生成烷烃。例如:

环烷烃的环的大小不同,催化加氢的难易程度也不同。高级环烷烃一般不进行催化开环加氢反应。
(2)加卤素
小环环烷烃加卤素比加氢容易,环丙烷及取代环丙烷在常温下易与溴发生开环加成反应。溴与环丙烷作用溴的颜色褪去,可利用这一性质鉴定环丙烷。环丁烷在加热条件下与溴也能发生类似的开环加成反应。环戊烷、环己烷与溴不发生开环加成反应,在高温或光照下能发生卤代反应。例如:

(3)加卤化氢
环丙烷在常温下能与溴化氢或碘化氢发生开环加成反应。环丁烷需在加热条件下与溴化氢或碘化氢发生开环加成反应。例如:
![]()
含侧链的环丙烷与卤化氢加成时,开环发生在环上含氢最多和含氢最少的两个碳原子之间,并且卤化氢的加成遵循马氏规则。
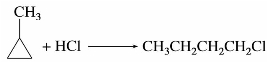
比较以上反应的条件,可以归纳出环烷烃开环加成反应的活性顺序为:
环丙烷>环丁烷>环戊烷>环己烷
由此可见,小环化合物,结构不稳定,五元环和六元环,结构较稳定。
练习3.4
1.下列哪种有机化合物经催化氢化以后能得到丁烷?( )
A.环丁烷 B.1-丁烯 C.2-甲基-1-丙烯 D.2-丁烯
2.五元环、六元环比三元环、四元环稳定是由于( )。
A.碳原子数多 B.环张力大 C.环张力小
3.在下列化合物中,哪种能使溴水的红棕色褪去?( )
A.丁烯 B.丙烷 C.环丙烷 D.环己烷
4.不能与HBr反应生成2-溴丁烷的化合物是( )
A.甲基环丙烷 B.1-丁烯 C.环丁烷 D.2-丁烯
5.马氏规则不适用于( )
A.烯烃的加成反应B.炔烃的加成反应
C.小环烷烃的开环加成反应D.取代反应
2)氧化反应
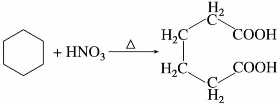
环烷烃不易开环被氧化,即使容易开环的环丙烷也不与高锰酸钾稀溶液发生氧化反应,由此可鉴别环烷烃和不饱和烃(如烯烃)。但在加热或用强氧化剂(如硝酸)或在催化剂的存在下用空气氧化环己烷也可被氧化开环。例如:
环烯烃、环炔烃等具有相应不饱和链烃的一般性质,这里不再讨论。
练习3.5
1.用化学方法鉴别下列各组化合物。
(1)丙烷和环丙烷 (2)丁烷、环丁烷和丁烯
2.下列化合物能使高锰酸钾紫色褪去的是( )。
A.丁烷 B.环丁烷 C.2-丁烯 D.环丙烷
3.1.5 环烷烃的构象
1)三元环、四元环、五元环构象
环烷烃的构象受环的刚性制约,环上每一个σ单键的旋转必定牵动其他σ单键一起转动。且重叠式构象存在的扭转张力同样是其中的不稳定因素。小环的构象变化很小,环丙烷的3个碳原子在一个平面上,构象只能有一个。环丁烷的四个碳原子偏离了同一个平面,在角张力、扭转张力的综合作用下,分子自然选择一种能量最低的状态。环戊烷受重叠式扭转张力影响,呈信封状。

2)六元环构象
六元环以十分稳定的构象存在。环己烷的椅式构象中,所有碳碳键夹角均为111°,与sp3杂化轨道夹角109.5°十分接近,基本上没有角张力。用Newman投影式表示这一构象,椅式构象中任意两个相邻碳的构象全部为交叉式,因此不存在扭转张力。

环己烷椅式构象存在两个相互平行的平面,即1-C、3-C和5-C组成的下平面以及2-C、4-C和6-C组成的上平面。以这两个平面为基准,垂直于平面的键,称为直立键(a键)。其余的键则平伏伸向环的两侧,称为平伏键(e键)。

环己烷的椅式构象可以翻转,a键和e键可以相互转化。

取代基在a键时,取代基与相隔一个碳的a键氢原子产生范德华斥力;取代基在e键时不存在这种范德华斥力使得分子更稳定。

练习3.6
画出1,4-二甲基环己烷的最稳定构象。
3.1.6 重要的脂环烃
1)金刚烷

金刚烷
金刚烷的碳架结构相当于是金刚石晶格网络中的一个晶胞,故得金刚烷这个名字。系统命名为三环[3.3.1.1(3.7)]癸烷,分子式C10H16,具有特殊的笼状结构。白色结晶粉末,溶于有机溶剂,不溶于水。有升华性,具有芳香味。本身具有抗病毒活性,其衍生物可用作药物,如1-氯基金刚烷盐酸盐和1-金刚烷基乙胺盐酸盐能防治由A2病毒引起的流行性感冒。
2)立方烷
立方烷
立方烷化学名为五环辛烷,分子式:C8H8,分子量:104.15,熔点103~131℃,为有光泽的晶体,8个碳原子对称的排列在立方体的8个角上。对热不稳定,200℃可分解。可由溴代环戊烯酮的二聚体经一系列复杂反应,最后从甲醇溶液中结晶析出;也可通过光化学反应合成;也可由环丁二烯与2,5-二溴对苯醌合成。
任务3.2 单环芳烃
芳香烃最初是从具有芳香气味的香树脂或香精油中发现的,故称芳香族化合物。根据结构分析,芳香族化合物是指大多数含苯环结构,性质具有芳香性的一大类化合物。芳香烃是芳香族化合物的母体,苯是单环芳烃中最典型的代表物。
3.2.1 苯的结构
苯的分子式为C6H6。1865年,凯库勒(Kekule)提出了苯的构造式,即苯分子是正六边形结构,3个碳碳双键和3个碳碳单键交替出现,苯分子中的6个碳原子和6个氢原子的地位分别是等同的。

根据杂化轨道理论,苯分子中6个碳原子都是sp2杂化,每个碳原子的3个sp2杂化轨道与相邻两个碳原子的sp2杂化轨道及氢原子的s轨道重叠,形成3个σ键(两个C—Cσ键和一个C—Hσ键)并且在同一平面上,键角120°。苯分子为平面正六边形结构,6个C—Cσ键和6个C—Hσ键在同一平面上,如图3.3所示。

图3.3 苯分子中σ键的形成示意图
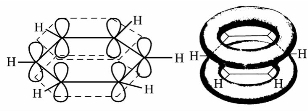
图3.4 苯分子中大π键示意图
每个碳原子还有一个未杂化的p轨道,垂直于σ键所处的平面。相邻两个p轨道之间“肩并肩”从侧面重叠形成具有6个π电子的闭合环状共轭大π键,也称芳香大π键。大π键电子云好像两个救生圈均匀地分布在苯环的上下,组成了苯环的闭合共轭体系,如图3.4所示。大π键电子云均匀分布,每个碳原子上的电子云密度和所有C—C键的键长完全相等,没有单双键之分,难以发生加成反应和氧化反应,却容易发生取代反应。而且,苯环上6个碳氢键(C—H)的地位也是相同的,苯的邻二卤代物只有一种。
现代文献常用![]() (中间的圆圈表示π电子云为一整体)表示苯的构造式,但是,由于沿用已久,习惯上教科书仍用
(中间的圆圈表示π电子云为一整体)表示苯的构造式,但是,由于沿用已久,习惯上教科书仍用![]() (凯库勒结构式)表示苯的构造式。
(凯库勒结构式)表示苯的构造式。
以苯为代表的芳香族化合物的特性叫芳香性。芳香性首先表现在,由于形成环状共轭体系而产生的特殊稳定性。在化学性质上的表现有:易于取代而不易加成和氧化,环不易破裂等。在结构上的表现有键长平均化。
3.2.2 单环芳烃的同分异构现象及命名
1)同分异构现象
苯和烷基苯的通式为C nH2n-6(n≥6)。单环芳烃的异构现象包括苯环上侧链的位置异构和侧链的碳架异构。
简单的一烷基苯没有构造异构体,当取代基含有3个或3个以上的碳原子时,可产生异构体,例如:

当苯环上连有两个或两个以上取代基时,可产生多种异构体,例如:

2)命名
(1)烷基苯的命名
①简单的烷基苯命名时,苯作为母体,烷基看作取代基。
一元烷基苯命名为某烷基苯。
二元烷基苯的命名,分别用邻或1,2-;间或1,3-;对或1,4-表示苯环上两个烷基的相对位置。例如二甲苯的3种同分异构体的命名。

三元烷基苯的命名,当苯环上3个烷基相同时,常用连、偏、均分别表示3个烷基的相对位置,或用阿拉伯数字编号,分别1,2,3-、1,2,4-、1,3,5-表示。例如,三甲苯的3种同分异构体的命名如下:

当苯环上3个烷基不同时,则必须用阿拉伯数字编号,从最简单的烷基开始,且使取代基位次和较小。此外,二元、三元烷基苯的命名,当其中有一个烷基为甲基时,也可以甲苯作为母体进行命名。例如:

②复杂芳烃的命名,可把苯基看作取代基,烷烃为母体。苯代不饱和脂肪链烃的命名也把苯基当作取代基,不饱和链烃为母体。例如:

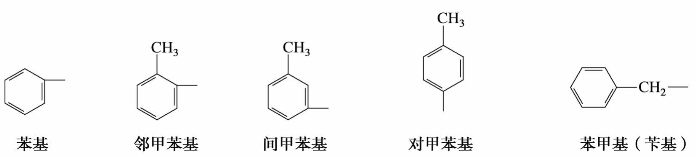
(2)芳基的命名
芳基用Ar-表示,是指芳烃分子(ArH)芳环上去掉一个氢原子后剩下来的基团。苯基也可以写成C6H5—、Ph或。甲苯分子中苯环上去掉一个氢原子后有3种异构体。甲苯分子侧链上去掉一个氢原子后称为苯甲基或苄基。例如:
练习3.7
试写出符合分子式为C9H12的单环芳烃的同分异构体,并命名。
3.2.3 单环芳烃的物理性质
苯及其同系物多数为无色液体,不溶于水,而易溶于乙醇、乙醚等有机溶剂。相对密度为0.68~0.9。蒸气有毒,使用时要注意防护措施。易燃,火焰带黑烟。苯、甲苯等是良好的有机溶剂。
在苯的同系物中,每增加一个“CH2”单位,沸点平均升高30℃左右。同碳数的各种异构体中,沸点相差不大。结构对称性好的具有较高熔点。
3.2.4 苯及其同系物的化学性质
苯及其同系物的化学性质具有芳香性,表现为易取代,难氧化和难加成的性质。
1)取代反应
(1)卤代反应
在催化剂(铁粉或三卤化铁等)存在下,苯环上的氢原子被卤原子取代生成卤代苯。常见的卤代反应有氯代反应和溴代反应。

苯的同系物与卤素发生卤代反应时,反应条件不同,卤代反应发生的位置也不同。甲苯在以铁粉或三卤化铁为催化剂时,比苯容易发生卤代反应,而且卤代反应发生在苯环上,生成邻卤代甲苯和对卤代甲苯两种主要产物。例如:
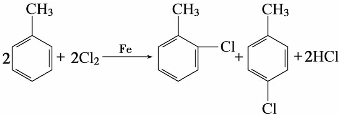
甲苯在光照或加热条件下,卤代反应发生在苯环的侧链上,优先取代侧链的α-H。例如:
由此可见,反应条件不同,产物也就不同。烷烃的苯环卤代反应属于离子型的亲电取代反应;烷烃的侧链卤代反应属于游离基型的取代反应。
(2)硝化反应
苯与浓硝酸、浓硫酸的混合物(通常称为混酸)共热至50~60℃,苯环上的氢原子被硝基(—NO2)取代生成硝基苯,称为硝化反应。
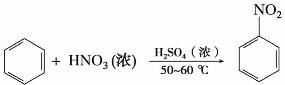
硝基苯能继续硝化,但比苯困难,需在较高的条件下,才能反应得到间二硝基苯。
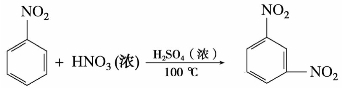
苯的同系物如甲苯的硝化比苯容易,在20~30℃温度下,反应得到邻硝基甲苯和对硝基甲苯两种主要产物。

甲苯若在较高的温度100℃下,与硝-硫混酸作用则生成2,4,6-三硝基甲苯,俗称TNT,是一种烈性炸药。

(3)磺化反应
芳烃与浓硫酸作用,加热至70~80℃,苯环上的氢原子被磺酸基(—SO3H)取代生成苯磺酸,称为磺化反应。

甲苯磺化在室温就可以进行。

磺化反应是一个可逆反应。当苯磺酸加水煮沸或与稀硫酸共热时可水解脱去磺酸基生成苯和硫酸。苯磺酸是一种结晶性固体,酸性强似硫酸,易溶于水。因此,常常利用磺化反应在有机物或药物中引入磺酸基以增大其水溶性。
练习3.8
1.写出乙苯在下列条件下发生溴代反应的方程式。
(1)有铁粉时 (2)光照时
2.写出乙苯的磺化反应方程式。
(4)傅瑞德-克拉福茨反应(傅-克反应)
在无水三氯化铝(AlCl3)催化下,苯环上的氢原子被卤代烷(R—X)中的烷基(R—)取代生成烷基苯,称为傅-克烷基化反应;苯环上氢原子被酰卤(RCOX)和酸酐[(RCO)2O]中的酰基(R—CO—)取代生成芳香酮,称为傅-克酰基化反应。例如:

3个碳原子的卤代烷发生傅-克烷基化反应时,常因异构化而得到不止一种产物。例如:

除无水三氯化铝外,三氯化铁、四氯化锡、氟化硼、氯化锌等也可作为傅-克反应的催化剂。傅—克烷基化反应是向芳烃上引入烷基得到烷基苯的方法之一,烯烃、醇也常用作烷基化试剂。除了酰卤外,酸酐、酯、羧酸等也可以作为酰基化试剂。
(5)苯环亲电取代反应历程
苯环上所发生的取代反应多数是亲电取代反应,即由正离子或带有部分正电荷的亲电试剂(E+)进攻苯环引起。反应历程是E+进攻苯环,生成不稳定的中间体σ-配合物,这个过程中碳原子由sp2杂化转变为sp3杂化,E与碳原子形成新的σ键,破坏了原来苯环稳定的共轭体系。然后σ-配合物分解,苯环上碳氢σ键(C—H)减弱,氢以H+形式离去,生成取代苯。
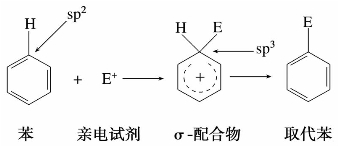
例如苯的硝化反应历程为:
a.硝酸在催化剂浓硫酸的作用下,产生亲电试剂(硝酰正离子或称硝基正离子 )。
)。
![]()
b.硝酰正离子(或硝基正离子)NO+2进攻苯环,生成不稳定σ-配合物。

c.σ-配合物分解,得到硝基苯。

2)氧化反应
苯环结构稳定,常温常压下不被酸性高锰酸钾氧化。含侧链的烷基苯,受苯环影响,α-H变得比较活泼,易被氧化。在酸性高锰酸钾条件下,侧链被氧化成羧基。例如:
![]()
但是,烷基苯的侧链不含α-H时,侧链不发生氧化。

根据氧化反应产物,可以确定苯环上的侧链(烷基)数目,同时根据硝化反应产物的结构,可以确定苯环上侧链的相对位置。两者综合起来,可用于推测烷基苯的结构。
苯环在强烈的条件下如高温以及催化剂作用下,也可以被氧化,使苯环开裂,生成顺丁烯二酸酐。

练习3.9
举例讨论:
苯、甲苯和硝基苯的硝化反应因反应物的不同,反应的难易会不同,反应的产物也不相同。
3)加成反应
(1)加氢
在催化剂(如镍)、高温、高压条件下,苯可以与氢气发生加成反应,生成环己烷。

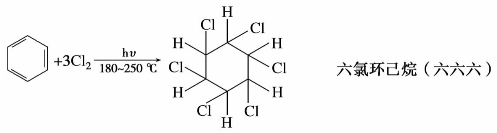
(2)加氯
苯在紫外光照射下与氯气作用,得到六氯环己烷。
练习3.10
完成下列反应式。

3.2.5 苯环上取代反应的定位效应
通过对硝化反应条件和产物的比较,可见苯环的取代反应有如下特点:
①甲苯硝化比苯容易,硝基进入甲基的邻、对位,得到邻硝基甲苯和对硝基甲苯两种主要产物。
②硝基苯硝化比苯困难,硝基进入原来硝基的间位,得到间二硝基苯一种主要产物。
由此可见,苯环上原有的基团能决定苯环取代反应的难易,并对新引入的基团进入苯环的位置起支配作用,这种规律叫做定位规律或定位效应,苯环上原有的基团叫做定位基。受定位基的影响,苯环上各个碳原子的电子云密度不再均匀化,亲电试剂进攻苯环碳原子各位置的机会也不再均等。苯环上碳原子电子云密度越高越有利于亲电取代反应;反之,越不利于亲电取代反应。亲电试剂主要进攻苯环上电子云密度较高的碳原子。苯环上定位基分为邻、对位定位基和间位定位基两大类。
1)邻、对位定位基
邻、对位定位基是指主要使新引入基团进入其邻、对位,且邻、对位产物含量之和达到60%以上的定位基。常见的邻、对位定位基定位效应按下列顺序依次减弱:—NR2,—NHR,—NH2,—OH,—OR,—NHCOR,—OCOR,—CH3(—R),—X(卤素)等。这类定位基中直接与苯环相连的原子不含双键或叁键,且多数含有未共用电子对。除卤素外,其他的定位基均能活化苯环,使苯环电子云密度增加,亲电取代反应容易进行。
①甲基。甲基中的σ键与苯环的闭合环状共轭大π键重叠,形成σ-π超共轭效应,σ键电子云向苯环离域,甲基产生给电子的共轭效应(+C),使苯环上碳原子的电子云密度增高,活化苯环。并且使苯环电子云沿苯环共轭体系传递,邻、对位碳原子的电子云密度比间位增高得较多,亲电试剂主要进攻苯环的邻、对位,如图3.5所示。其他烷基如CH3CH2—、CH3CH2CH2—、(CH3)2CH—的情况与—CH3相类似。

图3.5 甲基与苯环的σ-π共轭体系示意图

图3.6 羟基与苯环的p-π共轭体系示意图
②酚羟基。一方面,氧原子的电负性强于碳原子,酚羟基产生吸电子的诱导效应(-I),使苯环上碳原子的电子云密度降低;另一方面,酚羟基氧原子上的未共用电子对与苯环闭合环状共轭大π键构成p-π共轭体系,产生给电子的共轭效应(+C),氧原子上未共用电子对通过共轭效应向苯环离域,增加了苯环上碳原子的电子云密度。由于酚羟基+C-I,给电子性的共轭效应占优势,起决定作用,总的趋势还是使苯环活化,而且邻、对位碳原子的电子云密度较间位增高得多一些,亲电试剂主要进攻酚羟基的邻、对位,见图3.6。其他的基团如—NH2、—OCH3、—NHCOCH3的情况与—OH相类似。
2)间位定位基
间位定位基是指主要使新引入基团进入其间位,而且使间位产物含量达到40%以上的定位基。常见的间位定位基定位效应按下列顺序依次减弱: ,—NO2,—SO3H,—CHO,—COR,COOH等。这类定位基中与苯环相连的原子一般都含双键或叁键,或带有正电荷,能钝化苯环,使苯环电子云密度降低,取代反应难以进行。
,—NO2,—SO3H,—CHO,—COR,COOH等。这类定位基中与苯环相连的原子一般都含双键或叁键,或带有正电荷,能钝化苯环,使苯环电子云密度降低,取代反应难以进行。
如图3.7所示,一方面,硝基产生吸电子诱导效应(—I);另一方面,硝基的氮氧π键与苯环闭合环状共轭大π键重叠形成π-π共轭体系,由于氮和氧的电负性均大于碳,硝基产生吸电子的共轭效应(—C)。硝基—I和—C的协同作用使苯环上碳原子的电子云密度都降低,钝化苯环,间位碳原子电子云密度比邻、对位降低得少,亲电试剂主要进攻硝基的间位,得到的主要产物是间位取代物。其他基团如—SO3、—CN、—COOH的情况与—NO2相类似。

图3.7 硝基与苯环的π-π共轭体系示意图
3)二元取代苯的定位规律
①两个取代基定位效应一致,第3个取代基进入的位置由原取代基共同决定,例如:

②两个取代基定位效应不一致,其中一个是邻、对位定位基,另一个是间位定位基时,第3个取代基进入的位置主要由邻、对位定位基决定,例如:

③两个取代基定位效应不一致,而它们属于同一类定位基时,第3个取代基进入的位置主要由定位效应强的取代基决定,例如:

④空间位阻。当苯环上的两个取代基互为间位时,由于空间位阻,第3个取代基进入前两个取代基中间的产物一般比较少,例如:

练习3.11
将下列化合物进行一次硝化,试用箭头表示硝基进入的位置(指主要产物)。

4)定位规律的应用
由苯合成间硝基溴苯时,若先溴化再硝化时得到邻硝基溴苯和对硝基溴苯。若先硝化再溴化,则得到间硝基溴苯。所以合成路线应为:

由甲苯为原料合成间硝基苯甲酸应考虑先氧化,后硝化。合成路线为:

若合成邻硝基苯甲酸或对硝基苯甲酸,则顺序相反。

由对二甲苯合成2-硝基对苯二甲酸时,先氧化和先硝化都可以得到目标化合物。但路线Ⅱ中,有两个致钝基团的对苯二甲酸硝化需要有发烟硝酸、发烟硫酸和很高的温度,且收率低,对设备腐蚀性大,难于工业化。而路线Ⅰ中含两个致活基团的对二甲苯硝化时在稀硝酸和室温下就能反应,且收率高,反应条件温和,是最佳的工业化路线。

3.2.6 重要的单环芳烃
1)苯
苯来源于炼焦工业中,从焦炉气和煤焦油中获得。现在苯主要由石油的铂重整获得。
苯是无色、易燃、易挥发的液体。熔点5.5℃,沸点80.1℃,相对密度0.879,不溶于水,易溶于乙醇、乙醚等有机溶剂。具有特殊气味,其蒸气有毒,苯的蒸气与空气能形成爆炸性混合物,爆炸极限为1.5%~8.0%(体积分数)。
苯是重要的化工原料之一,它广泛用来生产合成纤维、合成橡胶、塑料、农药、医药、染料和合成洗涤剂等。苯也常用作有机溶剂。
2)甲苯
甲苯一部分来自煤焦油,大部分从石油的铂重整获得。
甲苯是无色、易燃、易挥发的液体。沸点110.6℃,相对密度0.867,不溶于水,易溶于乙醇、乙醚等有机溶剂。具有与苯相似的气味,其蒸气有毒。蒸气与空气形成爆炸性混合物,爆炸极限为1.2%~7.0%(体积分数)。
甲苯是重要的化工原料之一,它主要用来制造三硝基甲苯(TNT),苯甲醛和苯甲酸等重要物质。甲苯可用作溶剂,也可直接作为汽油的组分。
工业上生产苯乙烯是由乙苯经侧链脱氢而得。
苯乙烯为无色、易燃液体,沸点145.2℃,相对密度0.906,难溶于水,溶于乙醇和乙醚。苯乙烯有毒,在空气中的允许浓度在0.1 mg/L以下。苯乙烯易聚合成聚苯乙烯。故生产和贮存时间加阻聚剂(如对苯二酚)以防止其聚合。
苯乙烯主要用于合成聚苯乙烯塑料、丁苯橡胶、ABS工程塑料和离子交换树脂等。
任务3.3 多环芳烃和非苯系芳烃
多环芳烃是指含两个或两个以上苯环的芳烃。根据苯环的连接方式不同,多环芳烃分为联苯和联多苯类、多苯代脂肪烃类和稠环芳烃类。
3.3.1 联苯和联多苯类
苯环间以σ键连接而成的化合物称为联苯。联苯分子中苯环上碳原子的编号如下。联苯类衍生物及联多苯类化合物都是以联苯为母体来命名。

3.3.2 多苯代脂肪烃
多苯代脂肪烃类指由若干个苯环取代脂肪烃中的氢原子而形成的化合物。此类化合物以苯基作为取代基,脂肪烃为母体来命名。例如:

上述两类化合物的结构和性质与单环芳烃相似。
3.3.3 稠环芳烃
稠环芳烃是指由两个或两个以上苯环共用两个相邻碳原子稠合而成。
1)萘
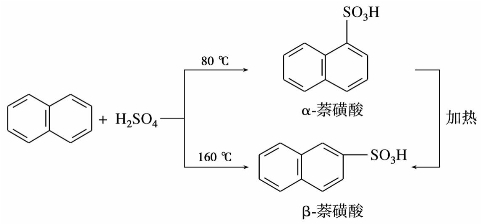
萘是煤焦油中含量最多的化合物,在高温煤焦油中含萘约10%。萘的分子式为C10H8,它是两个苯环共用相邻两个碳原子稠合而成。萘的构造式和环上碳原子的编号如下,其中1、4、5、8位碳原子相同,称为α位;2、3、6、7位的碳原子相同,称为β位。

萘的结构中,每个碳原子用3个sp2杂化轨道与其他3个原子形成σ键。每个碳原子p轨道的对称轴都垂直于σ键所在的平面,p轨道彼此侧面交盖,形成了一个闭合环状共轭体系。每个碳原子上的电子云密度不同,其中α位的电子云密度比β位高。萘比苯易发生取代、氧化和加成反应,取代反应主要发生在α位。
萘为白色片状晶体,熔点80℃,沸点218℃,不溶于水,易溶于热的酒精、乙醚等有机溶剂。易挥发,易升华,有特殊气味。
萘的化学性质与苯相似,可以发生下列反应:
(1)取代反应
萘比苯易发生卤代、硝化、磺化等取代反应,反应主要发生在α位。
①萘比苯易发生卤代反应,一般不需要催化剂,萘就能与溴作用得到α-溴萘。

②萘比苯易发生硝化反应,在室温下,萘与硝-硫混酸作用得到α-硝基萘。

③萘与浓硫酸发生磺化反应时,温度不同,产物也不同。在低温下主要产物为α-萘磺酸;在较高温度下,则磺化反应的主要产物为β-萘磺酸。
(2)氧化反应
萘容易被氧化,随反应条件不同生成不同的氧化产物,例如:

有止血作用的维生素K1、K2、K3是1,4-萘醌的重要衍生物。
(3)加成反应
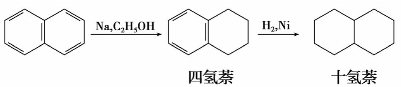
萘比苯易发生加成反应。萘的不饱和性比苯显著,可以发生部分或全部加氢。在催化剂镍或铂存在下,萘加氢可得到四氢化萘或十氢化萘。
2)蒽
蒽存在于煤焦油中,含量约为0.25%。蒽的分子式为C14H10,它由3个苯环稠合而成。蒽的构造式和环上碳原子的编号如下,其中碳原子的1、4、5、8位相同,称为α位;碳原子的2、3、6、7位相同,称为β位;碳原子的9、10位相同,称为γ位。

蒽的结构与萘相似。蒽分子中碳原子的电子云密度和碳碳键的键长也不完全相等。9、10位碳原子的电子云密度最高,9、10位最活泼。
蒽的化学性质与萘相似,但比萘易发生取代、氧化和加成反应。其中以氧化反应最为重要,反应主要发生在9、10位。

醌类化合物常有颜色,9,10-蒽醌是合成蒽醌类染料的中间体;某些天然色素如茜草素也含有蒽醌结构。中药中有致泻作用的大黄的有效成分大黄酚、大黄酸是9,10-蒽醌的衍生物。
3)菲
菲也是存在于煤焦油中。菲的分子式为C14H10,与蒽互为同分异构体。菲分子结构中3个苯环不在一直线上,为角式稠合。菲的构造式和环上碳原子的编号如下:

菲的结构与蒽相似,化学性质介于萘和蒽之间,9,10位比较活泼。

菲醌是一种农药,可防止小麦莠病、红薯黑斑病。
菲也可以与氢发生加成反应,全氢化菲合并环戊烷又叫甾烷,它的衍生物如胆甾醇等天然化合物都含有甾烷这种结构。

4)其他稠环芳烃
芳烃主要来自煤焦油,其中可分离出稠环芳烃,如茚、芴和苊是脂环和芳环相稠和的芳烃;四苯、芘等是高级稠环芳烃。

此外,还有显著致癌作用的稠环芳烃,简称为致癌烃,它们都是蒽或菲的衍生物,例如:

熏制品、汽车排出的废气、香烟,还有高温烧焦的食物中,1,2-苯并芘含量较高,长期接触或食用,容易致癌。
3.3.4 非苯系芳烃
苯是一个闭合环状共轭多烯体系,苯系芳烃都含有苯环,具有芳香性。1931年休克尔提出了一个判断芳香性体系的规则:在环状共轭多烯化合物中,π电子的数目符合4n+2(n为0,1,2,3,…,即电子数为2,6,10,14,…)的体系就具有芳香性。这个规则普遍适用于平面单环多烯体系。对于稠环芳烃如萘、蒽、菲,由于构成它们结构的所有碳原子均处于同一平面上,且π电子数分别为10、14和18,符合休克尔规则,因此具有芳香性。
芳烃中除苯系芳烃外,还有非苯系芳烃。它们不含苯环,但符合休克尔规则,有芳香性。
1)环戊二烯负离子
环戊二烯分子没有芳香性,而环戊二烯负离子中亚甲基碳的p轨道与两个π键组成环状共轭多烯体系,且π电子数为4+2=6个,符合休克尔规则,具有芳香性。

2)奥
奥是由五元环和七元环稠合而成的,是具有10个π电子数的环状共轭多烯体系,环系中的碳原子都在同一平面上。因此奥符合休克尔规则,具有芳香性,其构造式如下所示。
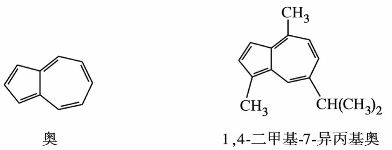
奥为蓝色固体,熔点99℃,是一种典型的非苯系芳烃。像苯、萘一样,能发生芳烃具有的硝化反应和烷基化反应等取代反应。奥没有萘稳定,容易异构化而变成萘。
奥的主要衍生物1,4-二甲基-7-异丙基奥叫愈创木奥,也称愈创蓝油烃,是治疗烧伤、烫伤和冻疮的药物。
练习3.12
1.芳香烃从结构上是否含有苯环可分为( )和( )。
2.休克尔提出一个判断芳香体系的规则:在( )化合物中,( )电子数目符合( )的体系就具有芳香性。
3.判断下列化合物是否具有芳香性?
一、脂环烃
1.命名下列各化合物。

2.写出下列化合物的构造式。
(1)1-甲基-4-异丙基环己烷 (2)1,1-甲基环丁烷 (3)1-氯-2-溴环己烷
(4)3-异丙基环己烯 (5)环戊基环戊烷 (6)1,4-二甲基环己烷
3.完成下列反应。

4.有一化合物分子式为C4H8,能和HI及Br2(室温)发生加成反应,但不能使冷的高锰酸钾溶液褪色。写出该化合物的可能构造式。
5.用化学方法区别下列各组化合物。
(1)丙烷、丙烯、环丙烷 (2)1,2-二甲基环丙烷、环戊烷和戊烯
(3)环己烷、环己烯、己炔
6.A、B两个异构体的分子式为C5H10,溴与A反应得到C5H10Br,溴与B反应得到C5H10Br2;A氧化后得到一个羧酸C5H10O4,而B氧化后得到醋酸的混合物,试写出A与B的构造式及上述反应的方程式。
7.分子式为C4H6的3个异构体A、B和C能发生如下的化学反应:
(1)3个异构体都能与溴发生反应,且B、C反应的溴量是A的两倍;
(2)三者都能与HCl发生反应,而B、C在Hg2+催化下与盐酸反应得到同一种化合物;
(3)B和C能迅速地和含HgSO4的硫酸溶液作用,得分子式为C4H8O的化合物;
(4)B能和Ag(NH3)2NO3作用生成白色沉淀。
试推测化合物A、B和C的结构,并写出有关的方程式。
二、芳香烃
1.用系统命名法命名下列化合物。

2.在下列化合物中,若发生亲电取代(如硝化)反应,取代基容易导入环上哪个位置,请用箭头表示出来。

3.写出甲苯与下列试剂作用的反应式。
(1)浓H2SO4 (2)浓HNO3,浓H2SO4 (3)CH3CH2Cl
(4)Cl2/FeCl3 (5)KMnO4/加热 (6)CH3COCl/无水AlCl3
4.单环芳烃在高锰酸钾酸性溶液中加热氧化,根据氧化得到的产物,试推测原来芳烃结构。

5.用化学方法鉴别下列化合物。
(1)苯、苯乙烯、苯乙炔、环己烷 (2)环己烯、苯、乙苯
(3)苯、甲苯、1,3-丁二烯、1,3-丁二炔
6.试将下列各组化合物对亲电取代反应的活泼顺序进行排列。
(1)苯、甲苯、对二甲苯、甲苯 (2)苯胺、苯、硝基苯、甲苯
(3)对苯二甲酸、苯、对甲苯甲酸、苯甲酸 (4)甲苯氯苯、2,4-二硝基氯苯、苯酚
7.A、B、C 3种芳烃分子式为C9H12,氧化时A生成一元羧酸,B生成二元羧酸,C生成三元羧酸。但硝化时A与B分别得到两种主要一元硝化产物,而C得到一种硝化产物。试推测A、B、C的构造式。
8.A的分子式为C9H8,它能和氯化亚铜氨溶液反应生成红色沉淀,A经催化加氢得到B,分子式为C9H12,B用酸性重铬酸钾溶液氧化得到酸性化合物C,分子式为C8H6O4。再将C加热得到D,分子式为C8H4O3。试写出化合物A、B、C、D的构造式及各步反应方程式。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















