第六节 蛋白质相互作用的研究方法
蛋白质相互作用存在于机体每个细胞的生命活动过程中,生物学中的许多现象如复制、转录、翻译、剪切、分泌、细胞周期调控、信号转导和中间代谢等均受蛋白质相互作用的调控。由于蛋白质间相互作用具有如此重大的意义,因此,其检测方法的研究也备受重视。由生化方法,如蛋白质亲和层析(protein affinity chromatography)、亲和印迹(affinity blotting)、免疫沉淀(immunoprecipitation)及交联(cross-linking),发展到当今的分子生物学方法,如以基因文库为基础的蛋白质探测(protein probing)、噬菌体显示(phage display)及双杂交系统(two-hybrid system)等。另外,还发展了可定性和定量检测蛋白质间相互作用的简便又快捷的方法,如表面胞质团共振(surface plasmon resonance)等。通过这些方法的联合使用,由实验得出的蛋白质间相互作用的结论显得更为可靠。
现将蛋白质相互作用研究方法总结如下,在具体实验中可以根据需要选择合适的方法进行分析。
1.细菌双杂交系统:在原理上与酵母双杂交系统相同(图3-16)。通过将研究的目的蛋白质分别与DNA结合域与活化域融合,利用蛋白质之间的相互作用,使得活化域与DNA结合域结合,从而调控报告基因的表达。报告基因的表达可以通过生化或者遗传学的方法进行检测。
该方法是继酵母双杂交系统和哺乳动物双杂交系统之后,产生的另一种直接与细胞内检测蛋白质相互作用的遗传性新方法。这种方法的优点是研究周期短,操作简单,能够产生容量更大的文库,同时假阳性率和假阴性率均较低。此外,对于一些真核的蛋白质可能对酵母细胞产生毒害,但是在细菌中将会降低这种可能性。
具体操作方法见实验手册: BacterioMatch II.Two-Hybrid System XR Plasmid cDNA Library Instruction manual。
2.酵母双杂交系统:一种在酵母细胞内分析蛋白质相互作用的技术。实验原理见本节实验三十一和图3-17。

图3-16 细菌双杂交系统的构建和原理图谱
(http://www.genomics.agilent.com/files/Manual/982000.pdf)
3.GST PULL-DOWN:通过与GST融合蛋白相互作用从可溶性蛋白质库中亲和纯化一个未知蛋白质,再通过GST与谷光苷肽偶联球珠的结合收集相互作用蛋白质,从而分离出蛋白质复合物(图3-18)。
4.体内共表达-共纯化:在原理上与GST PULL-DOWN类似。将要鉴定的两个基因分别克隆到两个含有不同标签的载体中,然后在大肠杆菌中共表达,可以采用类似GST-PULL-DOWN的方法鉴定他们之间的相互作用。
5.免疫共沉淀:当细胞在非变性条件下裂解时,完整细胞内许多蛋白质之间的结合保持下来,因而,可以据此检测生理条件下

图3-17 酵母双杂交系统原理图谱
相关蛋白质间的相互作用。如果蛋白质X用其抗体免疫沉淀,在细胞内与X稳定结合的蛋白质Y也可能沉淀下来。蛋白质Y的沉淀是基于与X的物理相互作用,被称为免疫共沉淀(图3-19,本节实验三十二)。
6.SPR技术:表面等离子体共振技术是研究蛋白质之间相互作用的一种全新的技术手段。该技术利用表面等离子体共振现象和SPR谱峰对金属表面上电介质变化敏感的原理,将受体蛋白固定在金属膜上,检测受体蛋白与液相中配体蛋白的特异性结合。SPR技术为蛋白质组研究开辟了全新的模式,其特点是测定快速、安全、

图3-18 GST PULL-DOWN实验原理和流程图
不需标记物或染料,灵敏度高,最重要的是能在保持蛋白质天然状态的情况下实时提供靶蛋白的细胞器分布、结合动力学及浓度变化等功能信息。SPR技术除应用于检测蛋白质间的相互作用外,还可检测蛋白质与核酸及其他生物大分子之间的特异性相互作用。
7.噬菌体展示技术:将编码噬菌体外壳蛋白的基因上连接一个单克隆抗体的基因序列。当噬菌体生长时,表面就会表达出相应的单抗。将噬菌体过柱,检测单抗与柱上目的蛋白的特异性结合。噬菌体展示技术具有简便、高通量的优点。噬菌体文库中的编码蛋白均为融合蛋白,可能改变了天然蛋白质的结构和功能,其体外检测的相互作用可能与体内不符。
8.荧光共振能量转移(fluorescent response energy transfer):该方法是比较分子间距离与分子直径的有效工具,可以定量测量两个

图3-19 免疫共沉淀技术的原理
发色基团之间的距离,在蛋白质空间构象、蛋白质相互作用、核酸与蛋白质相互作用以及其他分子间距的研究领域得到了广泛应用。
将待分析的两种蛋白质分别与CFP和YFP构建成融合表达蛋白。构建好的质粒可以转入植株中,也可以转入细胞系中进行分析。CFP的激发波长是442nm,发射波长是480nm;而YFP的激发波长为480nm,发射波长为530nm。如果两个待测蛋白质相互作用,使两种融合蛋白的距离接近,导致CFP的发射波长可以激发YFP,在荧光显微镜442nm激发波长下,可以检测到YFP的荧光(图3-20)。
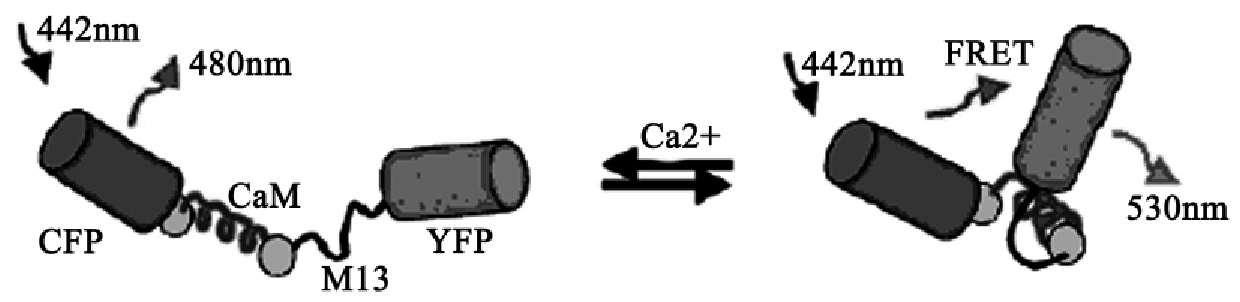
图3-20 FRET的基本原理
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















