15.3.4 微生物SOD的制备技术
15.3.4.1 酵母SOD的制备技术
(1)酵母SOD菌种的培养。采用15L发酵罐,培养条件为:6%白糖、1%酵母膏、1%蛋白胨,pH为7.0,搅拌速度50r/min,发酵时间为24h。
(2)SOD的释放。离心收集湿菌体,按异丙醇∶湿菌体为9∶1(体积∶质量)用异丙醇浸泡菌体120min。抽滤除去溶剂,加入3倍体积的50mmol/L的磷酸钾缓冲液(pH为7.0),搅拌120min,离心除去菌体即可得到SOD释放液。利用异丙醇浸泡酵母可选择性地释放SOD,其释放率达89%,纯化20倍以上,与传统的细胞破碎方法(如机械法及超声法)相比具有以下优点:①不需要低温或高压等复杂设备;②菌体分离容易,由于没有整体破碎细胞,在5 000r/min离心后上清液浊度比机械法破碎的上清液浊度低2倍;③可以选择性地释放,对SOD具初步纯化作用;④成本较低,浸泡菌体所用的异丙醇可回收后再次使用。
(3)中空纤维超滤浓缩SOD。用聚丙烯腈(PAN)中空纤维膜(截断相对分子质量6.0万)将SOD释放液浓缩1倍,回收率约为90%。
(4)SOD分级沉淀。将上述浓缩液用2.0mol/L盐酸调节pH至5.0,加入0.8倍体积丙酮,搅拌均匀后,5 000r/min离心除去沉淀蛋白。当pH为7.0时,加入1.5倍体积的丙酮,SOD回收率仅65%。酵母SOD等电点在4.0左右,而多数杂质蛋白的等电点在pH为4.0~5.0,因而采用降低pH至5.0来改善丙酮沉淀效果。
(5)在上清液中继续加入0.3倍体积丙酮,同法进行二次沉淀。再次用0.3倍体积丙酮,可使上清液中的SOD全部沉淀。离心收集沉淀可得纯化的SOD产物。该法工艺步骤少,操作简单,最终SOD回收率可达66%,比活约4 000u/mg蛋白(连苯三酚自氧化法测定)。
15.3.4.2 钝顶螺旋藻Fe-SOD的纯化方法
将冷冻螺旋藻溶于50mmol/L的pH为7.8的磷酸盐缓冲液中,进行超声波破碎(3min,而后1 000r/min冷冻离心10min,取上清液得粗酶液,粗酶液经35%~90%硫酸铵分级沉淀。沉淀溶解透析后上DE-FF柱进行梯度洗脱,操作在4℃下进行。接着再上CM-52柱,柱预先用pH为5.5、0.01mol/L HAc缓冲液平衡,上柱后用pH为7.8、0.05mol/L的磷酸盐缓冲液洗脱,收集洗脱液,超滤浓缩、脱盐后上Sephadex G-100以10mmol/L PBS(pH为7.8)洗脱,经过这几步柱分离即可得到高纯度Fe-SOD,钝顶螺旋藻SOD最后比活可达4 576u/mg蛋白,收率通常在50%左右,见表15-17。用SDS-PAGE测Fe-SOD亚基相对分子质量为21 kD,每分子亚基含0.7个Fe原子,在Tris-HCl缓冲液中的最适pH为8.2,最适温度为25℃,最大紫外吸收值为279nm,Fe-SOD对过氧化氢敏感,在5mmol叠氮钠中稳定。
表15-17 钝顶螺旋藻SOD纯化表
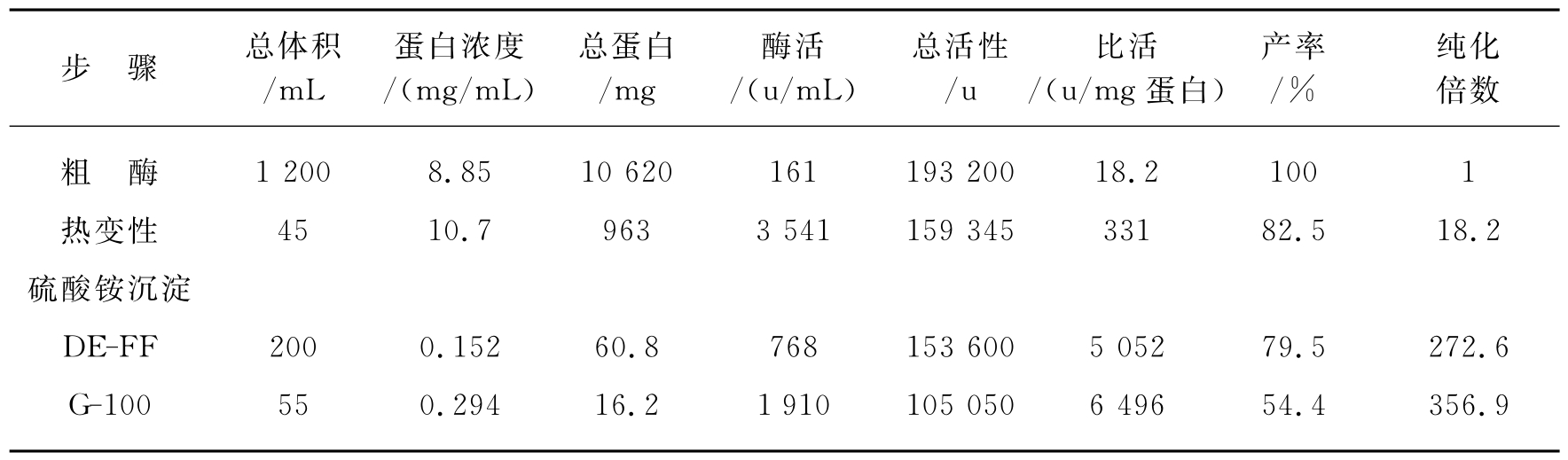
(摘自华东理工大学学报,2003,24(1):20)
15.3.4.3 棕色固氮菌Fe-SOD的制备方法
取棕色固氮菌(AV-230)湿菌体300g,加入400mL 0.025mol/L pH为7.2的Tris-HCl缓冲液和60g细粉状二氧化硅,超声破碎。将所得的粗提液以15 000r/min离心20min。上清液用1mol/L NaOH调至pH为7.2,然后于56℃水浴中搅拌加热10min,迅速冷却至室温。于15 000r/min离心30min后除去沉淀。以1mol/L NaOH调上清液至pH为7.2,搅拌加入固体硫酸铵至终浓度为30%(质量∶体积),15 000r/min离心30min后除去杂蛋白。将上清液在4℃下0.025mol/L、pH为7.2的Tris-HCl缓冲液中透析除盐。
DEAE纤维素-52柱层析(以下层析均在4℃下进行)。将除盐样品以30mL/h的流速上至以0.025mol/L、pH为7.2的Tris-HCl缓冲液平衡好的DEAE-52柱上,以0~0.15mol/L NaCl的相同缓冲液进行梯度洗脱,收集活性部分浓缩冻干。
Sephadex G-75柱和羟基磷灰石柱层析。将冻干粉末溶于10mL 0.020mol/L pH为8.2的Tris-HCl缓冲液中,分两次加入已用同样缓冲液平衡过的Sephadex G-75柱上,流速为20 mL/h,以同样缓冲液洗脱。
经Sephadex G-75柱层析后的样品,透析除盐后冻干,溶于4mL 5mmol/L、pH为6.8的磷酸缓冲液中,加入用同样缓冲液平衡过的羟基磷灰石柱上。以5~15mmol/L、pH为6.8的磷酸缓冲液进行梯度洗脱,收集活性组分。将活性部分透析除盐后冻干即得Fe-SOD纯品。各步纯化结果见表15-18。
表15-18 棕色固氮菌Fe-SOD纯化表
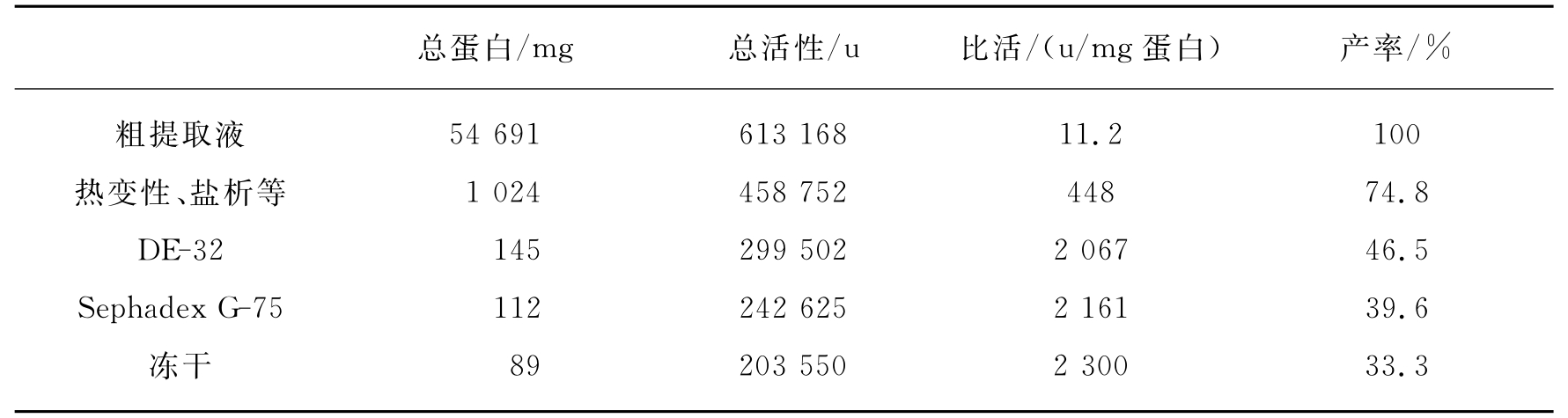
(摘自生物化学杂志,1988,4(3):193-195)
15.3.4.4 从大肠杆菌中提取SOD(Fe-SOD)
Fe-SOD一般存在于需氧的原核生物中,也存在于少数真核生物如细致虫藻与芸苔中。它的酶蛋白性质类似Mn-SOD,故其纯化方法大致与Mn-SOD类似。Yost与Fridovich首先从大肠杆菌中分离出Fe-SOD,随后其他菌藻如间隔发光杆菌、leignachi发光杆菌、脱氮副球菌、结核分枝杆菌、卵状假单孢菌、嗜硫代硫酸盐绿菌、酒色着色菌、脱硫弧菌、巨大芽孢杆菌、烷杆菌以及织线藻中也分离出该酶,甚至还得到结晶。所有的分离方法虽有一些不同,但大体类似。现以大肠杆菌Fe-SOD为例介绍该酶的纯化方法。
(1)破碎细胞。取300g大肠杆菌悬浮于1 500mL的pH为7.8、0.05mol/L磷酸钾缓冲液中。在0℃~5℃中用超声波发生器使大肠杆菌破碎。以13 000r/min离心30min,除去沉渣,收集上清液。
(2)链霉素硫酸盐处理。在上清液中加入链霉素硫酸盐,使其浓度为2.5%。在23℃搅拌30min,离心,收集上清液。
(3)50%硫酸盐处理。在23℃缓慢加入硫酸铵至上清液中,使达到50%饱和。1h后离心,收集上清液。
(4)75%硫酸盐处理。按照上述步骤,在上清液中继续缓慢加入硫酸铵,使其饱和度达到75%。放置1h后离心除去上清液,保留沉淀。
(5)透析。将沉淀溶于最小量的pH为5.5、0.002mol/L醋酸钾缓冲液。在冷室中用同样缓冲液透析48h左右。
(6)CM-52层析。取CM-52柱,预先用pH为5.5、0.01mol/L醋酸盐缓冲液平衡。将上述透析液上柱。Mn-SOD仍在柱中被吸附,但Fe-SOD可被洗脱,用pH为7.8、0.05mol/L磷酸钾缓冲液透析。所有操作应在4℃进行。
(7)DE-52柱层析。预先用pH为2.8、0.005mol/L磷酸钾缓冲液使DE-52柱平衡。将上述透析液上柱,用同样缓冲液200mL洗柱,并以500mL的0.005~0.05mol/L同样pH缓冲液进行梯度洗脱,测定收集管的蛋白质含量及酶活性。将符合纯度要求的收集、合并和浓缩,冷冻干燥即得Fe-SOD成品。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















