第四节 细胞的生命历程
一、细胞的分裂
生物的生长发育、代代相传、延续种族的基础是细胞分裂。繁殖是生物或细胞形成新个体或新细胞的过程。
从一次分裂开始,到下一次分裂完成的整个过程,称为细胞周期,分为DNA合成前期(G1期),DNA合成期(S期),DNA合成后期或有丝分裂准备期(G2期),分裂期(M期或D期)。前三者合称间期,是细胞进行生长的时期,合成代谢最为活跃,进行着包括DNA合成在内的一系列有关生化活动并且积累能量,准备分裂(图3-16)。
DNA合成前期(G1期):DNA合成以前的准备期,染色体由一条DNA分子的染色单体组成。G1期细胞极其活跃地合成RNA、蛋白质和磷脂等。
DNA合成期(S期):合成DNA时期,染色体发生复制,DNA含量比G1期增加一倍。
DNA合成后期或有丝分裂准备期(G2期):G2期的每条染色体由两条完全相同的染色单体组成,含一个完全相同的DNA分子。
分裂期(M期):是进行有丝分裂的时期。
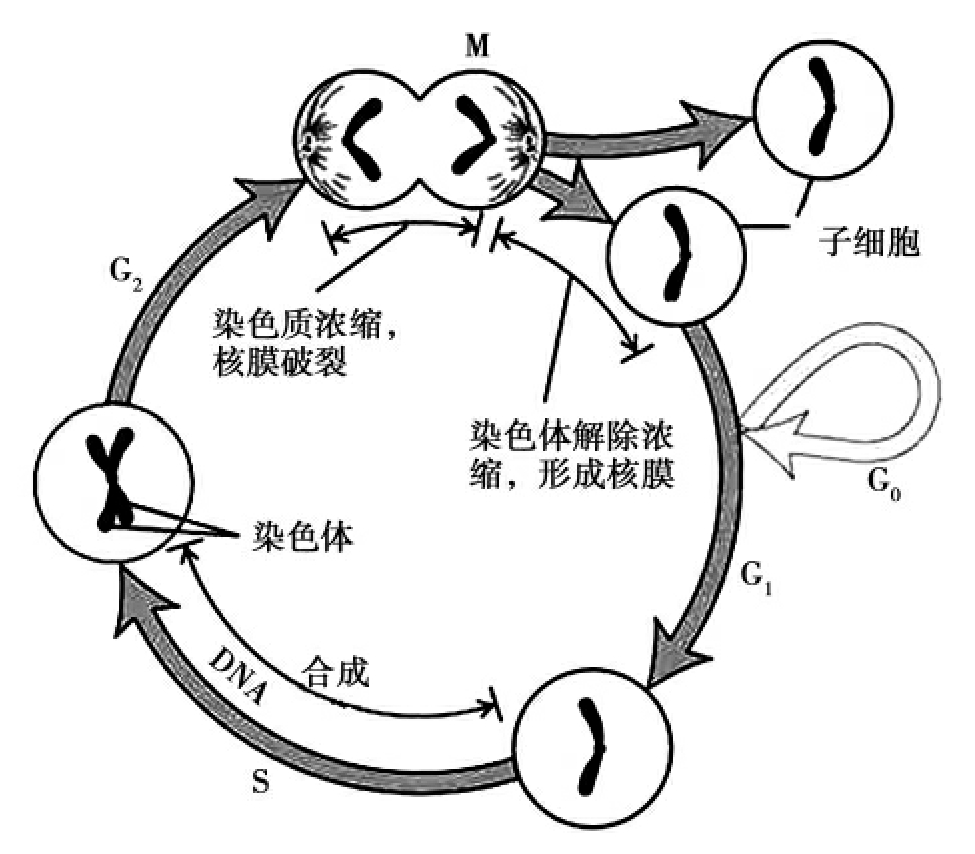
图3-16 细胞周期可划分为四个阶段
细胞分裂的类型包括无丝分裂、有丝分裂、减数分裂等,下面分别简单介绍。
1.无丝分裂:是指间期核不经任何有丝分裂时期,直接分裂,形成差不多相等的两个子细胞。
2.有丝分裂:又称间接分裂,分为核分裂和胞质分裂。一个细胞经过一次有丝分裂,产生染色体数目和母细胞染色体数目相同的两个子细胞。据核的变化,又分为前期、中期、后期和末期。
前期(prophase):核内的染色质凝缩成染色体,核仁解体,核膜破裂以及纺锤体形成。间期核的染色质是细长的细丝,分裂前期,染色质丝螺旋缠绕逐渐增粗,为念珠状的细丝,继续螺旋化缩短、变粗,成为分离的染色体,染色体缩至最短,核仁解体,其组成物质的一部分转移到了染色体。前期最末,核膜破裂,和内质网结合,此时核液和细胞质混合起来,此外,前期终了前,核的两极出现少量的微管细丝,开始形成纺锤体。
中期(metaphase):是染色体排到赤道面上,纺锤体完全形成的时期。核膜破裂,标志着前期的结束,各染色体的染色单体清晰可见,微管伸长,形成纺锤丝,有的通过两极,有的从一极附着到染色单体的着丝点上。每个染色单体,各有一个着丝点,所有的纺锤丝形成了一个纺锤状的构象,称为纺锤体。纺锤丝在染色体的运动上起重要作用,由于微管的作用,染色体移动,到细胞中部,染色体的着丝点,都排在赤道面。
后期(anaphase):各个染色体染色单体分开,由赤道面移向细胞两极的时期。后期时,染色体仍继续缩短,达最短程度。染色体从着丝点分开,向两极移动,到两极集中。
末期(telophase):是形成二子核和胞质分裂的时期。到达两极的子染色体,膨胀而失去轮廓,螺旋解开,变为染色质细丝,并形成新的核膜,核仁出现,形成了两个子核。经过核分裂和胞质分裂,一个母细胞成为两个子细胞,子细胞染色体的数目和母细胞的相同,为2N(图3-17)。
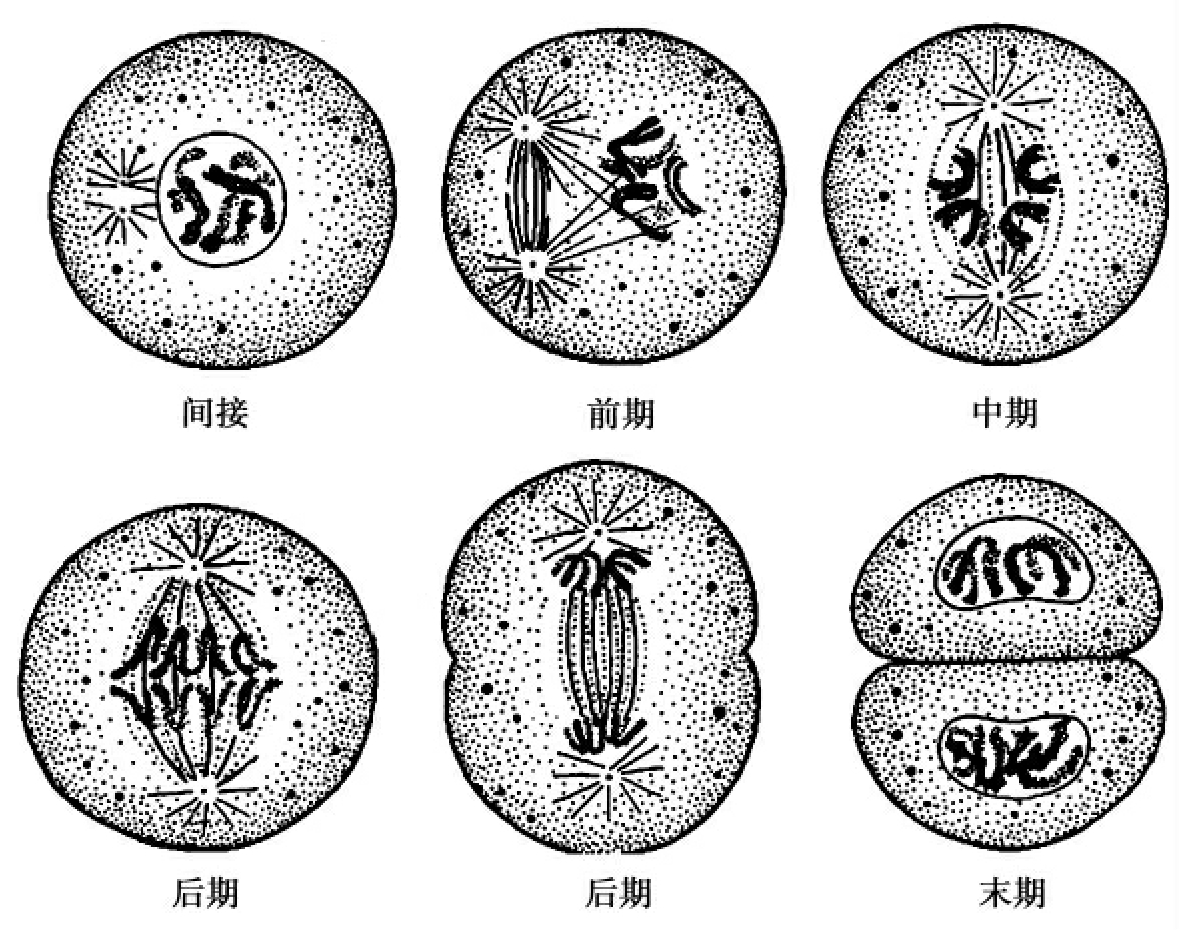
图3-17 细胞的有丝分裂模式图
3.减数分裂
凡是进行有性生殖的动植物都有减数分裂的过程。两个性细胞,即配子(精子或卵)融合为一,成为合子或受精卵,再发育成新的一代,称为有性生殖。减数分裂包括两次连续的分裂,但其DNA只复制一次,一个母细胞经过减数分裂以后,形成四个子细胞,这样,每个子细胞染色体的数目(以N表示)比母细胞(2N)减少了一半,所以称为减数分裂(meiosis)。
减数分裂只发生在生物的有性生殖过程中,形成的子细胞染色体数目为母细胞的一半。由两次连续的分裂完成,一个母细胞形成四个子细胞,减数分裂过程中发生了同源染色体的配对、交叉、互换等现象(图3-18)。
减数分裂产生的子细胞染色体数目减为母细胞的一半,细胞内只有一组染色体,由此形成的精细胞及卵细胞也是单倍体。精、卵结合形成受精卵又恢复了亲代的染色体数目,这就使每一种生物的染色体数目保持了相对的稳定性,也就是在遗传上保持了物种的相对稳定性;减数分裂过程中,发生同源染色体间的交叉,即遗传物质的交换和重组,使后代出现了变异性。这对增强植物的适应力、繁衍种族,都具有重要意义。
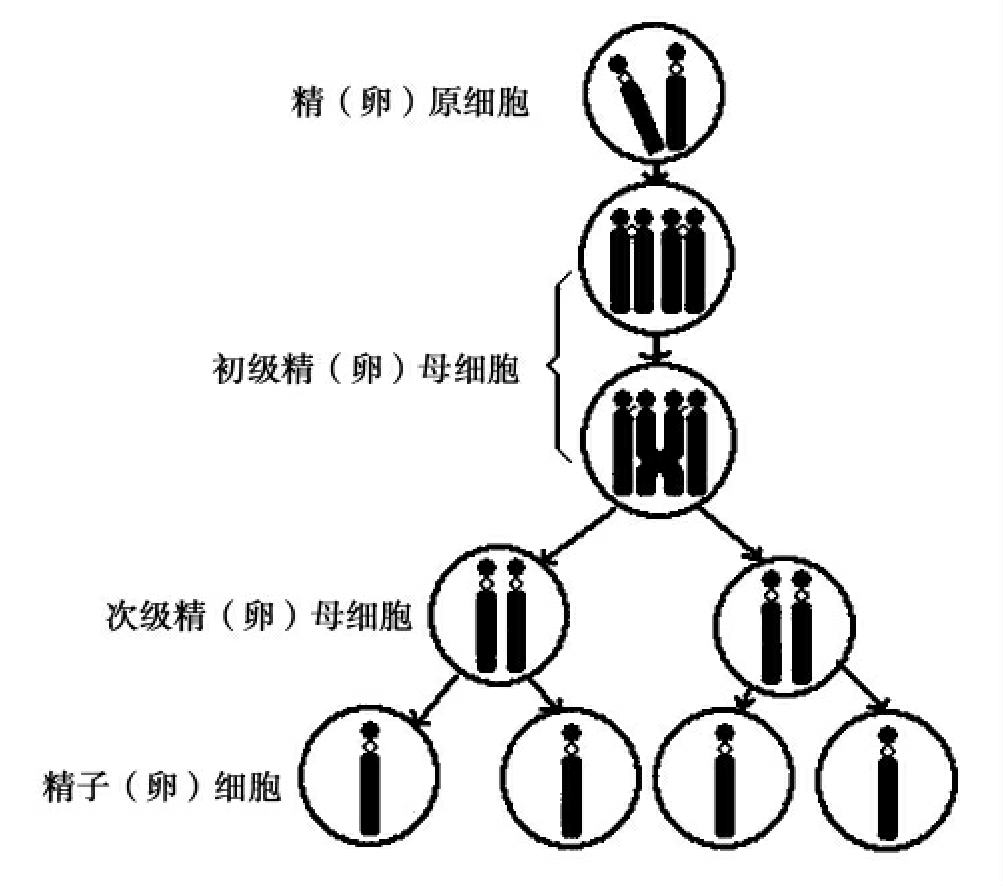
图3-18 减数分裂模式图
二、细胞的分化
在个体发育中,细胞后代在形态结构和功能上发生差异的过程称为细胞分化(cell differentiation)。细胞分化不仅发生在个体发育中,在人体中由多能造血干细胞分化为不同血细胞的细胞分化过程,在每个人的一生中都在进行着。卵细胞分裂的不对称性和细胞间的相互作用是细胞分化的两个基本机制。受精卵能够分化出各种细胞、组织,形成一个完整的个体,所以把受精卵的分化潜能称为全能性。随着分化发育的进程,细胞逐渐丧失其分化潜能。从全能性到多能性,再到单能性,最后失去分化潜能成为成熟定型的细胞。
干细胞是一类具有分裂和分化能力的细胞,多能干细胞可以分化出多种类型的细胞,但它不可能分化出足以构成完整个体的所有细胞,所以多能干细胞的分化潜能称为多能性。单能干细胞来源于多能干细胞,具有向特定细胞系分化的能力,也称为祖细胞。
一些科学家认为成熟动物细胞不具备全能性,其原因并非在细胞核而在细胞质,如大量的核移植实验证实,分化细胞的核仍保留完整的基因组DNA。我国发育生物学家童第周1978年成功地将黑斑蛙成熟的细胞核移入去核的受精卵细胞内,培育出了蝌蚪。上世纪60年代的爪蟾和80年代小鼠的核移植,90年代末多莉羊的诞生,都证明了分化细胞具有完整的DNA。
目前认为细胞分化的本质是细胞内基因选择性表达特异性功能蛋白质的过程。近年,细胞分化及其调控机制的研究主要集中在编码特异蛋白质的基因的选择性表达规律及其调控方面。围绕干细胞的研究及其组织工程中的广阔的应用前景,极大地促进了细胞分化领域的研究。
三、细胞衰老和凋亡
1.细胞衰老
衰老死亡是生物体或人体的必然归宿,也是细胞的必然归宿。对单细胞生物来说。细胞的衰老和机体的衰老是统一的;而对多细胞机体来讲,细胞衰老不等于机体衰亡,机体衰亡也并不意味着所有细胞衰老。如表皮的更新正是由于一些细胞的衰老,换来了另外一些细胞的新生,在刚刚死亡机体中,许多细胞依然存活。如血管里的白细胞还在做变形运动,气管的上皮细胞纤毛还在摆动。
细胞的衰亡,即使机体中重要器官的细胞衰亡,如肝细胞衰亡,并不直接引起机体的衰亡,只表现为机体局部生理生化功能改变。脑神经细胞和心肌细胞由于高度特化的细胞,不能增殖,又由于它们在人体生命活动中所占的重要地位,故它们的衰老将严重影响到机体的衰老。
在细胞成熟和行使功能后期,细胞逐步走向衰老。细胞衰老(cell aging)一般是指细胞在形态与生化成分上的改变,进而发生生理功能障碍的现象。这是一个缓慢行进、随细胞年龄增高而加剧的过程。
细胞在体外培养条件下,即使条件适宜,细胞也不能无限制地进行分裂,而是有一定界限。细胞的分裂能力,与个体年龄有关,从胎儿肺得到的成纤维细胞可传代50次,而从成人得到的肺成纤维细胞只能传代20次。各类细胞的寿命各不相同,一般来说,能够保持持续分裂能力的细胞相对不容易衰老,分化程度高又不分裂的细胞寿命大多有限。
细胞衰老主要是细胞生理生化的变化,也反映在细胞形态结构和功能上,比如细胞内水分的减少,蛋白质水合能力下降,衰老细胞水分减少,细胞皱缩,体积缩小,核膜内折,染色体固缩化,端粒缩短;随年龄增大,数量减少,体积增大,内容物呈网状化并形成多囊体,mtDNA缺失突变;质膜的流动性下降,磷脂减少,不饱和脂肪酸下降;膜脂过氧化,对刺激反应性下降;色素生成随衰老而增加,并在溶酶体或线粒体中沉积。
衰老细胞DNA、蛋白质和脂类等成分损伤,代谢能力降低,主要表现为DNA复制与转录受抑制,个别基因异常激活,端粒DNA丢失,线粒体DNA特异缺失,DNA氧化、断裂、缺失和交联,甲基化程度降低;mRNA和tRNA含量降低;蛋白质含量下降,蛋白质糖基化、氨甲酰化、脱氨基等修饰,使蛋白质稳定性、抗原性、可消化性下降,自由基使肽断裂、交联而变性。氨基酸由左旋变右旋;酶分子的活性中心被氧化,Ca2+、Zn2+、Mg2+、Fe2+等丢失,酶分子二级结构、溶解度、等电点改变,酶失活;不饱和脂肪酸被氧化,引起膜脂间或与脂蛋白间交联,膜流动性下降。
近二十年来,关于细胞衰老机制的研究取得了重大进展,主要学说有强调衰老是由于细胞中的各种错误积累引起的差错学说(Error theories)和强调衰老是遗传决定的自然演进过程的遗传学说(Genetic/Programmed theories)。
(1)差错学说
细胞衰老是细胞成分因内外环境受损,缺乏完善修复能力,使“差错”积累,导致细胞衰老。根据“差错”的“主因”的不同,又可分不同学说。
①代谢废物积累(waste product accumulation)
代谢产物超量积累危害细胞,引起衰老。脂褐质沉积是典型例子:脂褐质是长寿蛋白和DNA、脂类形成的巨交联物。脂褐质结构致密,在溶酶体不能水解也不能外排,在细胞内沉积,阻碍物质交流和信号传递,使细胞衰老。老年性痴呆(AD)是由β-淀粉样蛋白沉积引起。
②大分子交联(cross linking)
过量的大分子交联是衰老的主要因素,如DNA交联和胶原交联均可损害其功能,引起衰老。在临床方面胶原交联和动脉硬化、微血管病变有密切关系。
③自由基学说(free radical theories)
自由基是指在原子核核外层轨道上具有不成对电子的分子或功能基团。如AB两个原子各提供一个电子通过共价键形成分子A∶B,这两个电子是配对的,如发生均裂,A和B各带走一个电子形成A和B,即自由基。
自由基产生的因素有外源性因素,比如由环境辐射、光解、化学物质等引起的,内源因素是自由基主要来源,途径有:①线粒体呼吸链电子泄漏产生;②过氧化物酶体的多功能氧化酶催化底物羟化;③机体血红蛋白、肌红蛋白可经非酶促反应产生自由基。
自由基含未配对电子,具高度活性,易与细胞内的生物大分子发生反应,并发生伤害。自由基与核酸分子中的碱基发生加成反应,OH加到碱基双链上,破坏碱基产生基因突变;自由基可加成到膜脂及不饱和脂肪酸双链,引起脂质过氧化,并产生新的自由基;自由基常攻击肽链上的脯氨酸残基,造成蛋白质断裂。同时,自由基还引起蛋白质交联、破坏蛋白质高级结构;自由基的氧化也常损伤细胞骨架蛋白,如肌动蛋白与氧化型谷胱甘肽(GSSG)之间形成二硫键,导致分子表面电荷改变,引起大分子聚集。
衰老的自由基学说由美国科学家Harman1955年提出,核心内容是:①衰老是自由基对细胞成分的有害攻击所造成;②该学说提出的自由基是氧自由基;③维持体内适当水平的抗氧化剂和自由基清除剂可延长寿命和推迟衰老。
正常细胞内存在清除自由基的防御系统,包括:①酶系统:超氧化物歧化酶(SOD),过氧化氢酶(CAT),谷胱甘肽过氧化物酶(GSH-PX);②非酶系统:VE、醌类物质等电子受体。将铜锌超氧化物歧化酶基因导入果蝇,使转基因株具3个拷贝的SOD基因,其寿命比野生型延长三分之一。为衰老的自由基学说提供了证据。
线粒体是自由基浓度最高的细胞器,氧化磷酸化过程中,1%~4%的氧转为活性氧(ROS)。mtDNA裸露,易受伤害发生突变,mtDNA复制的聚合酶γ没校正功能,复制错误频率高。mtDNA突变使呼吸链受损,自由基堆积,循环脑、心、骨骼肌的氧负荷最大,是最易衰老的组织。
外源理化因子,内源自由基均可损伤DNA,使体细胞突变。辐射可致年轻的哺乳动物出现衰老症状,与个体正常衰老相似。正常机体存在DNA修复机制,可使损伤DNA修复。随着年龄增加,修复能力逐渐下降,使DNA错误累积,最终细胞衰老死亡。DNA的修复并不均一,转录活跃基因被优先修复,在同一基因中转录区被优先修复,彻底的修复仅发生在细胞分裂的DNA复制时期,这使干细胞能永葆青春。
真核生物基因组中存在大量重复序列,主要基因的选择性重复是基因组的保护机制,也是决定细胞衰老的因素。重复基因的一个拷贝受损或关闭后,其他拷贝被激活,直到最后一份拷贝用完,细胞因缺少某种重要产物而衰亡。小鼠肝细胞重复基因的转录灵敏度随年龄增加而降低,哺乳动物rRNA基因数随年龄增加而减少。
(2)遗传学说
衰老是遗传决定的自然演进过程,一切细胞均有内在的预定程序决定其寿命,而细胞寿命又决定种属寿命的差异,外部因素只能使细胞寿命在限定范围内变动。
①程序性衰老(programmed senescence)
生物的生长、发育、衰老和死亡都由基因程序控制,衰老是某些基因依次开启或关闭的结果。小鼠肝中,胚胎早期表达的胞质丙氨酸转氨酶为A型,随后停止表达,在衰老时表达B型。其他类似的衰老标志物(markers):如肝中的衰老标志蛋白也是在老年期表达。衰老还与神经内分泌系统退行性变化及免疫系统的程序性衰老有关。
②细胞衰老的端粒假说
细胞增殖次数与端粒有关。体细胞染色体端粒DNA随细胞分裂次数增加而缩短。细胞DNA复制一次端粒缩短一段,至Hayflick点时,启动DNA损伤检测点,不可逆退出细胞周期,走向衰亡。人成纤维细胞端粒每年缩短14~18bp,染色体的端粒具细胞分裂计数器功能。端粒长度与端粒酶活性有关,端粒酶是一种反转录酶,由RNA和蛋白质组成,所含的RNA是合成端粒DNA的模板,而所含的反转录亚基则催化端粒DNA的合成。生殖细胞、干细胞和肿瘤细胞端粒酶活性较高,正常体细胞端粒酶活性低,呈抑制状态。
③长寿基因(longevity genes)
各种动物都有相当恒定的平均寿命和最高寿命,成人早衰症病人平均39岁时出现衰老,47岁左右死亡,患婴幼儿早衰症的小孩在1岁时出现明显衰老,12~18岁夭折。
由此看物种寿命主要取决于遗传物质,DNA链上可能存在“长寿基因”或“衰老基因”决定个体寿限。细胞衰老时,衰老相关基因(SAG)表达活跃,人1号、4号及X染色体上发现SAG。线虫均寿命3.5d,age-1突变,提高均寿命65%,最大寿命110%,该突变型有较强的抗氧化酶活性。早老综合症患者体内解旋酶基因存在突变,该基因位于8号染色体短臂,称WRN基因。淀粉样蛋白前体基因(APP)突变,导致基因产物β淀粉样蛋白易于在脑组织中沉积,引起老年痴呆症。
2.细胞凋亡
死亡是生命的普遍现象,但细胞死亡并非与机体死亡同步。正常组织中,常发生“正常”的细胞死亡,它是维持组织机能和形态所必需的。细胞死亡的方式通常有两种:细胞坏死(necrosis)、细胞凋亡(apoptosis)。
细胞坏死是细胞受到急性强力伤害时立即出现的早期反应。包括胞膜直接破坏,大量水进入细胞,线粒体外膜肿胀而密度增加。核染色质呈絮状,蛋白质合成减慢。如及时去除伤害因素,以上早期反应尚可逆转。若伤害外因持续存在,则发生不可逆的变化。Ca2+升高、引起一系列变化,如细胞骨架破坏,溶酶体释放,pH下降,最后细胞膜和细胞器破裂,DNA降解,细胞内容物流出,引起周围组织炎症反应(图3-19)。
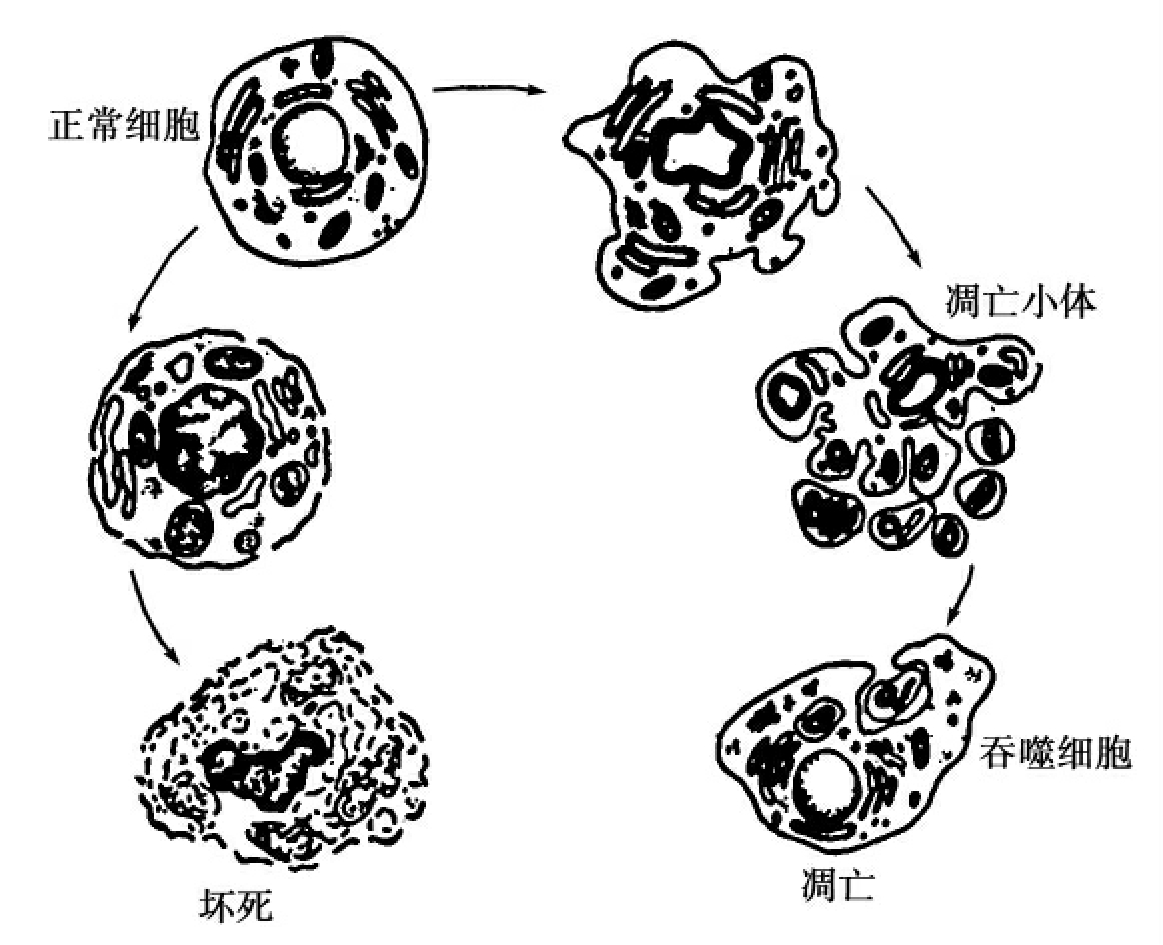
图3-19 细胞坏死与凋亡的形态区别
细胞凋亡(cell apoptosis)是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等作用,它并不是在病理条件下的自体损伤现象,而是为更好地适应生存环境而主动争取的一种死亡过程。
1965年澳大利亚科学家发现,结扎鼠门静脉后,电子显微镜观察到肝实质组织中有一些散在的死亡细胞的溶酶体并未被破坏,显然不同于细胞坏死。这些细胞体积收缩、染色质凝集从其周围的组织中脱落并被吞噬机体无炎症反应。1972年Kerr最先提出这一概念,他发现结扎大鼠肝的左、中叶门静脉后,其周围细胞发生缺血性坏死,但由肝动脉供应区的实质细胞仍存活,只是范围逐渐缩小,其间一些细胞不断转变成细胞质小块,未伴有炎症,后在正常鼠肝中也偶然见到这一现象。与细胞坏死的区别是:①染色质聚集、分块,位于核膜上,胞质凝缩,最后核断裂,细胞通过出芽的方式形成许多凋亡小体;②凋亡小体内有结构完整的细胞器,还有凝缩的染色体,可被邻近细胞吞噬消化,因始终有膜封闭,没有内溶物释放,故不会引起炎症;③线粒体无变化,溶酶体活性不增加;④内切酶活化,DNA有控降解,凝胶电泳图谱呈梯状;⑤凋亡通常是生理性变化,而细胞坏死是病理性变化。
在“细胞凋亡”一词出现之前,胚胎学家已观察到动物发育过程中存在着细胞程序性死亡(programmed cell death,PCD)现象,近年来PCD和细胞凋亡常被作为同义词使用,但两者实质上是有差异的。首先,PCD是一个功能性概念,描述在一个多细胞生物体中,某些细胞的死亡是个体发育中一个预定的,并受到严格控制的正常组成部分,而凋亡是一个形态学概念,指与细胞坏死不同的、受到基因控制的细胞死亡形式;其次,PCD的最终结果是细胞凋亡,但细胞凋亡并非都是程序化的。
线虫(Caenorhabditis elegans)是研究个体发育和细胞程序性死亡的理想材料。其生命周期短,细胞数量少,成熟的成虫若是雌雄同体则有959个体细胞,约2000个生殖细胞。若是雄虫则有1031个体细胞和约1000个生殖细胞。神经系统由302个细胞组成。这些细胞来自于407个前体细胞,这些前体细胞中有105个发生了程序死亡。控制线虫细胞凋亡的基因主要有3个Ced-3、Ced-4和Ced-9,Ced-3和Ced-4的作用是诱发凋亡。在缺乏Ced-3、Ced-4的突变体中不发生凋亡,有多余细胞存在。Ced-9抑制Ced-3、Ced-4的作用,使凋亡不能发生,Ced-9功能不足导致胚胎因细胞过度凋亡而死亡。
2002年10月7日,英国人悉尼·布雷内(Sydney Brenner)、美国人罗伯特·霍维茨(H.Robert Horvitz)和英国人约翰·苏尔斯顿(John E.Sulston)因在器官发育的遗传调控和细胞程序性死亡方面的研究,获诺贝尔生理与医学奖(图3-20)。

图3-20 2002年诺贝尔生理与医学奖获得者
形态学观察细胞凋亡的变化是多阶段的,细胞凋亡往往涉及单个细胞,即便是一小部分细胞也是非同步发生的。首先出现的是细胞体积缩小,连接消失,与周围的细胞脱离,然后是细胞质密度增加,线粒体膜电位消失,通透性改变,释放细胞色素C到胞浆,核质浓缩,核膜核仁破碎,DNA降解成为约180~200bp片段;胞膜有小泡状形成,膜内侧磷脂酰丝氨酸外翻到膜表面,胞膜结构仍然完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体,无内容物外溢,因此不引起周围的炎症反应,凋亡小体可迅速被周围专职或非专职吞噬细胞吞噬。
细胞凋亡的一个显著特点是细胞染色体的DNA降解,这是一个较普遍的现象。这种降解非常特异并有规律,所产生的不同长度的DNA片段约为180~200bp的整倍数,而这正好是缠绕组蛋白寡聚体的长度,提示染色体DNA恰好是在核小体与核小体的连接部位被切断,产生不同长度的寡聚核小体片段。实验证明,这种DNA的有控降解是一种内源性核酸内切酶作用的结果,该酶在核小体连接部位切断染色体DNA,这种降解表现在琼脂糖凝胶电泳中就呈现特异的梯状图谱,而坏死呈弥漫的连续图谱。细胞凋亡的生化改变不仅仅是DNA的有控降解,在细胞凋亡的过程中往往还有新的基因的表达和某些生物大分子的合成作为调控因子。如我们实验室发现的TFAR-19就是在细胞凋亡时高表达一种分子,再如在糖皮质激素诱导鼠胸腺细胞凋亡过程中,加入RNA合成抑制剂或蛋白质合成抑制剂即能抑制细胞凋亡的发生。
细胞凋亡的机制是一个非常复杂的问题,许多问题还没有完全清楚。但是有一点是可以肯定的,细胞凋亡是受遗传基因控制的。细胞凋亡的过程大致可分为以下几个阶段:接受凋亡信号→凋亡调控分子间的相互作用→蛋白水解酶的活化(Caspase)→进入连续反应过程。客观上说对细胞凋亡过程中信号传递系统的认识还是不全面的。对哺乳动物细胞凋亡的基因凋控过程目前还不十分清楚,研究表明与细胞增殖有关的原癌基因和抑癌基都参与对细胞凋亡的调控,其中研究较多的有bcl-2 c-myc、p53、Ice、Fas/APO-1等基因。
总之,细胞的凋亡是一种生理现象,是一把双刃剑。一方面是机体发育的正常过程,另一方面如果细胞凋亡过速,则会导致慢性退行性病变;如果细胞不凋亡就有可能导致癌变或对化疗的不敏感。进一步研究线粒体在细胞凋亡中的作用,有助于深入了解细胞凋亡的机制与对疾病的防治。在许多情况下,有机体的发育并无坏处,相反是机体调节细胞群比例,增加效率的表现。在此还需说明一点,即凋亡不一定是由细胞衰老所致,衰老的细胞最终会凋亡,但有实验表明同一种细胞用同一方法诱导时,年轻的细胞比衰老的细胞更容易引起凋亡,这可能与细胞本身的代谢程度和敏感性有关。
四、偏离正常轨道的细胞——癌细胞
癌细胞是正常细胞转化成不受控制的恶性增殖的细胞,他们的形态和功能都与正常细胞截然不同,而且具有广泛侵袭性和转移能力。癌细胞大小形态不一,通常比它的源细胞体积要大,核质比显著高于正常细胞,可达1∶1,正常的分化细胞和之比仅为1∶4~6。核形态不一,并可出现巨核、双核或多核现象。核内染色体呈非整倍态,某些染色体缺失,而有些染色体数目增加。正常细胞染色体的不正常变化,会启动细胞凋亡过程。但是癌细胞中,细胞凋亡相关的信号通路产生障碍,也就是说癌细胞具有不死性。其细胞周期失控,就像寄生在体内的微生物,不受正常生长调控系统的控制,能持续地分裂与增殖。具有迁移性,细胞粘着和连接相关的成分(如ECM、CAM)发生变异或缺失,相关信号通路受阻,细胞失去与细胞间和细胞外基质间的联结,易于从肿瘤上脱落。许多癌细胞具有变形运动能力,并且能产生酶类,使血管基底层和结缔组织穿孔,使它向其他组织迁移。
正常细胞为什么会转化为癌细胞?癌细胞为什么不受机体的约束而恶性增殖?这都是与一定的内在因素或外在条件相关联的。内在因素现在认为主要是与癌基因活动有关,外在条件主要是与一些能激活癌基因的物理和化学等因素有关。癌基因的激活引起正常细胞的癌变已有大量的证据说明,关于癌症的详细内容将在后面相关章节进行详细介绍。
综上所述,细胞增殖、分化、凋亡与衰老是细胞最重要的生命活动现象,它们既相互联系又相互制约,并受到一系列基因的调控。一切动植物生长发育都是依靠细胞增殖、分化、凋亡来实现的。细胞癌变往往是由于细胞增殖、分化、凋亡失控所致。受精卵如何有条不紊地发育为复杂的成体,一直是人们企图揭开的奥秘。而细胞分化及凋亡的研究,将是解决这一重大问题的基础。人们已经通过促进细胞凋亡来为癌症治疗提供依据及手段。不论是细胞增殖与分化,还是细胞凋亡的研究,核心问题依然是其调控机制的研究。
思考题:
1.自然界的细胞有哪些共同点?
2.原核细胞和真核细胞的主要区别是什么?
3.真核细胞有哪些细胞器?它们的作用分别是怎样的?
4.什么是膜的流动镶嵌模型?
5.细胞跨膜运输有哪些主要种类?
6.请叙述Na+、K+泵的主要作用机理。
7.质子泵有哪些主要种类?
8.什么是有丝分裂,它有哪些特点?
9.减数分裂的主要特点有哪些?
10.细胞衰老与死亡的主要原因有哪些?
11.什么是细胞凋亡?它有什么样的特点?
12.肿瘤细胞有哪些特点?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















