小儿白血病是最能对药物起反应的人类恶性肿瘤之一。目前,主要通过系统化疗,70%以上的ALL患儿能被治愈。由于对药物的反应性,小儿白血病对于评估抗肿瘤药物的药效学来讲,是一个良好的模型。
药动学和药效学研究的是药物的吸收、分布、代谢和排泄。它描述了药动学和药物预期作用及副作用之间的关系。目前已经广泛的认识到,儿童在许多抗白血病药物的药动学方面确实存在着个体差异。
患者之间药动学的差异使许多药物需要个体化处理。对具有广谱治疗指数的药物(如青霉素)来讲,个体间的差异不能影响到临床疗效和药物毒性。在大多数患者中,为了确保血药浓度,给予的药物剂量足够高时,极可能达到预期的疗效,而发生药物毒性的危险很小。然而,对于抗白血病药物而言,治疗指数窄,失误的余地则较小。许多研究已经建立了血浆(组织)药物及其代谢物的浓度与给药剂量之间的关系,一些研究还建立了这些浓度与药效学间的关系。正是对后者的研究,在抗肿瘤药物的临床治疗方面起到了指导作用,这也正是本章所要讨论的主题。
下面将就几种主要抗白血病化疗药物的药动学和药效学进行具体介绍。
一、甲氨蝶呤
自20世纪40年代后期抗叶酸药的使用开始,现代化疗便迈开了第一步。其中抗叶酸剂甲氨蝶呤(Methotrexate,MTX)乃是治疗ALL的重要组分。诊断为早期前B急淋(early pre B-ALL)的患者,80%已经可被联合化疗所治愈,但仍有20%这类患者的治疗是无效的。治疗失败部分归咎于细胞对治疗药物产生耐药性。耐药性在T系表型中则更为普遍,而在疾病分类中T系表型通常被认为是一个高危因素。包括大剂量MTX(high-dose methotrexate,HDMTX)的强化治疗可使T系患者取得与B系ALL患者相当的存活率。这意味着细胞对药物的耐药性可部分被增强的剂量所克服。急性髓系白血病(AML)患者的治愈率则比ALL明显低下,目前报道的5年无病生存率(event-free survival rates,EFSR)为40%~60%。AML与ALL治疗方案的差别就在于AML的治疗很少应用MTX,这是由于先前的一些临床试验结果使人们认为AML细胞对MTX具有内在耐药性(intrinsically MTX resistance)。
1.MTX的药动学和耐药机制 MTX经还原型叶酸载体(reduced folate carrier,RFC)及膜叶酸受体(membrane folate receptor,MFR)入胞,经合成酶(folylpolyglutamate synthetase, FPGS)多聚谷氨酸化形成MTXPGS(methotrexate polyglutamates),MTXPGS被水解酶(folylpolyglutamate hydrolase,FPGH)水解,合成酶与水解酶两者平衡后,MTXPGS处于胞内总MTX的一定比例,此比例相对稳定并与耐药性有关。MTX本身及MTXPGS可以抑制一些需叶酸辅因子的酶,二氢叶酸还原酶(dihydrofolate reductase,DHFR)等。最终MTX可经多药耐药相关蛋白(multidrug resistance-related pump,MRP)泵出胞外,大部分以原型排出体外。
(1)跨膜转运(transmembrane transport):MTX可经由主动转运、被动扩散及受体介导(MFR)入胞。MTX分子末端有一带负电的谷氨酸残基,因而必须通过RFC的主动转运才能入胞。RFC以阴离子交换的方式跨膜转运MTX及其他还原型叶酸。MFR虽主要转运生理性叶酸,但资料显示其在MTX的抗肿瘤效应中有一定的作用。在MTX胞外药物浓度大于20μmol/L时,MTX也可以被动扩散的方式入胞。研究发现在小鼠肿瘤细胞及人的细胞系中,RFC基因点突变可导致细胞对MTX敏感性的下降。有趣的是,RFC基因的某些点突变可导致叶酸摄取效率的增加,胞内叶酸池内容的增加可导致叶酸与MTX竞争靶酶FPGS,进而减弱了MTX的细胞毒效应。另外,翻译后经不同剪切所产生的RFC1mRNA、多启动子的存在、早期终止信号以5′端异质性均可能在耐药性中起一定的作用。
(2)聚谷氨酸化(polyglutamylation):MTX有时被认为是一前体药物或原药(prodrug),入胞后,MTX可发生聚谷氨酸化作用。对MTX来说,聚谷氨酸化是一重要的生化药理过程,MTXPGS比其母体药物在胞内滞留的时间更长,因而能发挥更强更持久的抗肿瘤效应。MTXPGS的靶酶谱也更为广泛。
MTX进入细胞,通过还原型叶酸的载体功能的破坏、由叶酸多聚谷氨酸合成酶催化的MTXPG形式的减少、或者通过γ-谷氨酸水解酶来水解MTXPG而被减少。体外加入MTX孵育时,MTXPG在高二倍体型白血病幼稚细胞中的蓄积量,大于非高二倍体型白血病;而且B系ALL的幼稚细胞内的蓄积MTXPG量大于T系ALL的幼稚细胞。患者中白血病幼稚细胞中的蓄积量相似的结果也被证实,这与抗代谢药治疗高二倍和(或)B系ALL预后佳一致。
(3)靶酶(target enzymes):MTX和MTXPGS均是DHFR强有力的抑制剂。此外,MTXPGS还可直接抑制胸苷酸合成酶(TS)。另一点需要注意的是,DHFR被抑制后将产生胞内二氢叶酸的聚积,其PG化产物也可直接抑制TS。胞内MTX的有效作用浓度将随着靶酶活性的增加而增加:在实验性肿瘤中,MTX一种重要的耐药机制,即为DHFR基因扩增引起DHFR表达增高所致。也有报道对MTX耐药是由DHFR点突变而致的DHFR对MTX亲和力下降所致。
2.大剂量MTX(HDMTX)治疗
(1)大剂量MTX(HDMTX)治疗理论基础:给予患者较高剂量的MTX(1.0g/m2,静脉>24h)与低剂量MTX(30mg/m2,每6小时口服1次)相比,在ALL幼稚细胞中能产生较多有活性的代谢产物MTXPG。ALL幼稚细胞中,这种较高水平的MTXPG,已经转化成较强的抗白血病作用,抑制嘌呤的从头合成和减少循环中的幼稚细胞。与长期低剂量MTX的用药相比,高剂量MTX(HDMTX)能使ALL幼稚细胞中MTXPG达到一个较高的浓度。
临床研究显示,系统给予HDMTX可能对ALL患儿的临床结果产生显著好的影响。在St.Jude儿童研究医院的研究中发现,标危ALL(SR-ALL)患儿MTX的血浆稳态浓度(Cpss)与无病存活(EFS)之间存在着显著相关。在第一个1.5年的持续化疗中,给患儿输入HDMTX(1.0g/m2,静脉>24h)15次,另外还按传统给予低剂量药物,口服硫鸟嘌呤(50mg/m2,每日1次)和MTX(40mg/m2,每周1次)。所有的患者都给予同样剂量的HDMTX,因此,HDMTX系统快速清除的患者,这一药物的血浆稳态浓度较低。在Cox比例风险回归分析中,MTX Cpss中位数<16μmol/L的患者比MTX Cpss中位数>16μmol/L的患者,有更大的早期失败(复发)的危险。在包括有其他预后因素(如白细胞计数和DNA指数)的多因素分析中,这种较大的危险具有统计学意义。长期随访(中位数7.3年)的分析表明,对于中等危险度(intermediate-risk)的ALL患者而言(特别是WBC 10×109~100×109/L),MTX Cpss是一个有意义的预后因素;而对于早期即复发的ALL患者来讲,只有在非常好的危险度(very good risk)的情况下,Cpss才能作为一个有意义的预后因素。这就是HDMTX+CF作为ALL的一个有效治疗手段的理论基础。
在一个以患者接受低剂量MTX(联合巯嘌呤)作为维持化疗一部分的方案中,红细胞内MTXPGs和硫鸟嘌呤核苷(TGN)的浓度,对治疗结果是一个有意义的预测指数。
(2)大剂量MTX(HDMTX)治疗的药物毒性:MTX暴露的药动学参数和急性毒性反应之间的关系。患者和个体化疗对MTX的显著的药动学影响包括有:①水化和碱化的情况;②出现胸膜渗出、胃肠梗阻、腹水和呕吐;③共用的药物及肾功能。认为影响MTX的药毒性的因素有,引起细胞毒性的药物血浆浓度的量及持续的时间;甲酰四氢叶酸援救用药的时间、剂量及持续时间;和一些对药毒性预处理的基本因素。伴有Downs综合征的患者血浆MTX延迟排泄发生的频率更高,产生的毒性更大;然而他们能在早期甲酰四氢叶酸的援救和密切的监视下,承受MTX的剂量范围是500~1 000mg/m2。由于负责MTX转运的还原型的叶酸载体,位于人类的21号染色体上,Downs综合征的患者可能提高所有组织对MTX的吸收,并且如果假设通过转化嘌呤代谢(也与21-三体相关)导致叶酸的耗竭,那么患者MTXPG也将提高。
(3)关于HDMTX与髓外白血病的防治:实验观察到1g/m2,静脉注射1/3量后15min,血浆MTX浓度达100μmol/L,2~3h期间在10~37μmol/L,这一浓度可使MTX穿透血-脑、血-眼及血-睾屏障,杀伤隐蔽所白血病细胞,从而可以防止CNSL。在儿童ALL,至少标危ALL的中枢神经系统(CNS)通过HDMTX结合鞘注得以替代放疗。许多资料显示HDMTX治疗CNSL优于LDMTX,当使用500mg/m2的MTX时,脑积液(CSF)几乎不能达到0.1μmol/L的细胞毒性浓度,相反,33.6g/m2的剂量CSF可达到10μmol/L浓度,3~7.5g/m2的剂量达到1μmol/L浓度。
(4)HDMTX与长期EFS的相关性:20世纪80年代初、中期,Freeman等就报道使用HDMTX明显减少了复发。Evans等发现ALL患儿的血清MTX浓度与缓解的时间长短明显相关,血清Css超过16μmol/L的ALL患儿,其获得缓解的时间明显长于16μmol/L患儿。Niemeyer等在诱导缓解期间使用HDMTX和LDMTX发现,HDMTX组较LDMTX组有明显高的EFS和无白血病期(LFI),并建议在诱导期就使用HDMTX。
3.MTX化疗个体化有关的若干问题 综上所述,用HDMTX治疗儿童ALL优于LDMTX,对于成熟T系ALL,低二倍体ALL及具备各种高危因素的ALL的治疗更是至关重要。目前各方案中不分个体、肿瘤特征的给药方式显然是不合理的,如何确定HDMTX最佳使用剂量和CF解救时间是今后一段时间所要解决的问题,这对于提高5年EFS有重要的意义。
(1)剂量选择:以往的资料显示要达到胞内最大的MTXPG聚集,T系ALL的HDMTX剂量要高于B系,一些资料猜测性地认为儿童T系ALL的MTX剂量需为5.0g/m2,B系ALL1.0g/m2剂量偏低。为了解决这一问题,Galpin等通过检测暴露于MTX 24h后的T系ALL细胞系CEM/CCRF(CEM)和B系ALL细胞系NALM6在多种浓度下MTXPG的聚集情况,结果发现CEM胞内MTXPG达到近饱和状态(95%最大长链MTXPG形成)的最小胞外浓度是48μmol/L,NALM6为34μmol/L。即便再大的剂量,T系的胞内最大的MTXPG的聚集水平仍低于B系。他们认为如根据3.5g/m2的给药剂量可达48μmol/L的稳定血药浓度,2.0g/m2可达34μmol/L推算,故上述对T系、B系ALL的最佳给药剂量猜测是合理的,也就是给B系及高二倍体ALL的使用剂量是2.0~3.0g/m2,具T-ALL及有其他高危因素的ALL的HDMTX剂量应是5.0g/m2。另值得注意的是,肾对MTX药物清除能力的变异性很大,尽管所有的患儿都接受1.0g/m2治疗剂量,但血浆稳定MTX浓度的变异范围达9.3~25.4μmol/L。此外,细胞毒性的变异随个体差异也很大,年龄较小的患儿对HDMTX耐受性明显大,药物导致的死亡率比年龄较大的患儿要小。
(2)CF解救剂量和解救时间:Galpin等的研究还表明达到稳定最大的长链MTXPG聚集所需的时间B系要短于T系,任一浓度的MTX都不能在24h内把所有的ALL细胞活力抑制(无论是T系还是B系),但只要达到适当的血浆浓度,在第48h时间点所有的细胞活力都被抑制。显然何时开始解救是值得探讨的。通过CF解救HDMTX引起的不良反应时,CF也在一定程度上解救了肿瘤细胞。由于肿瘤细胞RFC功能与正常细胞间的差异,对不存在MTX排泄延迟的患者,CF总解救剂量应掌握在MTX总剂量2%~3%即可解救大部分正常细胞。
(3)MTX给药方式:MTX的施药方式有口服、肌内注射、静脉注射和鞘注。MTX口服血药浓度有4倍差异,Teresi等在研究MTX口服、肌内注射的生物利用度时发现口服剂量小于40mg/m2时,平均生物利用度中位数为42%,大于40mg/m2时明显降低,为17.5%。相反,通过肌内注射给药方式剂量与生物利用度无相关性。提示MTX使用剂量大于40mg/m2时,肌内注射可获得更大的生物利用度。
(4)HDMTX的联合化疗:现代MTX在临床上的应用不是以单个药物出现的,而是与其他药物联合使用。例如,MTX+6-MP是儿童ALL缓解后治疗中的经典方案,联合应用后细胞毒性明显增加,其原因是MTX增加了磷酸核糖焦磷酸(PRPP)的水平,在较高PRPP的水平上引起6-MP代谢中形成的生物活性成分硫鸟嘌呤磷酸化合物(TGNs)增高;同时,6-MP的应用也通过增加MTXPG水平来增加MTX的细胞毒性作用。
(5)HDMTX+CF个体化治疗方案的优化:新华医院/上海儿童医学中心对HDMTX+CF的个体化治疗初步经验。1998年5月起,通过对中国儿童大剂量MTX(HDMTX)治疗儿童ALL的使用剂量和维持施药时间进行了优化研究。认为只要通过合理的水化、碱化和亚叶酸钙(CF)解救,可以保证绝大多数患儿化疗的安全,通过实验和临床研究得到如下结论:①不同危险度患儿使用不同剂量MTX;低危3g/m2,中、高危5g/m2。②长时间维持施药(连续24h)可以产生更大的全身巩固治疗及髓外白血病的防治作用。③联合巯嘌呤替代原联合泼尼松+长春新碱(VP)方案。④根据疗程中检测MTX血浆浓度,设置了预警浓度以调整水化、碱化强度和CF解救剂量和时间(表6-1,表6-2,表6-3)。⑤HDMTX施药前最好做预水化,MTX 3g/m2时水化量以3 000ml/m2,而5g/m2以4 000ml/m2为宜。必须注意各种原因引起的排泄异常。
表6-1 MTX开始滴入后的正常浓度范围

表6-2 根据MTX浓度调整CF用量
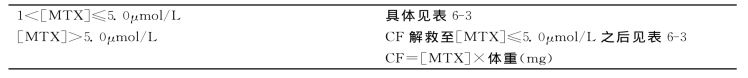
表6-3 44hMTX浓度<5.0μmol/L时CF剂量

二、巯 嘌 呤
1.巯嘌呤的代谢 作为治疗ALL的抗嘌呤代谢药物,巯嘌呤(Mercaptopurine,6-MP)本身是无内在生物活性的药物,只有经过一系列代谢生成硫鸟嘌呤核苷酸(6-thioguanine nucleotides,TGNs)后才具有抗肿瘤活性。在生物体内,6-MP有3条竞争性代谢旁路(图6-1),分别由黄嘌呤氧化酶(xanthine oxidase,XO)、巯基嘌呤甲基转移酶(thiopurine methyltransferase,TPMT)、次黄嘌呤磷酸核糖转移酶(HPRT)催化完成。XO催化6-MP氧化成为硫鸟嘧啶酸,最后形成尿酸,排出体外。TPMT催化6-MP形成甲基化的无活性衍生物甲基巯基嘌呤(MeMP)。HPRT催化6-MP形成巯基次黄嘌呤单磷酸盐(TIMP)、硫基黄嘌呤单磷酸盐(TXMP)、巯鸟嘌呤单磷酸盐(TGMP),TGMP经磷酸化后分别形成二磷酸盐和三磷酸盐,后三种物质统称为TGNs,是6-MP发挥抗肿瘤细胞毒作用的活性成分。
Christie等早就证实TGNs毒性与其整合入DNA链有关,随后的实验证明TGNs细胞毒性与其浓度有关,临床上发现患者在维持化疗期间的粒细胞缺乏、复发风险与TGNs浓度有一定关系。TGNs能可逆地阻断DNA、RNA的合成。其作用机制为TGNs残基与正常核苷酸竞争结合到DNA中,在结合有TGNs残基的DNA链相对应的互补链中将产生碱基缺失,从而形成DNA链的损伤。在体外实验中,即使受大剂量的TGNs作用的细胞将依然存活,只有在完成一个细胞分裂周期后,在随后的DNA复制中,由于DNA母链的异常损害了其复制功能,从而终止细胞分裂,导致细胞死亡。
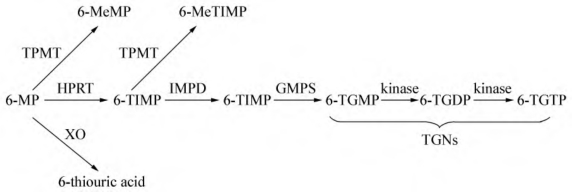
图6-1 6-MP代谢通路
2.6-MP的药物遗传学 由于每一个体遗传性不同,6-MP在体内的3条代谢通路的代谢酶活性亦存在遗传多态性分布。
(1)黄嘌呤氧化酶(xanthine oxidase,XO):XO在不同组织间的活性存在差异,在肠道和肝中的活性最高,但在血液细胞和血浆中缺如,研究发现,在健康人体内,XO的个体差异和种族差异较少,但在使用6-MP同时服用XO酶抑制药,如别嘌醇,将会提高TGNs浓度,增加细胞毒作用,故此时应适当减少6-MP剂量。
(2)次黄嘌呤磷酸核糖转移酶(HPRT):HPRT是一个研究较多的酶,在Lesch-Nyham综合征患者中,HPRT活性完全缺失,故6-MP对这种患者无任何细胞毒作用。编码HPRT的基因位于X染色体的q27-q28,当发生单个碱基突变后,HPRT活性即缺失。人体内HPRT广泛分布,但组织间活性亦不同,中枢神经系统的活性较高。HPRT活性的个体差异较少,在健康儿童中,HPRT活性大概为14~24U/ml,而在长期接受6-MP化疗的白血病患儿,其活性为20~27U/ml。
(3)巯基嘌呤甲基转移酶(TPMT):TPMT活性在个体间存在较大差异,大样本人群研究显示其呈三相分布,即0.3%为活性缺失,11.1%为低活性,86.6%为正常活性。顾龙君等的研究发现中国汉族人正常活性者为91.9%,低活性者为8.1%,尚未发现酶活性缺失者。目前认为TPMT活性缺失无性别差异而存在种族差异,西方白种人群为0.3%~5.7%,亚洲人群为0.006%~0.04%。TPMT活性与细胞内TGNs的累积存在负相关关系,即当低TPMT活性的白血病患儿服用“标准剂量”的6-MP后,体内蓄积的TGNs浓度较高,从而产生严重的骨髓抑制毒性,因此,若能在治疗前了解患儿的TPMT活性对于提前减少药物剂量、避免骨髓过度抑制有重要意义。对于TPMT活性缺失者,他们在服用通常剂量的6-MP后血中将出现高于正常人(126~832pmol/8×108 RBCs)几倍的TGNs,甚至达2 660pmol/8×108 RBCs,并发致死性的感染,患儿常因此中断6-MP治疗。自从Evens等通过监测红细胞TGNs浓度来控制6-MP给药后,这些患儿获得了满意的临床效果,在使用通常剂量的6%~10%,基本控制TGNs浓度在TPMT活性正常人的上限;而对于11%左右TPMT低活性患儿,美国St.Jude儿童研究医院报道,在控制TGNs浓度在正常人范围时,所需的6-MP剂量约为标准剂量的70%;相反,TPMT活性高的患儿,由于6-MP被清除得更快,可能还需要增加剂量。
TPMT活性的下降,是由于编码TPMT基因发生突变引起,已发现至少有8种TPMT基因突变,其中80%~95%的低活性和活性缺如由TPMT2、TPMT3A和TPMT3C引起,而通过普通的PCR和限制性片断长度多态性分析(PCR-RFLP)即能在治疗前了解这些信息,从而调整治疗用药。研究显示,存在TPMT基因突变患儿其TPMT酶活性降低1.4~9倍。根据报道,当给予TPMT纯合子缺乏的患者,正常口服剂量50~70mg/(m2·d)的6-MP时,出现不可接受的药物毒性。在这样的患者中RBC TGN的累积可以达到非常高的水平(2 000~4 000pmol/8×108 RBC),而大多数接受剂量是50~75mg/(m2·d)口服的患者,其RBC TGNs的累积中位数的范围是200~400pmol/8×108 RBC。通过评价TPMT作为一个可能的预后因素。尽管TPMT活力不是一个有统计学意义的预后因素,但红细胞中TGNs的最大水平与治疗结果有关。TGNs水平超过人群中位数的儿童,其无病生存率明显好于TGNs水平低于中位数的儿童。目前尚不清楚,是通过高的TGNs指示TPMT较低的活力(或其他无活性6-MP),来更全面的指导治疗(在这些研究中,6-MP和每周MTX通过口服常规给药)还是通过一些其他的与RBC TGNs相关的因素。在NOPHO研究儿童的连续化疗中,RBC TGNs和MTXPGs均被检测。再次口服两药物时,产物中RBC TGNs与MTXPGN浓度与产生较好的EFS密切相关,而单独的RBC TGNs浓度却不能。St.Jude的研究显示EFS与6-MP剂量强度有关而与TGNs无关。
3.6-MP的药动学和药效学 白血病患儿服用6-MP后血浆6-MP浓度的个体差异较大,同一个体不同时间用药亦存在较大差异。Lennard等发现患者口服6-MP 15min后,在血液中可检测到6-MP,也有患者服药60min后才可测出,按平均血浆药物浓度计算,6-MP在给药后2h达到最高点(345ng/ml),5h后基本上无法检出,半衰期为1.08h;而在TPMT缺乏症患者中,由于6-MP给药量少,在4h后即完全不能测出。给药后5h红细胞内TGNs浓度无明显变化。在按75mg/m2或更高剂量每日给药后,患者TGNs浓度将持续上升,28d可达到或接近稳定状态,在服药4周后测定TGNs,其浓度为126~832pmol/8×108 RBCs,中位数275pmol/8×108 RBCs,在6-MP停用后可测得TGNs半衰期为12d。TGNs浓度与不同给药方案无关,维持化疗的不同阶段其浓度亦无明显差异。
在ALL临床化疗中,影响6-MP长期持续服用的主要原因是粒细胞缺乏,许多患儿因此中断6-MP的使用。一些研究小组发现,红细胞TGNs浓度与检测后第14天的粒细胞计数及化疗持续时间成负相关,因此,在临床治疗中监测红细胞中TGNs浓度,对于TGNs浓度过高的患儿适当减少给药量,可能会避免此后因粒细胞过分低下而发生的严重感染,从而保持化疗的连续性。
现在大剂量化疗被认为是ALL治疗理想的治疗方案,但通常患儿的6-MP是按照体重或体表面积来计算。由于个体间的差异,部分患儿按此“标准”剂量不能产生足够的TGNs浓度,因此,对他们来说,“大剂量”将意味着低剂量及随后带来的高复发风险。有人提议用白细胞计数、血浆中6-MP浓度及TPMT活性作为6-MP给药的指标,但白细胞计数与6-MP用量的相关性尚不能确定,血中6-MP浓度因半衰期过短,药物在被消化道、肝吸收代谢过程中的消除变异大而不可靠,而治疗中TPMT活性往往升高。红细胞TGNs浓度可能是比较客观的衡量6-MP给药的指标,可以及早发现那些对6-MP过分敏感或耐受者,及早调整其剂量,使患儿有一合适浓度的TGNs,从而处于真正合适剂量的化疗作用下。
一般来说,体内蓄积的TGNs浓度越高,则细胞毒性越大,患儿的EFS可能越长。Lilleyman等发现,在TGNs浓度低于与高于中位数两组之间,复发率有明显不同,前者5年EFS为63%,而后者5年EFS为84%,故ALL患儿在化疗过程中,监测血中TGNs浓度,使之处于中位数以上,在总体上将降低患儿的复发危险,延长EFS。
4.6-MP的临床应用和不良反应 6-MP主要是作为细胞毒性药物用于化疗,虽然也有用于慢性粒细胞性白血病的报道,但主要是用于急性淋巴细胞白血病。在大多数化疗方案中,每天服用6-MP是长期维持治疗的重要组成部分,其目的是延长持续缓解时间。而用于DAT方案中的6-TG并没有像6-MP被广泛应用于ALL,是因为早期口服6-TG研究发现其效果并不比6-MP好,在后来的临床应用中两药物分别用于ALL和AML更多的是约定俗成,而没有完全的科学依据。
国外研究发现,提高6-MP的剂量后,ALL患儿的无病生存率亦明显提高。目前6-MP的给药剂量是75mg/(m2·d)×(3~4)周,或50mg/(m2·d)×8周,但对于那些TPMT活性高的患儿,可能他们的白细胞减少并不明显,他们体内的TGNs浓度过低,此时,“标准剂量”对他们意味着低剂量,从而可能发生残留白血病细胞增殖而复发。此外,由于HPRT的活性在晚间上升,因此,晚间是服用6-MP的最佳时机。
6-MP的不良反应包括白细胞下降、恶心呕吐、腹痛和其他胃肠道功能紊乱、肝功能异常和皮疹。骨髓抑制是其主要的细胞毒作用,亦是其用于化疗的原因,在用药过程中反复测定白细胞和血小板计数有利于对抑制程度的监测。而治疗前测定TPMT活性和治疗中测定TGNs浓度可以提高治疗的有效性、防止过强的骨髓抑制。肝功能损害往往导致药物减量甚至停药而影响化疗的效果,研究认为,肝功能轻度升高到40U/L左右,无其他肝功能指标异常的患儿,化疗的预后较好。此外,化疗中的继发感染也是使用6-MP过程中常见的,另有报道器官移植患儿服用6-MP后其发生肿瘤的风险提高。6-MP所引起的不良反应主要也是由于药物对增生组织DNA的破坏所致。
5.6-MP与其他药物的相互作用 6-MP的疗效和不良反应受到许多因素的影响,在药物的摄入、吸收、转化和与DNA的结合等各个环节均可发生。但一个主要因素是影响TPMT活性。动物模型中发现睾丸激素能增加TPMT活性,但在人体内尚无类似变化。
别嘌醇通过抑制XO的活性而影响6-MP口服时的药效,连续给药(100mg/d)7d后能使6-MP的峰浓度和AUC均增加5倍,28d后红细胞内的TGNs浓度增加3倍,并伴有白细胞的明显下降。但别嘌醇对小剂量静脉给药的6-MP无影响。
由于6-MP是一个抗代谢药物,内源性的嘌呤能明显影响其毒性,1~10μmol/L浓度的次黄嘌呤能保护急性早幼粒白血病细胞不受6-MP和6-TG的影响,次黄嘌呤浓度从1μmol/L增加到3μmol/L后,6-MP的半数致死浓度也需要增加3倍。
在ALL化疗过程中,6-MP常与MTX联合使用。已知MTX与6-MP有协同作用,Giverhang等的体外实验也表明,MTX能增加白血病细胞中TGNs的浓度,最高达2.4倍。MTX对TGNs的影响可能一方面抑制嘌呤的从头合成从而促进TGNs整合入DNA;另一方面,磷酸核糖焦磷酸(PRPP)是HPRT催化反应的协同因子,胞内PRPP的浓度越高则其细胞毒性代谢产物越多,由于MTX通过抑制嘌呤的合成而能增加细胞内PRPP的浓度,进而加速HPRT催化TGNs的合成。此外,MTX也能抑制XO的活性,从而增加体内细胞毒性代谢物的生成。
三、阿糖胞苷
1.阿糖胞苷的药动学和药效学 阿糖胞苷(Cytocine Arabinoside,Ara-C)是胞嘧啶的类似物通常被用于AML的诱导缓解和巩固治疗。鞘内用药时Ara-C对于神经系统白血病的预防和基础治疗都是有效的。Ara-C是药物的前体,在细胞内能被脱氧胞嘧啶激酶磷酸化为Ara-CTP(阿糖胞苷三磷酸),Ara-CTP能通过掺入到DNA链抑制DNA聚合酶的方式来抑制DNA的合成。细胞对母体药物的摄取并磷酸化为Ara-CTP是发挥细胞毒作用的关键步骤。在Ara-C的标准剂量下(0~100mg/m2),细胞的摄取是通过易化扩散及依赖一定量的跨膜的核苷载体位点。一旦稳态血药浓度超过转运的Km值(大多白血病细胞是10μmol/L),再进一步升高血药浓度时,不能引起细胞内Ara-CTP浓度的显著提高。应用高剂量Ara-C治疗(2~3g/m2)时,细胞的摄取不依赖转运能力而是通过被动扩散方式。
在AML中,白血病细胞形成和保留细胞内Ara-CTP的能力与临床反应相关;但对ALL的研究较少。注射Ara-C 100mg/m2超过30min,保留Ara-CTP的均值(±SD)在各免疫表型之间有显著不同:B系ALL 67%±25%;T系ALL 37%±15%;AML 34%±81%。有报道表明,与新诊断的ALL患者相比,复发患者有较低的Ara-CTP保留趋势。低Ara-CTP滞留的不利预后影响,可以通过持续的Ara-C输入减少,在这个过程中,循环血红细胞中的Ara-CTP稳态血药水平,随输入率成比例的提高,或通过使用高剂量的治疗方案,Ara-CTP的谷浓度水平在有反应性的患者中显著高于非反应性的患者,而两者Ara-CTP的峰浓度水平是相似的,这提示患者对Ara-CTP的耐受力可能比其血浆峰浓度的意义更重要。
白血病靶细胞内的Ara-CTP水平,已经被应用于高剂量Ara-C的治疗中。Plunkett等提出随着HD Ara-C的短期输入,最小影响的Ara-CTP谷浓度是75μmol/L。Estey等观察到在AML反应性患者中,血药稳态水平的中位数是122μmol/L;非反应性患者的是63μmol/L。此外,对于初发的成人AML患者,高剂量的Ara-C(3g/m2)治疗较标准剂量治疗更能成功地诱导完全缓解(CR),并且当HDAra-C掺入到持续化疗方案后,能导致较高的持续完全缓解。
Ara-CTP为Ara-C在细胞内的主要活性成分,其在细胞内的浓度与Ara-C的疗效直接相关。血浆中Ara-C通过细胞膜上核苷的转运进入细胞内后,需经过一系列的磷酸化过程(Ara-C→Ara-CMP→Ara-CDP→Ara-CTP),才能转变为有活性的三磷酸核苷即Ara-CTP,实现其细胞毒的作用。在这一系列转变中以第一步反应即Ara-C向Ara-CMP的转化最为关键,这一步反应的速度决定了整个一系列由Ara-C向Ara-CTP转化反应的速度。Ara-C向Ara-CMP转化的这一步反应是由脱氧胞苷激酶(dCK)来催化进行。所以,dCK的活性与Ara-C转化为Ara-CTP的能力密切相关。进入细胞内的Ara-C在胞苷脱氨酶(CdA)作用下迅速脱氨,变为无活性的阿糖尿苷(Ara-U)。CdA除了将Ara-C转化Ara-U外,也催化Ara-CMP转化Ara-UMP,从而减少了可向Ara-CTP转变的Ara-CMP含量,最终使细胞内的Ara-CTP生成量也减少。故细胞内CdA的活性也将直接影响最终Ara-CTP的生成量。从理论上说,细胞内Ara-CTP的积聚受多重因素的调节,包括Ara-C的跨膜转运,细胞内脱氧胞苷激酶(dCK)的磷酸化能力及胞苷脱氨酶(CdA)的脱氨基能力。Ara-C在体内的疗效取决于dCK和CdA之间的平衡。产生Ara-C耐药的主要机制为:①dCK的减少和缺乏;②CdA活性的增加;③dCTP(deoxycytidine triphosphate,dCTP)池的扩大。
在临床的经验治疗中,Ara-C被更多地用于急性非淋巴细胞白血病的治疗。国外的研究证明,髓系的原始细胞较淋巴系的原始细胞转化Ara-C为Ara-CTP要多。本实验的结果也发现,在AML和ALL(B-cell)细胞中,其dCK和CdA的活性存在着明显的差异。AML细胞内dCK和CdA的活性均较ALL(B-cell)细胞内的dCK和CdA的活性高。其中dCK活性高出约1倍,CdA活性则是淋巴细胞的1.8倍,两者均有统计学差异。而代表两者平衡的CdA/dCK比值AML组虽较ALL组为低,但在统计学上两者无差异。这个结果看似与临床上Ara-C的实际使用情况不相符合,但需要注意的是,Ara-C在细胞内的代谢除了与dCK和CdA的活性有关外,细胞膜上核苷受体的转运对Ara-C在细胞内的积聚及其代谢也起着重要作用。有实验通过对放射性核素标记的特异性配体(NBMPR)结合的核苷受体示踪显示,结合斯卡查德分析(Scatchard analysis),用于推断蛋白质结合部位和性质的方法)发现平均每个髓系的原始细胞细胞膜上有约10 000个核苷转运位点,而相应的在急性淋巴细胞白血病原始细胞膜上核苷转运位点数目为2 300个。相对较高的核苷转运使髓系的原始细胞内Ara-C的积聚浓度较急性淋巴细胞白血病原始细胞内的浓度要高,有关研究显示CdA/dCK比值在两者中的差异,均提示髓系的原始细胞内Ara-CTP的生成应高于相应在淋巴细胞内的量,从而导致髓系白血病使用Ara-C的疗效优于淋巴细胞白血病。
通过对AML患者dCK和CdA的活性的观察,发现dCK活性与患者的临床疗效或疾病进展程度有着较为重要的联系。dCK活性在CR患者明显高于NR患者,前者活性约为后者的3倍(P<0.001)。在复发后治疗的4名患者中,2名缓解者的CdA/dCK比值明显低于2例未缓解者(10.02vs 40.26),CdA的活性在两者相差并不大。因此,CR患者的CdA/dCK比值较NR患者为低(9.90vs 23.05),两者有统计学差异。初发患者与复发患者相比,dCK的活性明显要高,约为复发者的2.6倍,(P<0.01),这与Colly等所报道的相似。而CdA活性两者也相近。初发者与复发者CdA/dCK比值分别为11.22vs 25.67(P=0.097 8),在统计学上无显著差异。通过本实验我们观察到在AML患者中CdA的活性差异并不大,对Ara-C代谢的影响更多地取决于dCK的活性。dCK活性程度高,CdA/dCK的比值低,则临床使用Ara-C的效果更好。至于引起细胞内dCK活性降低的原因,有研究发现,在Ara-C耐药的细胞株中,dCK基因大多存在着某些位点上碱基的突变及缺失,并导致相应mRNA水平的下降。在部分Ara-C耐药的儿童患者中,即使未测到有dCKcDNA序列的变异,但由于细胞内脱氧胞苷三磷酸盐池的增大,使dCK活性的表达相对降低,从而导致了Ara-CTP的生成相对减少。这些都表明dCK基因序列或其表达的变化是引起细胞内dCK活性下降的主要原因,也是临床对Ara-C产生耐药的主要原因。
一般随着年龄的增长,化疗的疗效也会有所减弱。在本研究中,为了观察年龄变化与细胞内影响Ara-C代谢的酶的活性之间的关系,我们人为地将患者以50岁为界限划分为两组。结果发现年龄对体内CdA活性的影响较大。年龄≥50岁组患者细胞内CdA活性普遍高于年龄<50岁组,两者存在统计学差异(P<0.05)。在AML患者中,这种差异尤为明显,年龄≥50岁组患者的CdA活性比年龄<50岁组高出近1倍,两组存在非常显著差异(P<0.01)。因此,从理论上分析,随着年龄的增大,体内对Ara-C的灭活也相应增加,从而导致Ara-C疗效的下降。从参加试验的患者的具体疗效来看,大于50岁组的CR率为50%(6名患者中有3名CR),而小于50岁组的CR率为82.35%(17名患者中有14名CR)。这也与实验结果相符。此外研究还发现,性别对细胞内dCK和CdA的活性也有影响。男性患者细胞内dCK和CdA的活性均比女性患者高,尤以dCK活性为明显。AML组中,男性dCK活性为女性的2倍,两者有统计学差异。表现在治疗效果,8名男性患者中有7名CR,CR率87.5%;而15名女性患者中有10名CR,CR率66.67%。因此,细胞内dCK、CdA的活性程度与Ara-C的疗效密切相关。
Ara-C是治疗急性白血病的常用药物,如何在使用该药之前有效地预测其疗效,进行个体化治疗,这是我们还需努力的方向。从理论上说,Ara-C的跨膜转运率高,细胞内dCK的磷酸化能力强,CdA的脱氨基能力弱,则细胞内Ara-CTP的积聚更多。已有实验表明,加用dCK的活性促进剂或CdA的抑制剂,均可使细胞内生成的Ara-CTP含量增加。通过研究还发现白血病细胞内dCK、CdA活性程度及CdA/dCK的比值与Ara-C的疗效密切相关,可作为预测患者对Ara-C化疗是否敏感的一个监测指标。dCK的活性高,CdA的活性低,CdA/dCK比值小于10,临床对Ara-C的疗效可能较佳。另外,由于细胞内dCK的活性与dCKmRNA水平呈正相关,故国外报道dCKmRNA的测定也可作为患者是否选用Ara-C的一个预测指标。虽然目前测定dCK和CdA活性的方法还存在着操作繁琐、费用较昂贵等缺点,难以向临床普及。但相信随着今后实验技术的不断发展和完善,对dCK、CdA甚至dCKmRNA的检测,一定会有利于指导临床更合理地使用Ara-C。
通过持续的静脉输入,脑脊液(CSF)中的Ara-C浓度是血浆浓度的40%~50%。引起较高的CSF水平的原因,可能是由于CSF中的胞苷脱氨酶的活性低,使得Ara-C在CSF中的停留时间短(半衰期为1.8~2.9h),Ara-CTP蓄积在CSF的白血病淋巴细胞中,其半衰期为8.1~36h。Ara-C在CSF中的清除率接近CSF的更新率。
2.Ara-C的药物遗传学 伴有Downs综合征的AML患儿与非Downs患儿相比,ESF率增高并且复发率降低。Downs综合征患儿原始粒细胞对Ara-C的敏感性近似于非Downs患儿的10倍[暴露于Ara-C 72h,IC50分别是(108.3±66.8)nmol/L和(1040.8±272.9)nmol/L]。经5μmol/L Ara-C孵育后,Downs综合征患者原始粒细胞中Ara-CTP的水平,明显高于非Downs的患者(值分别是621.4与228.4pmol/mg protein)。细胞中Ara-C的代谢增高可能是导致Downs综合征的AML患者有较高存活率的一个因素。这种增高的原因可能是,位于21染色体上的胱硫醚-B合成酶和甘氨酸核糖核苷转移酶的基因量增加的结果,这改变了细胞内还原型叶酸池,结果使脱氧胞嘧啶的浓度下降,随之减少了对脱氧胞嘧啶激酶的反馈抑制,使Ara-CTP的量增高。
3.Ara-C的与其他药物的相互作用 Ara-c与大量药物存在着相互作用,这已经被用来提高白血病幼稚细胞中Ara-c的磷酸化反应。Ara-C与2-氢脱氧腺苷酸〔2CD〕,一种脱氧腺苷类似物,联合应用时,可以引起协同或拮抗作用。2CDA在细胞内被脱氧胞嘧啶激酶磷酸化为2CDA单磷酸(2CDAMP),继而被其他激酶转化为三磷酸形式2CDATP。2CDATP通过抑制核糖核苷还原酶来提高脱氧胞嘧啶激酶的活力,因此,同时给予2CDA和Ara-C应该导致细胞内Ara-CTP水平的提高。然而,由于Ara-C和2-CDA有共同的转运机制,并且脱氧胞嘧啶激酶磷酸化两者的效率相似,所以当同时给药时,这两种药物可能会出现竞争抑制。持续静脉滴注2CDA的同时给予Ara-C,9个患者中有7个出现了Ara-CTP的蓄积率提高40%。然而,可能是由于Ara-C的活力优于2CDA,因此减弱了2CDA对Ara-CTP蓄积的影响。这种影响可以通过跟随在Ara-C给药后或给药同时输入2CDA浓缩药团,来防止发生。此项研究正在一个前瞻性的随机研究中进行。
氟达拉滨是阿糖腺苷的一种核苷酸类似物,也已经与Ara-C联合应用。静脉注射后氟达拉滨被迅速地去磷酸化形成母体核苷酸F-Ara-A,并被快速转运至细胞。此代谢产物被胞嘧啶激酶再度磷酸化为5′-三磷酸-氟达拉滨(F-Ara-ATP)。同2-CDA一样,氟达拉滨也能提高脱氧嘧啶激酶的活力,并且也应导致较高的Ara-CTP蓄积率。F-Ara-ATP增高了Ara-C的合成反应,而Ara-CTP抑制了氟达拉滨的磷酸化反应。当氟达拉滨开始输入4h后,给予次级剂量的Ara-C时,Ara-C可引起F-Ara-A剂量依赖性的重分布,以Ara-C输入过程中血浆F-ara-A水平有一过性的升高为证据,并且随之减小了F-Ara-A的终末半衰期。与Fludarabine单独治疗相比,联合了Ara-C后,F-Ara-ATP的峰浓度减低了43%。以一个浓度依赖方式输入Ara-C后,细胞内F-Ara-ATP的终末半衰期也被减小。相反当Ara-C首次剂量在Fludarabine开始输入4h后给予时,循环血液的AML幼稚细胞中Ara-CTP的合成率增高。Fludarabine输入后,Ara-CTP AUC和蓄积速度在AML细胞中分别增高1.8倍和2.0倍。Ara-C血浆浓度的中位数和血循环中幼稚细胞中Ara-CTP的清除率不受Fludarabine输入的影响。在难治性或复发性AML患者中,与高剂量(23%)或中剂量(缓解率是25%)Ara-C相比,这种联合应用使缓解率显著提高(30%)。特别是对于首次缓解已经持续1年以上的患者,即使是以前已经用过高剂量Ara-C,对联合治疗也有反应,表明白血病仍保留有对Ara-C的敏感性。
四、蒽 环 类
柔红霉素(Daunrobicin)和多柔比星(Doxorubicin)均属蒽环类(Anthracyclines)有相似的药代动力学特征。两种药都有长的血浆终末半衰期,并表现为广泛的组织结合能力。在分布相,由于药物向除了CNS之外组织的渗入,并结合到DNA上,所以血浆药物水平迅速下降,药物的浓度与特定组织中DNA的含量成比例。血浆中主要的Anthracycline暴露作用,不是由柔红霉素,而是由Cytosolic Aldolketo还原酶形成的13-羟化代谢产物Daunorubicinol引起的;这在多柔比星恰恰相反,因为代谢物Doxorubincinol的浓度总是低于多柔比星浓度。在骨髓干细胞中,前者代谢物大约占柔红霉素细胞毒活力的10%,且后者将近有多柔比星抗肿瘤活力的5%,但可能有更潜在的心脏毒性。
AML中,柔红霉素和Daunrobicinol在白血病幼稚粒细胞胞质浓度与反应性相关,而两者对结果却没有预见性。柔红霉素在血浆中的浓度与其在骨髓中的浓度不相关,但在白细胞中,药物浓度与骨髓中有核细胞内的药物浓度呈正相关,与诊断时外周血幼稚细胞的数量呈负相关。外周血白血病细胞内达到有效的药物水平可能是由整体肿瘤细胞承担的。与正常细胞相比,患者的幼稚细胞中柔红霉素还原酶活力的提高获得缓解的可能性更大。在AML或ALL患者中,细胞内柔红霉素和Daunorubicinol的AUC值在反应性患者中显著高于非反应性患者。与之相似,Marie等发现与那些对治疗无反应的患者相比,达到完全缓解的AML患者细胞内柔红霉素浓度的更高。
蒽环类的心脏毒性包括3类。第一类是急性与亚急性期,主要表现是,在治疗后立即发生,包括有一过性的心律失常,伴有或不伴有电生理改变的心包心肌炎综合征,或急性左心衰竭;第二类是与总剂量相关的延迟性的心肌病,典型的表现发生在治疗1年内;第三类是蒽环类诱导的慢性的心脏毒性,以心脏功能不全、心律失常为特征,可在最后一次用蒽环类多年后发作。
慢性心肌病潜在的危险因素包括高蓄积剂量、曾经接受纵隔照射(≥2 000Gy)、年龄大于70岁、以前存在心血管疾病。另外,在婴幼儿期接受过治疗的青年,可能更可疑发生慢性的蒽环类诱导的充血性心力衰竭,特别是那些在婴儿期接受治疗的患者。新型的蒽环类类似药物,如去甲氧柔红霉素(Idarubicin)、脂质体柔红霉素(Liposomal Daunorubicin)或脂质体阿霉素(Liposonal Doxonubicin)可能会减少心脏毒性。目前尚不清楚每一个体的蒽环类剂量的与累积量之比达到什么程度能引起蒽环类心脏毒性危险度的提高。另外,在可能性的药效学关系上,目前没有有用的数据显示,血浆蒽环类的暴露与随后的心脏毒性相关。
五、表鬼臼毒素
表鬼臼毒素(Podophilotoxine),如依托泊苷(Etoposide,VP-16)和威猛(Teniposide,VM26)已被列入到治疗儿童AML和ALL的前线和复发的研究中。母体药物通过影响拓扑异构酶Ⅱ的作用,干扰细胞双链DNA断裂后的正常连接来发挥作用。另外,两种药物在人类通过细胞色素P450(CYP3A4)代谢,形成反应性的儿茶酚胺、半醌、和醌等代谢产物,这些代谢产物也可能具有细胞毒活性,尽管这一反应的量的重要性还未建立。10%~70%的药物原型可以从尿中重新获得,长期的静脉或口服用药和短期静脉输入相比及VM26和VP16相比,尿中获得的非代谢的药物更少。
VP-16和VM26在循环的正常血细胞或白血病原始粒细胞中都不能蓄积。两者都能高度的与血浆蛋白结合,是糖蛋白-P的底物。因此,静脉或口服给药后ALL患者CSF中的药物浓度仅能达到血浆药物浓度的0.3%。然而由于CSF中蛋白相对于血浆而言浓度是非常低的,所以通过系统的给予VP16,来达到有效的治疗CNS白血病是可能的。当单独口服VP16和小剂量VP-16(如0.5~1.0mg)鞘内注射后,可观察到CNS中原始的白血病细胞部分被清除。
已经有几个研究中报道,VP16或VM26的血浆浓度与急性造血系统或消化道毒性有关。这种毒性可能既依赖于暴露的细胞毒浓度的耐受力又依赖其浓度的量。在接受自体骨髓移植的患儿中,24hVP-16后的剂量浓度大于8.5μmol/L的患者比小于8.5μmol/L的患者干细胞植入要慢。
VM26的固定剂型是10mg/ml,其中乙醇占体积的40%,因此给予高剂量的VM26(如500mg/m2),超过短期(如≤4h)时,对于清除VM26低的儿童能导致嗜睡、高血压和代谢性酸中毒综合征。给予较高剂量的VM26后,乙醇剂量超过20mg/m2,或血浆乙醇浓度大于60mg/dl时,有3个ALL患儿,立即出现了这种综合征。延长注射时间到8h,希望能减少儿童中高剂量Teniposide引起的潜在的乙醇毒性。
对于伴有复发和难治性急性白血病的患儿,在持续输入Teniposide研究的Ⅰ~Ⅱ阶段,经系统的给予Teniposide后,通过检测AUC及稳态血药浓度,得出抗白血病反应和毒性之间存在着正相关。幸运的是:反应性的量-效曲线位于毒性曲线的左侧,说明这可能是Teniposide有用的治疗范围(特别是达到一个目标水平,即系统的暴露剂量既能达到是一个合理的、预期的效果,而这个范围可能是毒性也可接受的)。
六、全反式维A酸(All-trans-retinoic acid)
全反式维A酸(ATRA)已经广泛应用于急性早幼粒细胞白血病诱导缓解的治疗,并且这个药物的药动学特征十分有趣。ATRA通常是口服给药的,一个疗程几周。ATRA的血药浓度或AUC随每天服药逐步的下降,以致ATRA用药7d后与用药第一天相比AUC降低了8倍。口服和静脉注射同样都能产生这种快速清除。猜测可能是脂质过氧化氢酶对ATRA的诱导使之清除更容易,而不简单的是由P450或其他药物代谢酶诱导的结果。尽管其他的机制无疑也在发挥着作用,ATRA潜在的自身诱导清除能力,已经被假定为在APL对ATRA耐受力的提高中发挥作用。间歇的而不是持续的ATRA给药,被用于处理减少这种快速清除,尽管是否这一给药方式有临床意义尚未得到证实。
一些数据表明,系统的和细胞内的ATRA暴露与抗白血病的疗效之间有关系。APL中一个没有达到完全缓解的患者与已经明确达到完全缓解的患者相比,口服ATRA剂量30mg/(m2·d)产生的血药浓度较低。另外,成年人和儿童APL患者的幼稚细胞,在体外用1μmol/L ATRA孵育时,幼稚细胞内ATRA浓度蓄积高的患者比蓄积低的患者,更可能达到一个完全的反应。对ATRA吸收差的患者更倾向于,年龄较大和有更早的毒性者有死亡发生的可能,所以尚不清楚提高药物的吸收是一个可以被治疗利用的变量,还是这种增高的吸收仅与APL更具反应性的表型有关。
七、门冬酰胺酶(Asparaginase,L-Asp)
门冬酰胺酶是治疗儿童ALL的一个最有效的化疗药物之一,因此,是公认的ALL诱导缓解治疗标准方案中主要药物之一,它利用了正常和白血病细胞之间代谢的不同。正常细胞能够合成大多数的氨基酸,包括有门冬酰胺;然而一些白血病细胞中门冬酰胺的合成能力下降,因此需要外源性的门冬酰胺。门冬酰胺酶不能进入细胞,但在细胞外门冬酰胺能被水解成门冬酸和氨,因而夺取了白血病细胞中的门冬酰胺的来源。门冬酰胺依赖的蛋白合成被阻止,而且随后核酸的合成被抑制,使白血病细胞的增殖减少。
1.药动学 不同制剂的门冬酰胺酶在药代动力学特征上不同。门冬氨酸酶是从多种天然资源中分离出来的,如E.coli(大肠埃希菌)和Erwinia chrysanthemi(菊属欧文菌)。PEG门冬酰胺酶是天然E.coli门冬酰胺酶,在不影响到酶活性的位点与聚乙烯乙二醇形成的共价结合物。这一结合物阻止了网状内皮系统的摄取并延长了药物的清除半衰期而且可以降低它的免疫原性。尽管肌内注射是目前更常用的给药方式,但静脉给予E.coil制剂在药动学方面已经被广泛的研究。门冬酰胺的清除半衰期依赖于其使用的制剂和是否患者对门冬酰胺酶表现高敏反应。在25 000U/m2的剂量下,Erwinia门冬酰胺的半衰期是(0.65±0.13)d,明显的短于E.coli门冬酰胺酶(1.24±0.17)d,而且两种天然制剂的半衰期均比2 500U/m2剂量下PEG门冬酰胺酶的半衰期(5.37±3.24)d短。尽管被研究的患者数少,但对E.coli门冬酰胺酶存在高敏反应的患者,E.coli和PEG两种制剂的半衰期均缩短。
2.药效学 有70%的患者可以产生抗门冬酰胺酶抗体,许多没有出现高敏性的临床证据。对于对门冬酰胺酶有临床高敏性的患者,其高敏反应出现的前后,抗体的水平都较高。另外,接受门冬酰胺酶超过时间的患者,不管是否有过敏的临床表现,抗体水平也会增高,提示这些抗体可能通过缩短门冬酰胺酶的半衰期,或通过静脉输入后吸收或干扰酶的活力来阻碍其抗白血病的作用。门冬酰胺酶治疗中伴有症状明显的过敏反应的患者,其血浆门冬氨酸的浓度没有低于定量的限度,然而,目前仍缺乏关于抗白血病亚临床过敏反应这一不良反应的临床研究。
已经有报道,连续的暴露于门冬酰胺酶能减少血浆门冬酰胺的耗竭。例如,第一次暴露与Erwinia门冬酰胺酶的过程中,观察到血浆中门冬酰胺在80%患者中被耗竭,而第二次或第三次给药时则有25%患者被耗竭。
门冬酰胺酶不能直接注射到CNS中,然而血浆门冬酰胺水平与CSF中的水平相关。当血浆中门冬酰胺水平降低时,CSF中的门冬酰胺水平也降低。可能与浓度梯度有关,因此在阻止脑脊膜白血病中门冬酰胺酶也能发挥作用。Erwinia门冬酰胺酶的一个疗程的最后一次给药后的3d和5d,患儿中CSF门冬酰胺的水平低于定量水平(<0.2μmol/L),分别占75%和37%。所有患者在诊断时及直到第19天都可以检测到CSF门冬酰胺水平,CSF门冬酰胺的值与基线值之间没有显著不同。特别要提到的是给予天然E.coli门冬酰胺酶的两种不同产品制剂时,有显著的药动学和药效学的不同。
3.L-Asp与MTX及Ara-C的药物相互作用 门冬酰胺酶显著地影响细胞的蛋白合成,引起大量的时间依赖性的药物间的相互作用,蛋白的合成抑制可以减少MTX或Ara-C的细胞毒作用,门冬酰胺酶对前一种药物的影响可能与减少MTXPG相关,相反给予门冬酰胺酶之后,当再给予其他的抗代谢药物是能引起治疗的协同作用。门冬酰胺酶引起蛋白合成的抑制能导致低蛋白血症,随后能转变蛋白与抗癌药物(如表鬼臼毒素)间高度连接的蛋白键。
4.L-Asp作用与门冬酰胺合成酶(AS)活性相关
(1)不同肿瘤细胞门冬酰胺合成酶(AS)活性存在差异:L-Asp作用的强弱取决于其在体内的沟活性水平,而沟活性水平则与细胞内AS表达和活性水平负相关,因此,了解不同来源肿瘤细胞的AS活性的遗传差异,对于急性白血病的治疗具有重要意义。
早在1995年,Codegoni等就发现,除淋巴细胞(T、B、NK)和ALL细胞外,单核细胞性白血病肿瘤细胞其AS基因也仅低水平表达,而且在用10 000U/m2的L-Asp治疗后,基因表达仍未被诱导增加。随后的体外实验发现,AML-M5患者白血病细胞对L-Asp的敏感度较其他AML类型高,而ALL患者中,与Common和Pre-B型ALL相比,T-ALL的白血病细胞对LAsp存在药物抵抗。Dübbers等发现,虽然总体上ALL和AML患者白血病细胞中的AS活性无明显差别,但各亚型间则存在差异,即B-ALL和AML-M5两种亚型患者的白血病细胞AS活性水平最低。
体外实验证实,不同类型白血病细胞株,AS水平及对L-Asp作用的影响存在差异,耐药细胞株如MOLT-4/R及BAIL-1,它们的L-Asp ID50是敏感细胞株MOLT-4和BAIL-1的约100倍,而前者AS活性较后者显著增高。用表达AS基因的反转录病毒转染敏感细胞株MOLT-4后,MOLT-4的AS水平显著升高,而且,单独AS蛋白的表达就足以引起细胞对LAsp耐药。进一步证实不同肿瘤来源的细胞,其AS活性存在差异,而这种差异直接影响LAsp的作用,因此了解各患者肿瘤细胞中AS水平,特别是AS基因的表达调控机制,对于制订合理的个体化给药方案,指导临床化疗具有重要意义。
(2)AS基因表达调控机制:目前对于AS基因表达调控通路的认识,主要涉及内质网应激和氨基酸的调控作用,对于L-Asp引起的AS基因表达则为氨基酸的调控作用,与内质网应激无关。在大部分哺乳动物细胞中,AS基因是一种“看家基因”,能表达AS,催化门冬氨酸和氨合成门冬酰胺,当细胞内门冬酰胺、谷氨酰胺、亮氨酸和异亮氨酸缺乏时,均可诱导AS的mRNA表达增加。至于是通过何种信号通路诱导这种反应目前尚未弄清。此外,还有学者发现,L-Asp能诱导AS基因去甲基化,直接激活AS基因表达。
Guerrimi等研究AS基因结构序列发现,在其启动子序列中,-70~-66区域是氨基酸调控所必需的,任何碱基的突变都可导致氨基酸调控作用的消失,并称这一区域为“AARE(amino acid response element)”。Bruhat等比较AS基因及CHOP基因(也是一种受氨基酸调控基因)的启动子序列后发现,在它们的AARE区域存在9核苷酸长度的相似序列(位于AS基因启动子的-60~-68):5′-(A/G)TT(G/T)CATCA-3′,并称为AARE核心,认为其在真核细胞基因转录的氨基酸调控中是必需的。凝胶电泳显示,AARE核心序列结合着多蛋白复合体,AARE核心的突变可损害启动子的氨基酸调控功能,使多蛋白复合体不能与之结合。
综上所述,影响L-Asp作用的因素是多方面的,包括L-Asp生物来源、机体免疫反应及门冬酰胺合成酶活性差异等,了解它们的特性,特别是门冬酰胺合成酶活性基因的遗传多态性,以及这种遗传多态性与酶活性、临床疗效之间的关系,对于制订合理的个体化给药方案,有效治疗白血病具有很重要的意义。
八、糖类皮质激素(Glucocorticoids)
泼尼松和地塞米松通常被用于ALL患儿诱导、重复诱导和持续的维持治疗方案中。有报道表明,持续的维持化疗中联合加入地塞米松能收到极好的疗效。B系ALL患儿的幼稚细胞,在获取同源的骨髓提供基质的系统中进行短期的培养(4d)时,地塞米松的效应中位数是泼尼松的5.5倍,在缺乏基质的培养中,据报道,患者幼稚细胞的药效中位数之间的差异有16.2倍。因此,根据淋巴细胞的细胞毒作用的不同,地塞米松的优势剂量还不清楚。
总之,ALL方案中泼尼松的剂量大约是40mg/(m2·d);地塞米松是6~8mg/(m2·d)。LALGB的研究中发现,6~8mg/(m2·d)的地塞米松用药比40mg/(m2·d)的泼尼松用药CNS的复发的可能性更小。这些剂量是否与毒性有等价关系还不清楚,在决定选择地塞米松和泼尼松,同等药效剂量之间的比例上还存在争议。有报道表明,依赖药效学的终点来比较患者口服地塞米松的效力(关于皮质醇抑制)高出了泼尼松的17倍,提示目前在许多ALL方案中这6.7倍的不同,可能导致地塞米松比泼尼松存在更高的糖化可地松的暴露,是否地塞米松的毒性比泼尼松大还不清楚。尽管糖化可地松的药效学在ALL患者中还没有研究,但有些数据表明,肾移植后出现坏死性血管炎的患者(尤其是血浆浓度较高的患者),较未出现的患者泼尼松的清除率低。
九、长春新碱(Vincristine)
长春新碱的药动学和药效学方面可用的数据很少,大多是由于检测存在于血浆中的极低浓度的长春新碱是困难的。放免的方法显示,曾发生过与长春新碱相关的神经毒的患者(大多为成年人),比未发生过的患者AUC高。由于增高的AUC和神经毒作用在伴有碱性磷酸酶增高的患者中更常见,并且长春新碱的胆汁排泄状况,代表了清除长春新碱的一个有意义的部分。因此,建议对于胆道梗阻的患者应减量使用。最近的研究中,尽管使用更特异的HPLC方法,ALL患儿中,神经毒性与长春新碱AUC之间的关系仍不明确。
有报道显示,在非常小的患儿中(特别是那些体表面积小于0.5m2的患儿),神经毒的发生频率高,这些患儿给予的长春新碱剂量通常要比年长儿更低些。这种高频率神经毒性的原因是由于对药物的清除差,还是组织对其敏感性的提高尚不清楚。
十、环磷酰胺(Cyclophosphamide,CTX)
环磷酰胺(Cyclophosphamide)是经典的常用的烷化剂(oxazaphosphorines),已经被列入到ALL持续化疗和巩固治疗的方案中,尽管与其他药物相比其益处还存在争议。在一个前瞻性的研究中,患儿任意地被分成全剂量和半剂量化疗组,化疗药包括有MTX和CTX,在全剂量组缓解率更好。可清楚地看到CTX的贡献。尽管最近一些组已经将异环磷酰胺(Ifosfanide)并入到ALL方案中,与CTX相比Ifosfanide在药动学方面有些不利:也就是大部分的药物易于经N-脱氯乙酰化成为无活性的、潜在的毒性代谢产物。在急性白血病中,对于烷化剂没有公开的可用的药效学数据。代谢物浓度与母体药物浓度相比,前者与药效学更相关,因为这些物质是活性代谢所必需的。不过,对于一个乳腺癌患者,她接受了CTX作为持续化疗的一部分,其发生的心脏毒性与较低的母体药物AUC或更有活力的烷基化代谢产物的AUC相关。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















