不同年龄的儿童处于不同的发育阶段,组织器官的生理功能和生化代谢尚不完善,随着年龄的增长,在解剖、生理、生化、病理、免疫等方面不断变化,对药物的吸收、分布、代谢、排泄功能具有各自特点。因此,大多数药物在小儿的不同阶段其药动学特点与成人相比有明显差异。
1.吸收 药物的吸收是指药物经用药部位进入血液循环的转运过程,吸收的速度与程度决定于药物的理化特性、机体的状况和选择的给药途径。
(1)口服给药:药物口服吸收主要受胃肠道p H、胃排空时间和吸收面积等因素的影响。
①新生儿药物吸收的特点:新生儿出生后的24~48h,胃液p H为1~3,出生10天后回升至6~8,接近中性,然后逐渐下降,至2岁后才达到成人水平。因此,新生儿对不耐酸的口服青霉素类(青霉素、氨苄西林、阿莫西林)吸收完全,生物利用度高,血药浓度较成人高。又因新生儿胃酸缺乏,胃排空时间长达6~8h,造成主要由胃吸收的β内酰胺类抗生素吸收良好。并且新生儿肠管长度8倍于身长(成人4~5倍),肠壁薄、黏膜血管丰富、通透率高,致相对吸收面积增大,对药物吸收增加。新生儿小肠液p H高,可影响药物的化学稳定性和非离子态转运,肠道菌群量少,菌种特点不同且变异性大,由于细菌代谢类型不同,也可影响一些药物的吸收。新生儿肠蠕动不规则,表现为分节运动,使药物吸收无规律,难以预测。因此,新生儿口服给药的吸收与成人不同,使一些药物的吸收量和吸收速率增加,如半合成青霉素类,而有些药物则吸收减少,如苯巴比妥和苯妥英钠、对乙酰氨基酚等,有的药物的吸收量则与成人相仿,如地西泮、地高辛及易吸收的磺胺类药物等。主要在十二指肠部位吸收的药物表现吸收缓慢,达峰时间延长,如阿司匹林、红霉素等。
②婴幼儿药物吸收的特点:婴幼儿经口给药时,因吞咽能力差及惧怕服药而哭闹拒服,易造成呛咳及气管异物,因此宜用如糖浆剂、合剂、颗粒剂等液体制剂替代片剂、丸剂等固体制剂,但油类药液口服应注意避免引起油脂吸入性肺炎。出生6~8个月婴幼儿开始有胃肠蠕动,但婴幼儿胃排空时间缩短,十二指肠对药物的吸收速度快于新生儿。
③儿童期药物吸收的特点:较大儿童胃肠道对药物的吸收已接近成人,但首关消除能力强,对于首关效应较强的药物(如普萘洛尔等)生物利用度低,个体差异大。
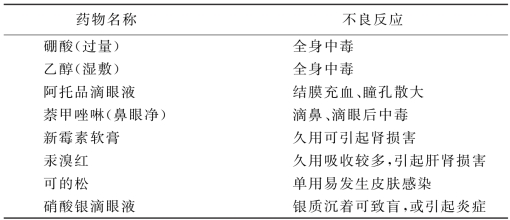
(2)皮肤、黏膜给药:新生儿、婴幼儿的皮肤、黏膜面积相对较成人大,且皮肤角化层薄,黏膜娇嫩,某些药物可通过口腔、直肠、鼻、眼等黏膜和皮肤吸收。但是,由于吸收速率快,作用强,尤其皮肤有炎症或破损时,吸收的更多,可引起一些药物发生不良反应,甚至中毒。如大面积使用硼酸制剂,可被皮肤吸收引起腹泻、皮肤病变,以致肝中毒而死亡;使用皮质类固醇软膏,经皮肤吸收后,引起全身中毒,影响生长发育;水杨酸软膏可引起水杨酸中毒;萘甲唑啉给新生儿滴鼻或滴眼后可中毒;聚乙烯吡咯烷酮碘可致碘过敏、甲状腺功能减退、皮肤肿痛等。经皮肤黏膜吸收产生不良反应的药物见表1-1。
表1-1 经皮肤黏膜吸收产生不良反应的药物
(3)肌内或皮下注射:药物吸收主要取决于局部的血流灌注。新生儿肌肉组织和皮下脂肪少,局部血流灌注不足,药物多滞留于局部组织,有时形成硬肿或结节,影响吸收,故肌内注射地高辛、氨基糖苷类抗生素和地西泮时吸收不规则。
(4)静脉注射:药物直接进入血液循环,是可靠的给药途径,该给药方式尤其适用于急症新生儿,用时多从头皮或四肢小静脉滴入。一般不通过脐静脉给药,因脐静脉给药可引起肝坏死,脐动脉给药可导致肢体或骨坏死。
(5)直肠给药:作为新生儿给药的一种途径,该给药方式既简便又不易引起呕吐。但由于新生儿便次多,直肠黏膜受刺激易引起反射性排便,或因粪便的阻塞使药物的吸收不规则,若采用此法一定要在小儿排便后进行。使用栓剂应放置于括约肌以上,避免自行脱出。新生儿便秘不宜使用开塞露和甘油栓,否则可致久泻不止,宜用液状石蜡或适当地调整饮食,如饮用果汁等。
(6)其他给药途径:对新生儿脑脊液给药一般应慎用,因为新生儿血脑屏障通透力强,静脉给药可使一些药物在脑脊液内达到一定浓度,除非一些药物难以通过血脑屏障,可考虑使用鞘内给药,如在治疗结核性脑膜炎时使用链霉素;在治疗脑膜白血病时鞘内注射甲氨蝶呤、阿糖胞苷等。
婴幼儿皮下、肌内注射吸收亦不完全,适宜静脉给药,有些药物还可使用滴剂、喷雾剂、栓剂,通过口腔、直肠、鼻、眼等黏膜和皮肤给药吸收。
儿童胃肠外给药吸收特点:与成人相似。
2.分布 许多因素影响儿童的药物分布,如体液组分、血浆蛋白结合、血-脑脊液屏障等。新生儿、婴幼儿药物分布与成人差异明显。
(1)体液组分:儿童的体液量、细胞外液、间质液均相对高于成人。如新生儿的体液、细胞外液分别占体重的80%和45%,1岁婴儿的体液、细胞外液分别占体重的70%和30%,儿童的体液占体重的65%,而成人上述两项的比例分别为60%和15%~ 20%。因此,对于儿童来说,水溶性药物的分布容积增大,一是可以降低药物峰浓度而减低药物的最大效应;二是减慢药物消除,延长药物作用维持的时间。这说明,若欲达到与成人相似的血浆药物浓度,儿童需要较大的初始药物剂量,而且首剂量之后给药间隔需延长。
婴儿特别是新生儿,体脂肪与体重的比例低于成人。早产儿体脂肪的含量仅占其体重的1%~3%,而足月儿则占其体重的12%~15%。随着年龄的增长,体脂肪含量有所增加。幼儿脂溶性药物分布容积较新生儿期大。体脂肪比值的高低,可影响脂溶性药物的分布。由于新生儿、婴幼儿脂肪含量低,脂溶性药物不能与其充分结合,分布容积小,血浆中游离药物浓度升高,这是新生儿容易出现药物中毒的原因之一。同时,新生儿、婴幼儿的脑占身体比例较成人大得多,而脑组织富含脂质,血脑屏障发育又不完全,通透性较成人大,使得脂溶性药物易分布入脑,这是新生儿、婴幼儿容易出现中枢神经系统反应的重要机制之一。
(2)药物与血浆蛋白结合率:影响药物分布最重要的因素是血浆蛋白与药物结合的程度。新生儿血浆蛋白含量少,与药物的结合力弱。若再患有严重感染、营养不良或低蛋白血症,则药物与血浆蛋白结合得更少。药物与血浆蛋白呈疏松、可逆性的结合,凡与血浆蛋白结合的药物相对分子质量变大,不能再透过毛细血管壁进入组织液抵达靶细胞发生效应,只有游离型药物才能保持其药理活性。药物间可以竞争与血浆蛋白的结合部位,结合力强者可置换出弱者使其游离,同时后者血浆浓度增高,生理效应增强。
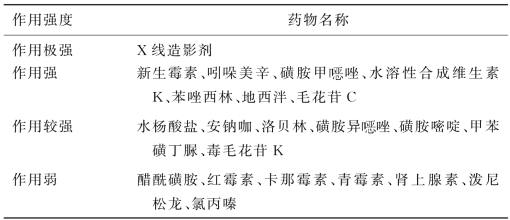
新生儿最常见的是药源性高胆红素血症。新生儿出生后由于大量红细胞破坏,血中胆红素浓度很高,而葡萄糖醛酸结合能力很低,大部分胆红素与血浆蛋白结合,此时若使用血浆蛋白结合率高的药物(如磺胺、水杨酸盐、苯妥英钠、吲哚美辛、毛花苷C、水溶性维生素K、安钠咖等),可将大量结合型的胆红素游离出来,但由于新生儿血脑屏障功能差,游离的胆红素可通过该屏障进入脑脊液,与脑核蛋白结合而酿成核黄疸。与胆红素竞争血浆蛋白结合的药物见表1-2。
表1-2 与胆红素竞争血浆蛋白结合的药物
3.代谢 药物在体内代谢的主要场所是肝脏。肝代谢药物的酶系统有肝微粒体酶和葡萄糖醛酸转移酶等,参与药物氧化、还原、水解、结合等过程,最后使代谢产物排出体外。新生儿、婴幼儿肝脏酶系统发育尚不成熟,各种酶活性低,使代谢减慢,t 1/2延长,易致药物在体内蓄积中毒,且个体差异较大。例如,用一般剂量氯霉素,因与葡萄糖醛酸结合较少而在新生儿体内代谢较慢,故可引起“灰婴综合征”,磺胺类药物可使葡萄糖醛酸转移酶缺乏的新生儿出现溶血。新生儿在出生后1~4周,应慎用或减量使用在肝脏代谢的药物,如地西泮、苯妥英钠、地高辛等。幼儿、学龄儿童对某些药物在肝脏的代谢能力有所提高,如茶碱、地西泮、苯妥英钠等,血浆t 1/2较成人短。要注意肝代谢酶诱导药或抑制药对新生儿药物代谢的影响。
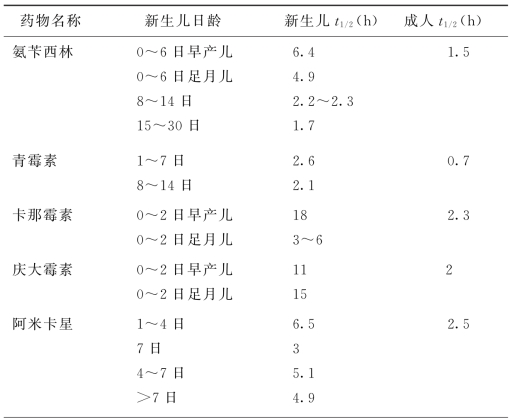
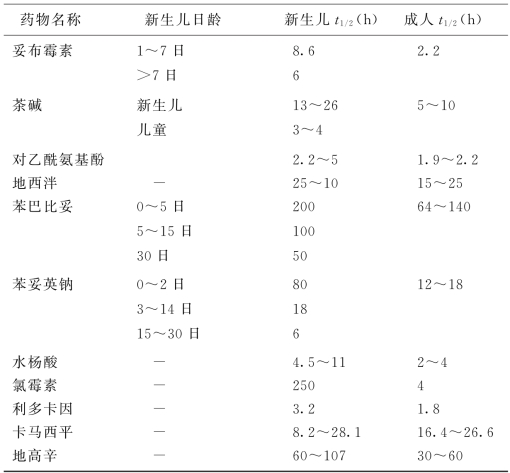
4.排泄 肾是药物排泄的主要器官。儿童年龄越小,肾功能越不完善。婴幼儿、新生儿肾功能发育不全。肾小球滤过率、肾小管排泄能力、肾有效血流量均远较成人或年长儿低。肾小管重吸收、尿浓缩、钠离子交换、酸碱平衡功能也差,特别是新生儿,可使药物排泄减慢,t 1/2延长。如氯霉素在新生儿半衰期为250h,而成人仅为4h。因此,在新生儿与儿童时期,使用的药物剂量不能相同。新生儿用药情况十分复杂,尤其是早产儿,既不同于足月儿,更不同于年长儿,必须结合各自的生理特点用药,一般要求剂量要小,给药次数要少,疗程不宜过久,间隔时间要适当延长。对于1周内的新生儿,主张每12小时给药一次,1周以上的新生儿每8小时给药一次。若为毒性强的药物(如卡那霉素),则每日只能给药1次。决不能用同样的剂量和方法用于不同胎龄的早产儿及不同日龄的新生儿。新生儿随着年龄的增大,生理功能逐日成熟,此时即应恢复到一般用量和方法,否则药物浓度降低也会影响疗效。某些药物在新生儿及成人体内的半衰期见表1-3。
表1-3 药物在新生儿及成人体内的半衰期
(续 表)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














