第三节 u-PA/u-PAR蛋白酶水解系统在肿瘤侵袭转移中的作用
肿瘤细胞侵袭转移过程的4个步骤中,第一步、第三步都涉及细胞外基质的降解,细胞外基质降解需要多种蛋白水解酶,是肿瘤细胞侵袭转移的前提和转移到远处组织停留、增殖生长的前提。在这一复杂的多步骤过程中最为关键的是肿瘤细胞黏附性质和能力的改变,降解细胞外基质的蛋白酶的产生和作用,以及各种细胞因子的分泌。其中细胞外基质的降解在侵袭转移中占有特别重要的地位。蛋白酶水解系统包括尿激酶及其受体(u-PA/u-PAR)系统和基质金属蛋白酶(MMPs)系统。
(一)细胞外基质的结构和组成
细胞外基质(基膜和间质组织)由胶原、糖蛋白、蛋白多糖等构成的致密网络,胶原是细胞外基质的主要成分,有12种之多,其中Ⅳ型胶原主要分布于基膜;糖蛋白包括laminin、fi-bronectin、entactin、nidogen等。细胞外基质的各种成分组成一种高度组织化的结构,承担支持作用,调节细胞与细胞间液之间的物质交换,调节细胞黏附,有丝分裂、分化,细胞移动等。细胞外基质比较严密,对蛋白质等大分子物质及细胞难于通过,使细胞被限制在原位。肿瘤细胞要离开原位发生侵袭转移,首先就得突破细胞外基质,降解细胞外基质是侵袭转移的先决条件,肿瘤细胞产生降解基质的蛋白酶是肿瘤细胞侵袭转移的基础。
(二)参与细胞外基质和基膜降解的蛋白水解酶
肿瘤细胞转移的必要步骤是细胞外基质的降解和侵袭周围组织。降解细胞外基质的蛋白酶很多,主要有3大蛋白酶家族:
1.丝氨酸蛋白酶(serine proteases) 尿激酶型纤溶酶原激活剂及其受体(urokinase-type plasminogen activator,u-PA、u-PAR),组织型纤溶酶原激活剂(tissue-type plasminogen acti-vator,t-PA),弹性蛋白酶(elastase),纤溶酶(plasmin),组织蛋白酶G(cathepsin G)。丝氨酸蛋白酶抑制物主要有纤溶酶原激活剂抑制物1和2(plasminogen activator inhibitor-1,PAI-1,plasminogen activator inhibitor-2,PAI-2)。
2.基质金属蛋白酶(matrix metalloproteinases,MMPs)和它的抑制剂(TIMP) 明胶酶(gelatinase),间质胶原酶(interstitial collagenases)。
3.半胱氨酸蛋白酶(cysteine proteases) 组织蛋白酶B和L(cathepsins B and L)。
(三)u-PA/u-PAR在肿瘤侵袭转移中的作用
u-PA最先是作为蛋白水解酶,它的主要功能就是催化酶原形式的纤溶酶原(plasminogen)转化成具有催化活性的纤溶酶(plasmin),纤溶酶是广谱蛋白水解酶,可以水解多种细胞外基质蛋白质的水解,u-PAR为u-PA的膜受体,结合的u-PA可以被浓集于细胞膜并分布于细胞移动的前沿,而且活性可大大提高,形成强大的蛋白质水解活性。u-PA/u-PAR系统的作用如图11-2所示。
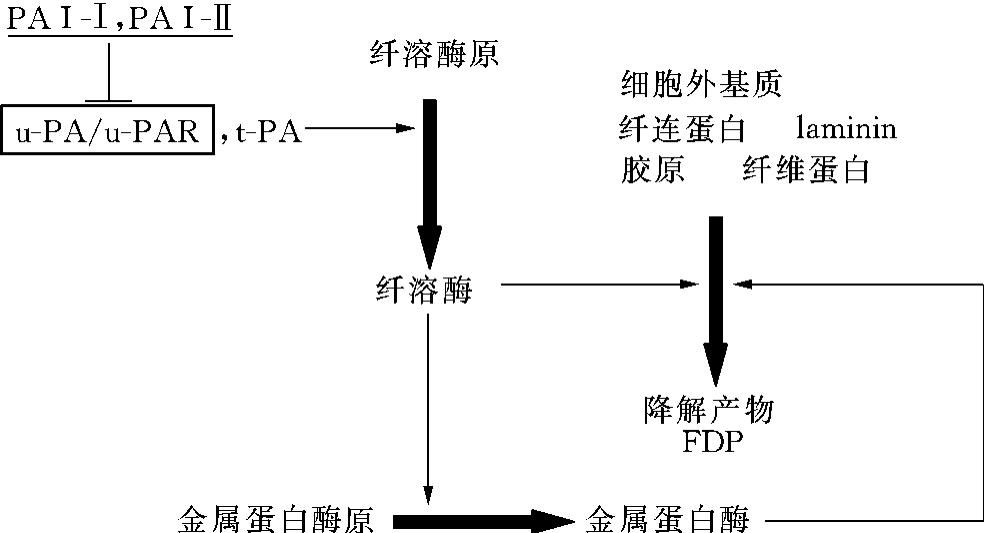
图11-2 u-PA/u-PAR系统的作用
在图11-2所示的级联(cascade)式反应中,起始和关键步骤是:纤溶酶原→纤溶酶的激活,纤溶酶原是没有活性的前体,纤溶酶是激活形式,是一种广谱蛋白酶,它可水解细胞外基质,也能激活没有活性的金属蛋白酶原成活性形式的金属蛋白酶,从而降解细胞外基质。激活纤溶酶原的关键组分是u-PA和t-PA,在基质降解中,u-PA起主要作用,u-PA的激活作用受其抑制剂PAI-Ⅰ和PAI-Ⅱ的调节。
近年来的研究表明,u-PA/u-PAR在体内生理和病理条件下发挥多种功能,正如前面所述,它们最早被认识的功能是它们的蛋白水解酶功能,在体内u-PA/u-PAR的生理性和病理性作用有一些是绝对依赖于它们的蛋白酶水解功能,例如降解细胞外基质、细胞的侵袭与移动、基质重建、生长因子的释放与激活等,而另外一些作用却与u-PA的蛋白水解活性无关,例如在化学趋化作用、细胞黏附和增殖中的作用。没有水解活性,或没有活性中心的N-端片段(ATF)也能在这些方面发挥作用,这些功能作用也与u-PAR有关,并可能涉及信号转导。
为了更好地理解u-PA/u-PAR的功能和作用,需要对它们的结构有一些了解。
1.u-PA/u-PAR的结构与功能
(1)u-PA 新分泌的u-PA是单链无活性的形式,单链u-PA(pro-u-PA)分子量约55×103(55kD),高度糖基化的糖蛋白,在158位Lys处的肽键切开,形成有活性的双链形式,A链20×103(20kD),B链34×103(34kD),A、B两链由二硫键相连。A链含表皮生长因子区(epitherial Growth factor,EGF)和Kringer区(K),是与特异性受体结合的区域,而且在A链区内的第138位的丝氨酸的磷酸化能够增强细胞黏附和化学趋化作用,B链为丝氨酸蛋白酶结构域(SPD),含活性中心(图11-3)。

图11-3 u-PA结构模型

图11-4 u-PAR及它与u-PA结合的结构模型
(2)u-PAR(u-PA受体) u-PAR是一个高度糖基化的糖蛋白,属于细胞膜的外在蛋白,仅借助于糖苷磷脂酰肌醇(GPI)锚定于细胞膜上,整个分子伸向细胞外面。u-PAR由2部分组成,蛋白质部分和GPI(锚),前者位于细胞膜外侧,后者插入细胞膜内,起固定作用。新合成的蛋白质部分由313氨基酸残基组成,包括信号肽(22个氨基酸残基)和羧基端8个氨基酸残基,连接到GPI上去的成熟肽有283个氨基酸残基。有3个功能结构域(图11-4),每个功能结构域大约90个氨基酸残基,u-PAR3个功能结构域高度同源。位于氨基末端的第一个结构域与u-PA结合。u-PA与u-PAR彼此亲和力很强(Kd为0.1~1.0nmol/L),借助于u-PAR,肿瘤细胞将其分泌的或细胞外的pro-u-PA或u-PA浓集于细胞表面、侵袭前缘形成强大的蛋白水解酶活性,从而大大提高了u-PA的活性;u-PA与u-PAR特异性结合后,多条通路被激活,从而发挥其在肿瘤演进中的多种功能。这些功能主要包括两方面:一是细胞内的多种信号通路被活化,包括癌基因表达的上调、刺激细胞黏附、调节化学趋化及MAPK通路的激活;二是细胞外的蛋白水解作用。受痕量纤溶酶的激活,pro-u-PA被激活为u-PA,与u-PAR结合的u-PA大大增强了激活纤溶酶原为纤溶酶的活性。
(3)u-PA抑制剂 主要有两种抑制剂:纤溶酶原激活剂抑制物1-型(PAI-1)和2-型(PAI-2),PAI-1和PAI-2是u-PA的特异性抑制剂,调节u-PA活性的主要物质,它们属于丝氨酸蛋白酶抑制剂家族成员(serine proteinase inhibitor,serpin)。
1)PAI-1:主要由内皮细胞、肝细胞和血小板分泌,存在于血浆、血小板和内皮细胞的基质中,肿瘤细胞也分泌PAI-1。成熟PAI-1由379个氨基酸组成,具有3根糖链,分子中有一个反应中心环(RCL),其中有活性中心肽键(RCPB)R346-M347。与t-PA或u-PA形成1∶1分子比的复合物,快速抑制它们的活性。
2)PAI-2:首先在胎盘中发现,为丝氨酸蛋白酶抑制物超家族成员,比PAI-1更为特异的u-PA抑制物。滋养层细胞、单核细胞、内皮细胞、成纤维细胞等可合成PAI-2。PAI-2由415个氨基酸残基组成,有糖基化和非糖基化两种类型,前者为分泌型,后者为细胞内型。两型PAI-2有不同的功能,前者主要执行抑制u-PA的功能,后者抑制细胞凋亡。
3)抑制机制:PAI-1与u-PA形成复合物,在活性中心的肽键(R346-M347)被切开,PAI-1分子中被切开的肽键的羧基与u-PA的活性中心丝氨酸羟基形成酯键,使u-PA失活。PAI-2有类似的作用机制。
2.u-PA/u-PAR作为蛋白水解酶在侵袭转移中的作用 u-PA、u-PAR、PAI-1、PAI-2的主要作用是参与和调节细胞外基质的降解。
(1)u-PA/u-PAR系统 已有大量文献报道,u-PA/u-PAR系统在许多生理和病理过程中起着重要作用,包括胚胎形成、血管生成、伤口愈合、组织重建、肿瘤细胞的侵袭转移等都与蛋白酶活性有关。t-PA和u-PA都是激活纤溶酶原的激活剂,将纤溶酶原激活成纤溶酶。t-PA主要参与血管内的纤维蛋白溶解,u-PA主要在生理或病理条件下参与细胞分化、细胞迁移、组织重建、细胞周围基质降解等。
纤溶酶是广谱蛋白水解酶,它直接水解血循环和细胞外基质中的许多蛋白质和激活一些酶原,主要是金属蛋白酶原家族,或者生长因子。u-PA活性受多种抑制剂的调节,主要是PAI-1和PAI-2。
u-PAR是位于细胞膜上的u-PA受体,它可以与其他细胞分泌的游离的u-PA(或pro-u-PA)和细胞本身分泌的u-PA结合,与u-PAR结合的u-PA,其激活纤溶酶原的活性比未结合的u-PA强20倍,并且能将u-PA活性定位于特定的部位。许多肿瘤细胞合成和分泌较多的u-PA/u-PAR。免疫组化实验显示u-PA/u-PAR定位于肿瘤细胞侵袭前沿,表明在侵袭转移过程中肿瘤细胞与基质接触界面存在高活性的u-PA/u-PAR系统。
由于u-PAR主要定位在肿瘤细胞侵袭前沿,又能与基质中和细胞本身分泌的u-PA或单链pro-u-PA结合,所以能把u-PA浓集在肿瘤细胞侵袭前沿,激活纤溶酶原成纤溶酶。pro-u-PA/u-PA与纤溶酶原/纤溶酶之间具有正反馈相互激活作用,而且是u-PAR依赖的,这样在局部产生强大的蛋白水解酶活性,降解细胞外基质中的各类蛋白,并破坏细胞结构,为肿瘤细胞的侵袭转移扫清障碍。
已经发现许多肿瘤如脑瘤、乳腺癌、肺癌、大肠癌、前列腺癌、膀胱癌、胰腺癌等都有u-PA和u-PAR的高表达。u-PA和u-PAR协同作用促进对细胞外基质的降解,从而增加肿瘤细胞的侵袭转移能力,两者的协同表达十分重要,其中任何一种成分受限或受到抑制都可能使肿瘤细胞的侵袭转移能力大大降低。
(2)PAI-1、PAI-2在侵袭转移中的作用 PAI-1是u-PA的特异性抑制剂,调节u-PA/u-PAR,直接抑制u-PA;PAI-1与u-PA和u-PAR形成三联复合物,促进内吞,加速u-PAR更新;在各种肿瘤中呈异常表达。
Tanaka等报道对胃癌、结肠癌ELISA和免疫组化研究的结果,发现癌组织中有PAI-1的表达,且在癌中心部分最高,边缘次之,随癌的发展而升高,正常组织中未见有PAI-1的表达,提示随恶性程度的增加而升高。
Sumiyoki研究了36例纤维瘤和39例乳腺癌病人术后标本,乳腺癌中PAI-1明显高于纤维瘤(P<0.001),有淋巴结转移的较无淋巴结转移的高(P<0.01),PAI-1浓度增高与淋巴结转移侵袭相关(P<0.05),而且u-PA与PAI-1呈直线相关。PAI-1在肿瘤组织中似乎不发挥抑制u-PA的作用。PAI-2是更强的u-PA抑制剂,直接抑制u-PA;在多种肿瘤中呈异常表达。
Nagayama等发现在肺癌组织中u-PA、PAI-1均高于正常组织,PAI-2的表达水平与淋巴结转移呈负相关。Bouchet等报道,大量表达u-PA和PAI-1的患者预后差,PAI-2表达低的患者生存期短。PAI-2可能在肿瘤组织中有u-PA抑制剂的作用,抑制肿瘤细胞的侵袭转移。
3.u-PA/u-PAR作为信号分子在肿瘤侵袭转移中的作用 细胞为了移动,就要修饰它的形状,这要通过重建细胞内的骨架,连续发生细胞与细胞和细胞与周围基质之间的接触和松动,在这个过程中有许多蛋白质因子参与,包括化学趋化因子及其受体、细胞黏附分子、细胞骨架调节因子和信号酶等。u-PAR基因在1985年被克隆的时候,仅仅认为它是一种可以在细胞前沿参与将纤溶酶原转变成纤溶酶过程的分子,现在的研究结果证明它还通过它的功能单位与其他分子的作用,组织几组细胞内涉及细胞质、跨膜激酶和细胞骨架成分等的信号通路的起始,从而影响细胞的移动、黏附、分化和增殖。u-PA/u-PAR的信号功能不需要它的蛋白水解酶活性,因为用化学抑制剂阻断u-PA的活性,或用没有催化活性的u-PA(例如pro-u-PA,u-PA的氨基端片段ATF)同样具有信号活性,重要的是u-PA与u-PAR的结合。u-PAR是一种胞外蛋白,它没有跨膜结构域,更没有胞内结构域,仅仅是通过GPI锚定在细胞膜上,它如何将信号转入细胞内,影响细胞的黏附与移动?Yebra等选用不表达u-PA/u-PAR的人前列腺癌细胞株LNCap作模型细胞,用u-PAR cDNA转染LNCaP细胞,获得高表达u-PAR的LNCaP-u-PAR,而不表达u-PA的细胞。在LNCaP-u-PAR细胞培养液中加入pro-u-PA或u-PA的N端片段,在37℃保温30min,然后在Fibronectin进行细胞移动试验,20~24h后,发现pro-u-PA和ATF作用后的LNCaP-u-PAR细胞的移动率增加3~4倍,而LNCaP原代细胞和用空载体转染的LNCaP-pcDNA3细胞的移动率没有增加。以上结果表明u-PA促进细胞移动仅仅依赖其与u-PAR的结合和占据细胞膜的作用,与u-PA的活性无关。将LNCaP-u-PAR细胞黏附在fibronectin上培养4h,然后加入pro-u-PA,再培养30min,细胞裂解液进行SDS-PAGE,用磷酸化抗体检测蛋白质酪氨酸磷酸化的程度,以多聚赖氨酸代替fibronectin作对照,结果发现黏附在fibronectin上的LNCaP-u-PAR细胞其蛋白质酪氨酸磷酸化程度增加,细胞能黏附、扩展和移动,而黏附在多聚赖氨酸上的细胞其蛋白质酪氨酸磷酸化程度没有变化,能黏附,但不能扩展、移动,表明这种酪氨酸磷酸化是依赖fibronectin(基质)的。u-PA/u-PAR的这种作用通过什么信号分子介导的?目前已经确认最少有3类跨膜蛋白是u-PA/u-PAR的介导物,介导u-PA/u-PAR的信号转导,它们是整合素、GPCR和caveolin。整合素是细胞表面受体,以它的黏附功能,能将细胞固定到ECM和转导细胞外环境和细胞内之间的信号。用免疫沉淀法和来自噬菌体库的u-PAR结合肽的试验证明,u-PAR能与整合素相互作用,u-PAR与多种整合素都有相互作用,但亲和力最强的是α3β1和α5β1。u-PA/u-PAR诱导的细胞移动不仅能被抗u-PAR抗体阻断,也能被抗整合素抗体阻断,证明整合素参与由u-PA/u-PAR诱导的细胞移动,配体激活的u-PAR也影响整合素依赖的细胞黏附、移动和增殖。
4.u-PA/u-PAR系统与整合素在功能上的相互依赖 在2、3条目中我们分别叙述了u-PA/u-PAR系统作为丝氨酸蛋白酶和作为信号转导分子在细胞外基质降解和细胞侵袭、移动的两种功能,在细胞增殖、黏附、移动、化学趋化以及在肿瘤侵袭转移中发挥着极其重要的作用。如前所述u-PAR缺乏跨膜结构域,单u-PAR本身不可能将细胞外的信号传入细胞内,需要与其他信号分子与受体结合和在功能上相互协同。这些信号分子主要是整合素,整合素与u-PA/u-PAR一起组成一个相互依赖的网络,彼此影响对方的功能,而且,u-PA/u-PAR/PAI-1的表达受特异的ECM与整合素相互作用的调控,同样整合素的表达也受u-PA/u-PAR系统的调节,细胞通过这种多方位的信号“串话”(multifaceted crosstalk)调节细胞的蛋白水解、黏附和移动的活性来控制细胞外基质与它的环境的完整性。
u-PA/u-PAR除了前述的具有蛋白水解酶活性和触发信号转导的功能外,还具有有丝分裂活性和化学趋化活性。u-PA/u-PAR系统的有丝分裂活性在许多正常细胞和肿瘤细胞都存在,但这种作用具有细胞类型特异性,例如,在人表皮肿瘤细胞,黑色素瘤细胞和非恶性的血管平滑肌细胞中u-PA/u-PAR的有丝分裂活性既依赖u-PA的蛋白水解活性,又依赖其与u-PAR的结合。在另一些肿瘤细胞中,例如骨肉瘤细胞、乳腺癌细胞等u-PA/u-PAR的有丝分裂活性依赖其无水解酶活性形式包括u-PA的ATF片段。在人中性粒细胞、内皮细胞和角质细胞等细胞中都发现u-PA/u-PAR有趋化活性,表明有特异的蛋白激酶的激活和细胞形状及形态的改变。
(1)u-PA/u-PAR系统与整合素之间的串话 u-PA/u-PAR与整合素的结合,细胞表面锚定的u-PAR与β1-整合素家族成员横向结合导致u-PAR转染的人胚肾293细胞与vitrone-ctin的黏附显著增强,并伴有β1-依赖的对fibronectin黏附的抑制,因此,在整合素与u-PAR结合时,在改变了的细胞外基质微环境,例如在肿瘤侵袭转移中发生的微环境改变时,可以通过精细调节黏附表型改变对细胞外基质蛋白结合的偏向性。u-PAR与整合素直接的和物理的相互作用广泛影响整合素在许多生物学环境中的功能,这些研究结果强烈激励人们去寻找和鉴定那些能够干扰u-PAR与整合素结合的调节分子。通过肽库筛选,筛选到一个肽25(p25)能够特异的扰乱u-PAR与整合素相互作用和由u-PAR引起的整合素功能的改变。表达p25的侵袭性人乳腺癌细胞其癌细胞的进展显著减少。
几组试验证据表明GPI锚定的u-PAR可分别与整合素亚家族成员β1、β2、β3、β5形成物理连接,已经证明这种结合不仅改变了整合素的黏附功能,也触发了信号转导途径,由此影响细胞的黏附、移动、细胞骨架重构、蛋白水解作用、细胞侵袭和增殖。此外,通过u-PAR与PAI-1能结合ECM成分vitronectin的能力,u-PA/u-PAR系统与整合素之间可能发生功能串话,就因为这一点,u-PAR与PAI-1相互竞争与vitronectin的作用和与整合素竞争及vitronectin的相互作用,由此干扰细胞的黏附。在细胞黏附过程中,u-PA作为一种重要调节因子,一方面u-PA的存在,使PAI-1从VN上解离下来;另一方面,u-PA增强u-PAR/VN的结合亲和力。
也有证据表明u-PAR能与vitronectin受体αvβ3和αvβ5发生物理性和功能性的相互作用,乳腺癌和人纤维肉瘤细胞受u-PA和ATF(与u-PAR结合的结构域)刺激后,导致依赖αvβ5和涉及蛋白激酶C作用的细胞骨架重排,或许通过改变αvβ5信号特异性参与u-PA/u-PAR介导的细胞移动。
除了上述的在同一细胞中u-PAR与整合素的相互作用(称为u-PAR与整合素的顺式相互作用,Cis interaction)以外,还有就是可溶性形式的u-PAR能分别特异性地与α4β1、α6β1、α9β1和αvβ3结合,这种结合能被整合素抗体或u-PAR抗体所阻断。与此相似的是,细胞表面结合的GPI-相连的u-PAR能与相邻细胞上的整合素结合,调节细胞与细胞的相互作用(称为反式相互作用)。
(2)u-PA/u-PAR系统与整合素之间的串话相互影响各自的表达水平
1)整合素调节u-PA的表达:越来越多的证据表明u-PA/u-PAR的表达受特异的ECM/整合素相互作用的调节,例如,人卵巢癌细胞,当癌细胞培养在ECM成分fibronec-tin和Ⅳ型胶元作为黏附支持基质的条件下,u-PA和u-PAR的合成显著增强,其他肿瘤细胞如乳腺癌和纤维瘤细胞,情况也相类似,在癌细胞以β1依赖黏附在fibronectin上时,呈现u-PA表达的增加。在人角质细胞中的情形也类似,在α3β1存在时,u-PA的分泌增加。发生这种作用时伴有细胞外信号调节激酶的磷酸化,并且发生u-PAR重新分布到α3β1云集部位。
vitronectin的作用同fibronectin相反,在蛋白质水平和mRNA水平上显著下调u-PA的表达。在卵巢癌细胞中发现的vitronectin依赖的u-PA表达水平的下降,平行伴有u-PA基因启动子活性的减少,当结合vitronectin的整合素αvβ3的表达水平增加时,u-PA表达水平的下降更加明显。
2)整合素调节u-PAR的表达:在人卵巢癌细胞中,整合素αvβ3与vitronectin(VN)的相互作用下调u-PAR的表达,据报道VN与整合素的结合不仅干扰u-PA/u-PAR的表达,而且决定和指导u-PA/u-PAR定位在细胞与ECM接触的区域,并促进u-PA介导的细胞周围的蛋白水解作用和细胞移动。在卵巢癌细胞中u-PAR水平的下降与整合素亚基β3表达水平有关,在β3的细胞质结构域中要求有细胞膜基元(motif)NITY,已知NITY是细胞黏附和focal contact formation所必需。先前的研究证明截短型的β3-endonexin能与NITY结合,这种β3整合素的应接器(adapter)的过表达阻遏u-PAR启动子活性,这种作用要通过PEA3/est家族转录因子对u-PAR启动子的结合。同样在内皮细胞中,β3-endonexin的过表达,减少u-PAR启动子的活性,这要依赖于u-PAR启动子中的完整NF-kB结合位点。
ECM与整合素相互作用对u-PAR表达的调控似乎具有细胞特异性,例如,转移性黑色素瘤细胞中的情形正好与卵巢癌细胞中的情形相反,整合素αvβ3表达的增加与u-PAR mRNA的显著升高相关联,并且使细胞表面结合的u-PA水平更高,当用αv反义寡核苷酸抑制这些细胞合成αv时,αv mRNA的合成显著减少,同时伴有u-PAR mRNA水平的显著减少。
3)PAI-1的表达受整合素的改变:已经证实许多调节因素调节PAI-1基因的转录活性,但是,PAI-1基因表达对细胞黏附到ECM组分的机制还没有阐明。在人卵巢癌细胞黏附到VN时,PAI-1蛋白的表达被显著诱导,与VN对u-PA/u-PAR的表达的作用正好相反,PAI-1启动子活性的提高反映了PAI-1表达的增加,在整合素αvβ3过表达时,进一步提高。这些平行的数据显示在其他贴壁生长的癌细胞中,PAI-1基因的转录,在细胞附着生长的起始阶段被上调,当细胞完全黏附后,则被下调,而且在体外伤口愈合试验模型中,当激活的、培养的角质细胞黏附在FN、VN和Ⅳ型胶原、RGD肽时,能检测到PAI-1的mRNA,而黏附在Ⅰ、Ⅲ型胶原和Liminin时则相反,PAI-1mRNA的表达被完全抑制。
4)u-PA/u-PAR系统对整合素表达的影响:u-PA/u-PAR介导的信号转导确实能影响整合素的表达,在某些细胞类型中,u-PAR和αvβ3的表达相关联。用含反义u-PAR的腺病毒载体转染胶质瘤细胞,这些转染细胞当有VN存在时,αvβ3表达减少,因此导致整合素介导的信号通路改变。
5.u-PA/u-PAR、PAI-1、PAI-2的临床意义 以上所述表明,各类肿瘤细胞u-PA/u-PAR、PAI-1、PAI-2的表达有显著改变,在肿瘤细胞的侵袭转移中起着关键的作用。许多研究者发现u-PA、u-PAR和PAI-1在人恶性肿瘤组织中的表达水平远远高于相应的正常组织。用原位杂交及免疫组化等方法研究,发现临床肿瘤患者的多种肿瘤组织细胞高表达u-PA、u-PAR和PAI-1,且u-PA、u-PAR及PAI-1表达越高的肿瘤患者其预后越差、生存期越短,而PAI-2在大多数高侵袭和转移肿瘤组织中表达水平低,当PAI-2表达高时肿瘤病人的预后良好。在胃癌、胰腺癌、宫颈癌、结肠癌、卵巢癌等多种恶性肿瘤中也得到相类似的结果。在研究肿瘤的体外侵袭能力时,人们发现在恶性肿瘤的细胞系中u-PA/u-PAR系统的表达水平也与肿瘤细胞的侵袭能力正相关。
6.u-PA/u-PAR可作为抗侵袭转移的靶标 以上叙述表明u-PA/u-PAR系统在肿瘤侵袭转移中起重要作用,而且这种作用是发生在u-PA与u-PAR结合以后,因此,普遍认为该系统是抗肿瘤侵袭转移的重要靶标蛋白系统。通过干扰u-PA/u-PAR的相互作用及抑制u-PA活性来抑制肿瘤细胞侵袭转移,这已经成为抗肿瘤侵袭转移治疗研究的一种新思路。目前针对u-PA/u-PAR系统进行抗肿瘤治疗的研究主要包括以下几个方面:①利用反义核酸来抑制u-PA、u-PAR、PAI-1的表达。例如,用u-PAR反义RNA表达质粒转染高侵袭性人乳腺癌细胞株MDA-MB231,该细胞株能表达u-PAR的反义RNA,其u-PAR表达水平和培养上清液中的纤溶活性显著降低,反义转染细胞体外侵袭力比原代细胞显著降低,裸小鼠体内侵袭试验表明,反义细胞的成瘤性和侵袭性都比原代细胞显著降低。②利用u-PA抑制剂抑制u-PA的丝氨酸蛋白酶活性,这些抑制剂主要为天然抑制剂PAI-2及一些合成的小分子抑制剂。③利用u-PAR的抗体或无u-PA酶活性的u-PA片段类似物竞争细胞表面u-PAR。Ossowski等研究发现u-PA抗体虽不能抑制肿瘤局部侵袭,但能抑制肿瘤在荷瘤小鼠的远端转移;Rab-bani等用u-PAR抗体可显著降低原发瘤的体积和肿瘤的肝、脾、肺及淋巴结转移;转染u-PA的ATF cDNA的肺癌巨细胞株PG细胞接种裸鼠后,与对照组裸鼠相比,肿瘤的侵袭转移能力明显下降,说明仅利用u-PA N端与u-PAR结合的结构域可以同肿瘤细胞膜上的u-PAR结合干扰肿瘤细胞分泌和周围的u-PA与u-PAR的结合;Guo等发现u-PA的135—143位的连接肽是u-PA和u-PAR相互作用的第二个部位,他们合成的小分子肽6(KPSSPPEE,u-PA的136—143位的肽段)通过干扰u-PA和u-PAR的结合而抑制肿瘤的侵袭转移,并发现6通过抑制肿瘤血管生成而促进肿瘤细胞凋亡。
Kobayashi等把u-PA的ATF与纤溶酶的抑制剂bikunin进行重组后的融合蛋白不仅干扰u-PA和u-PAR的相互作用,同时又能抑制肿瘤细胞表面的纤溶酶活性,这种融合蛋白通过其双重功能抑制体外肿瘤细胞的侵袭和荷瘤裸鼠体内的肿瘤转移。u-PA能够催化无活性的纤溶酶原转变成有活性的纤溶酶,是纤溶酶的关键调节酶,是细胞外基质降解的限速酶,因此,通过抑制肿瘤细胞表面的u-PA活性比抑制肿瘤细胞表面的纤溶酶活性更为有效。Bal-ance等把u-PA的GFD(生长因子结构域)与PAI-2进行融合后,发现该融合蛋白能够抑制u-PA的丝氨酸蛋白酶活性,又能竞争结合肿瘤细胞表面的u-PAR,但是该融合蛋白与肿瘤细胞表面u-PAR的结合能力明显弱于u-PA,说明u-PA的Kringle结构域对于u-PA及u-PAR的相互作用起着相当重要的结构支持。王霞等利用蛋白质工程研制把u-PA的氨基端片段(包括生长因子和Kringle结构域)与缺失螺旋C、D间33个氨基酸残基肽段的PAI-2CD(保留抑制u-PA的活性,失去抑制细胞凋亡作用)构建成融合蛋白,既能干扰u-PA和u-PAR的相互作用,又能同时抑制u-PA的丝氨酸蛋白酶活性的双功能蛋白质,放射竞争实验及流式细胞仪检测分析表明,该融合蛋白既能抑制u-PA的丝氨酸蛋白酶活性,又能与u-PA竞争结合肿瘤细胞表面的u-PAR。体内外肿瘤侵袭转移模型研究结果表明,该融合蛋白能够抑制肿瘤细胞的体外侵袭和肿瘤在裸鼠体内的转移。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















