实验二十 水生生物遗传多样性的微卫星标记分析
一、实验目的
(1)了解微卫星分子标记技术的原理。
(2)掌握微卫星分子标记技术的操作方法。
(3)了解微卫星分子标记技术在水生生物遗传多样性分析中的应用。
二、实验原理
微卫星(Microsatellites)又称简单序列重复(Simple Sequence Repeats,SSR)、短串联重复(Short Tandem Repeats)或简单序列长度多态性(Simple Sequence Length Polymorphism),是指由1~6个核苷酸为核心序列组成的一个简单串联DNA重复单位头尾相连的重复序列。在迄今研究过的所有生物种类中都发现了它的存在,并且分布密度很大,表现出高度的多态性。一般认为,微卫星重复序列产生的原因主要有三点:①DNA复制过程中的滑动;②DNA复制和修复时滑动链与互补链碱基错配;③在减数分裂中的不等交换,导致一个或几个重复单位的插入或缺失,使这些重复序列的拷贝数发生变化,从而形成群体内个体间的多样性即多态性。由于微卫星具有多态性丰富、遵循孟德尔分离定律、共显性遗传等特点,已成为种群分化、家系分析、基因连锁分析、进化研究中使用最为广泛的遗传标记,是继第一代作图用分子标记RFLP后的第二代作图用分子标记。
尽管微卫星分布于整个基因组的不同位置,但它两端的序列多是相对保守的非重复序列或称为侧翼序列,中间为重复的核心序列,因此分析微卫星DNA多态性时,可以根据分离得到的微卫星两端的单拷贝序列设计一对特异引物,利用PCR技术,扩增每个位点的微卫星DNA序列,得到个体之间因为重复次数不同而造成的大小不等的DNA片段,经聚丙烯酞胺凝胶电泳技术分析核心序列的长度多态性。一般来说,同一类微卫星可分布于整个基因组的不同位置上,通过其重复的次数不同以及重复程度的不完全造成每个座位上的多态性。
三、实验材料
太平洋牡蛎(Crassostrea gigas)基因组DNA样品。
四、实验用具和试剂
1.仪器用具
台式冷冻离心机,PCR仪,电泳仪,测序仪,恒温水浴锅,高压灭菌锅,微量移液枪,Tip头,离心管,PCR管,冰浴锅等。
2.药品试剂
太平洋牡蛎微卫星引物,Taq聚合酶,10×PCR buffer,MgCl2,dNTP,DNA Marker;尿素(urea),丙烯酰胺(Acr),甲叉双丙烯酰胺(Bis),过硫酸铵(APS),四甲苯乙二胺(TEMED),三羟甲基氨基甲烷(Tris),硼酸,EDTA,去离子甲酰胺,二甲苯青,溴酚蓝,无水乙醇,冰醋酸,剥离硅烷,亲和硅烷,硝酸银,甲醛,无水碳酸钠,硫代硫酸钠等。
五、实验步骤
1.PCR反应体系
在PCR管中加入下列溶液:
模板DNA(100ng·μL-1) 1μL
正向引物(10μM) 1μL
反向引物(10μM) 1μL
10×Buffer 1μL
dNTP(2.5mM) 0.8μL
MgCl2(25mM) 0.6μL
Taq(5U·μL-1) 0.05μL
ddH2O 4.55μL
2.反应程序
94℃预变性3min后,开始如下循环:
94℃变性 1min
退火 1min
72℃延伸 1min
经过45个循环后,最后一个循环72℃再延伸10min,循环结束后反应产物置于4℃下保存。
3.变性聚丙烯酰胺凝胶的制备
(1)电泳用的玻璃板一定要非常清洁,一般先用去污剂洗涤,再用去离子水冲洗玻璃板,最后用乙醇擦洗干净。
(2)每次灌胶前均需分别严格处理清洗过的方玻璃板和耳玻璃板。耳玻璃板擦拭1mL 2%的剥离硅烷(Repel Silane),方玻璃板用亲和硅烷(Binding Si-lane)(1.5mL无水乙醇,7.5μL冰乙酸,2μL 0.5%亲和硅烷)进行硅化。方、耳玻璃板轮流处理过程中,要先更换手套,防止两块硅烷交叉污染。硅烷化后至少干燥10min。
(3)进行玻璃板组装。用0.4mm厚的边条置于方玻璃板左、右两侧,将耳玻璃板压于其上,两侧用夹子固定住。使用夹子固定玻璃板时,最好夹子的力量稍大一些,防止因力量不足使灌胶的过程中出现漏液现象。
(4)将60mL 6%变性聚丙烯酰胺凝胶储存液(420g尿素,57g丙烯酰胺,3g甲叉双丙烯酰胺,100mL 10×TBE,溶于灭菌双蒸水,定容至1L,4℃下保存备用),加入0.024g过硫酸铵和24μL TEMED后,沿灌胶口轻轻灌入,待胶流动到玻璃板底部,在灌胶口轻轻插入鲨鱼齿梳。注意:灌胶过程中要严格防止出现气泡,否则影响电泳的结果。灌胶结束后,静止放置使之聚合至少2.5 h。若让胶过夜,在胶的两头铺上保鲜膜以防干胶。
4.电泳
(1)当凝胶聚合完全后,拔出鲨鱼齿梳,将玻璃板组装到电泳槽上,稀释10×TBE缓冲液至1×TBE,将该缓冲液加入上、下两个电泳槽中,60W恒功率预电泳30min。预电泳是为了去除凝胶的杂质离子,同时使凝胶板达到所需的温度。高温电泳可防止GC丰富区形成发夹状结构影响电泳结果。
(2)预电泳同时,进行样品的制备。PCR产物与甲酰胺变性剂1∶1混合,95℃变性5min,然后立即冰浴。
(3)预电泳结束后,关闭电源,用针管吸缓冲液清洗样品孔,去除在预电泳时扩散出来的尿素。将鲨鱼齿梳反过来,把有齿的一边插入凝胶中。每一个点样孔点入6μL经变性的样品。加样完毕后,立即采用60W恒功率电泳。
5.银染显色
(1)电泳完毕后,小心分开两块玻璃板,凝胶会紧贴在涂亲和硅烷的长玻璃板上。
(2)固定:将凝胶板置于10%冰醋酸溶液(固定/停止液)中,轻轻摇动15~30min至样品中染料完全消失。
(3)冲洗:用三蒸水振荡洗胶3次,每次3~5min。
(4)染色:2L三蒸水中加入2g AgNO3和3mL 37%甲醛配成染色液,将凝胶板置于染色液中充分摇动30min。
(5)冲洗:从染色液中取出胶板放入三蒸水中浸洗5~10s。注意:把凝胶从三蒸水转移到显影液的时间不能过长,否则导致信号微弱,甚至丧失信号。
(6)显影:将凝胶板迅速移到2L冷却的显影液中(2L水加入60g无水Na2CO3,冷却至4℃,使用前加入37%甲醛3.5mL,10mg·mL-1硫代硫酸钠400μL),充分振荡直至带纹出现。
(7)定影:固定/停止液中定影3~5min。
(8)冲洗:在三蒸水浸洗凝胶3~5min。
(9)干燥保存:等胶板干燥后将其扫描成图像文件保存。
六、实验结果分析
根据变性聚丙烯酰胺凝胶电泳上的10bp DNA Marker人工读取扩增片断大小,使用分析软件GENEPOP 3.4和MICROSATELLITE ANALYSER(MSA)对每个微卫星位点等位基因的数量进行统计,计算等位基因频率、观测杂合度(HO)、期望杂合度(HE)与检测群体是否符合哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)。
七、实验作业
(1)总结微卫星标记的优缺点。
(2)简述微卫星标记在海洋生物遗传学研究上的应用。
八、微卫星标记参考图
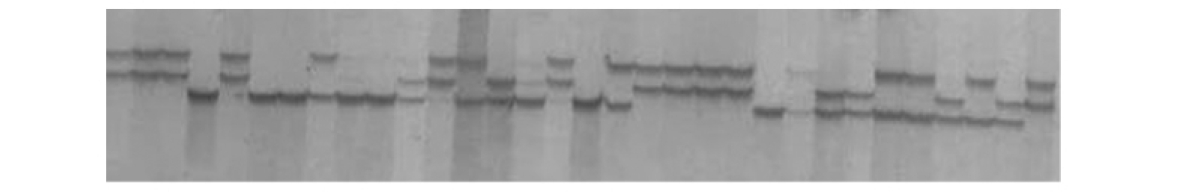
图20.1 太平洋牡蛎Cge449位点的电泳图

图20.2 太平洋牡蛎Udg194位点的电泳图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















