第三节 病毒的培养
病毒缺乏完整的酶系统,又无核糖体等细胞器,所以不能在任何无生命的培养液内生长,培养病毒必须选用适合病毒生长的敏感活细胞。人工培养病毒的方法有实验动物培养法、鸡胚培养法以及细胞培养法(包括器官、组织和单层细胞培养法等)。病毒的大量培养是病毒学实验研究以及制备疫苗和特异性诊断制剂的先决条件。培养病毒最早应用的方法是用实验动物和鸡胚来培养,但从20世纪50年代细胞培养技术广泛应用于病毒培养以来,前两种方法已降到次要地位,但至今仍有部分病毒的分离鉴定还离不开实验动物或鸡胚,特别是在免疫血清制备以及病毒致病性、免疫性、发病机理和药物效检等方面。在禽类病毒病和流感、副流感类等病毒病的研究方面,鸡胚(含其他禽胚)仍具有重要的应用价值。
一、实验动物培养法
(一)实验动物的选择
实验动物是长期以来分离和增殖病毒、制造病毒抗原和病毒疫苗以及病毒病实验研究的常用材料和工具。病毒学研究中实验动物主要用于:①分离病毒,并借助感染范围试验鉴定病毒;②培养病毒,制造抗原和疫苗;③测定各毒株之间的抗原关系,如应用实验动物做中和试验和交叉保护试验;④制备免疫血清和单克隆抗体;⑤进行病毒感染的实验研究,包括病毒毒力测定,建立病毒病动物模型等。进行动物实验时,首先考虑的是选择对目的病毒最敏感的实验动物品种和品系以及适宜的接种途径和剂量。
进行病毒学研究时,最好选择SPF动物。一般来讲选择实验动物应遵循以下条件:①对病毒易感性高。②动物健康,体重、年龄尽可能一致,符合培养病毒要求。③遗传特性相似,实验结果具有一致性、准确性和可比性。④外购动物要了解所在动物群健康、饲养及免疫接种情况,接种前要经过健康观察,以免误用带有病原体的动物。
国外实验动物科学发展迅速,我国已在部分大城市建立实验动物中心,专门供应各种经过人工遗传控制和微生物控制而育成的纯系高品位实验动物。为了满足生物学、医学和兽医学研究的需要,国外按遗传控制标准已育成各类实验动物2600余种,其中小鼠就有1700余个品系,而且已经规范化、标准化,从而保证了研究工作的科学性和严密性。兽医学上除常应用家兔、小鼠、大鼠、豚鼠和仓鼠等进行病毒分离、适应以及疫苗生产外,还常直接应用自然易感动物,如羊、猪、犬、鸡甚至马和牛等大动物做各自易感病毒的实验研究。
(二)实验动物的接种
1.接种途径和方法:接种实验动物的途径和方法主要包括皮内接种、皮下接种、肌肉接种、静脉接种及腹腔接种等。应根据病毒的生物学特点选择相应的接种途径和方法。
2.动物接种后的饲养管理与收获病毒:接种病毒后应每天观察动物,检查规定的各项指标,主要包括体温、精神、食欲、粪便、尿液、被毛状态、活动情况和接种部位的局部反应,做好记录。出现反应症状的动物,按规定方法剖杀,采取含病毒高的组织脏器。
二、鸡胚培养法
鸡胚是正在发育中的机体,多种动物病毒能在鸡胚中增殖和传代,并可用鸡胚制备某些病毒抗原和疫苗。鸡胚培养的优点在于胚胎的组织分化程度低,又可选择不同的日龄和接种途径,病毒易于增殖,感染病毒的组织和液体中含有大量病毒,容易采集和处理,而且来源充足,设备和操作简便易行。
应用鸡胚需要注意的首要问题是胚内可能污染细菌和病毒,尤其是经母鸡垂直传递的病毒,如沙门菌、禽白血病病毒、新城疫病毒、禽脑脊髓炎病毒和Rous肉瘤病毒等。另外,普通鸡胚中往往含有母源抗体,影响同种病毒的增殖。因此,应尽可能选用SPF胚。虽然喂饲添加抗生素饲料母鸡的蛋中含有抗生素,但对病毒学实验通常无影响。病毒在鸡胚中增殖,除部分病毒产生痘斑,引起充血、出血、坏死灶和死亡等变化外,许多病毒缺乏特异性的感染指征,必须应用血清学反应或检查病毒抗原以确定病毒的存在。
常选用鸡胚的绒毛尿囊膜、尿囊腔、卵黄囊和羊膜腔等部位增殖病毒(图3-4)。
1.绒毛尿囊膜接种:主要用于痘病毒和疱疹病毒的分离和增殖,这些病毒可在鸡胚绒毛尿囊膜上形成痘斑。
2.尿囊腔接种:主要用于正黏病毒和副黏病毒,如流感病毒和新城疫病毒的分离和增殖,也是制备马脑炎病毒疫苗的常用接种途径。
3.卵黄囊接种:主要用于虫媒披膜病毒以及鹦鹉热衣原体和立克次体等的分离和增殖。
4.羊膜腔接种:主要用于正黏病毒和副黏病毒的分离和增殖。在由病料初次分离病毒时,羊膜腔接种法比尿囊腔接种法敏感。但此法操作技术比较困难,鸡胚也易受伤致死。
兽医病毒学实验中,除常用鸡胚外,有时也用鸭胚、鹅胚、火鸡胚和鹌鹑胚等进行病毒分离、弱毒株培育、疫苗制造等。鸭胚和火鸡胚的孵化期为28d,比21d孵化期的鸡胚更有利于慢病毒的增殖。
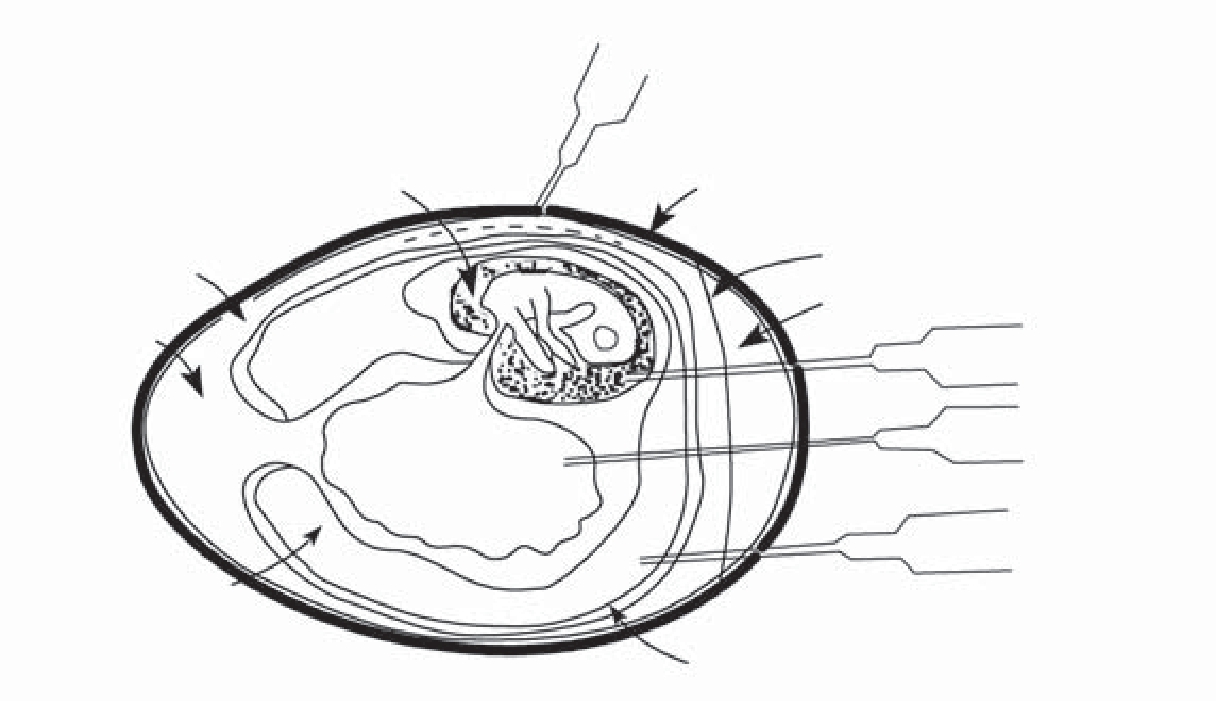
图3-4 鸡胚接种法
三、细胞培养法
体外的组织、器官和细胞培养是分离和增殖病毒以及进行病毒学实验研究的简便而有效的工具和手段。病毒在细胞内的增殖及其对细胞的作用,可以根据细胞病变、细胞培养物内出现血凝素或其他病毒抗原、红细胞吸附现象以及通过对“指示病毒”的干扰等方法加以识别。
组织培养是将动物组织切成小块在固定或悬浮状态下培养,现在已经很少用,只在某些慢病毒和难于在单层细胞内生长的病毒的分离培养上适用。早期制造的口蹄疫疫苗(Frenkle疫苗)就是口蹄疫病毒的牛舌上皮组织培养物。
器官的体外培养主要用于气管环的培养,特别适合观察呼吸道病毒对气管的破坏作用。这种培养还是研究器官生理机能以及某些病毒感染机理的良好工具。培养的器官组织能基本保持原来固有的特性,如气管黏膜能保持纤毛上皮运动。
由于细胞分散剂的应用,现在组织培养主要指单个细胞的体外培养。细胞培养与实验动物和鸡胚相比,不仅经济、方便、省时、省力,而且能提供大量生物性状稳定的细胞群体,降低了外界因素的影响,使实验结果更加准确可靠。因此,细胞培养是病毒学实验研究必不可少的重要工具和手段。用于培养病毒的细胞有原代细胞、二倍体细胞株和传代细胞系。
1.病毒培养常用的细胞:根据培养细胞的染色体和繁殖特性,可分为:
(1)原代细胞:直接利用新鲜动物组织经胰蛋白酶消化、分散,获得单个细胞,如鸡胚成纤维细胞、兔肾细胞等。原代细胞均为二倍体细胞,可用于生产病毒疫苗,如用兔肾细胞生产风疹疫苗,用鸡胚成纤维细胞生产麻疹疫苗,用猴肾细胞生产脊髓灰质炎疫苗。因原代细胞不能持续传代培养,故不便用于诊断工作。
(2)二倍体细胞株:将长成单层的原代细胞培养物,再进行消化分散成单个细胞后继续培养,以及随后的连续传代培养,称为继代细胞培养。原代细胞只能传2~3代细胞就退化,在多数细胞退化时,少数细胞能继续传下来,其染色体数与原代细胞一样,保持其二倍染色体数目,称为二倍体细胞。二倍体细胞生长迅速,并可传50代仍然保持二倍体特征,但不能无限制地连续传代,通常用胚胎组织的成纤维细胞(如WI-38细胞系)。目前多用二倍体细胞系制备病毒疫苗,也用于病毒的实验室诊断工作。
(3)传代细胞系:能在体外持续增殖传代的细胞,通常是由癌细胞或二倍体细胞突变而来(如HeLa、PK15、Vero细胞系等)。这类细胞的优点是容易培养,生长迅速,缺点是对病毒分离不太敏感,一般不能用来生产活疫苗,多用于病毒的分离鉴定,但美国最近批准使用Vero传代细胞系生产人用狂犬疫苗。
2.细胞培养方法:常用的细胞培养方法有静止细胞培养法、旋转细胞培养法、悬浮细胞培养法和微载体细胞培养法等,不同的细胞需要选择不同的细胞培养法进行培养。
(1)静止细胞培养法:静止细胞培养法是将细胞分装在细胞培养瓶或培养板(孔)中,置于含5%CO2温箱内培养。各种细胞尤其是传代细胞系在微量培养板上能获得良好生长,可应用于病毒分离、毒力滴定、中和试验、荧光抗体试验和酶联免疫吸附试验等。
(2)旋转细胞培养法:又称为转瓶(管)培养法,是将细胞分装在细胞培养瓶后,让培养瓶在温室的转床中缓慢旋转,使贴壁的单层细胞并不始终浸泡于培养液中,有利于细胞的新陈代谢,从而获得更为旺盛增殖的细胞培养。转瓶培养能充分利用整个瓶壁表面,使其长满细胞单层,能生产出高效价的病毒制品。
(3)悬浮细胞培养法:是一种细胞不贴壁而呈悬浮状态的培养方法,主要用于一些体外生长速度快或不贴壁的细胞。一般来说,活细胞都有可能在悬浮状态下生长,但原代细胞和二倍体继代细胞都难以在悬浮状态下生长。大规模培养哺乳类动物细胞是生产多种生物制品的重要方法,国内目前也已得到应用。
(4)微载体细胞培养:利用微载体培养动物细胞的原理是利用对细胞无毒性的微小颗粒,按一定比例放入混悬培养的营养液中,作为细胞附着增殖的载体,从而显著扩大细胞长成单层的附着面,充分利用生长空间和营养液,大大提高细胞产量。微载体培养的细胞即在载体表面形成单层生长,但为了不使载体沉淀,又要不断搅拌,使载体保持悬浮状态,所以微载体培养是单层细胞培养与悬浮培养相结合的方法。当前利用微载体已成功地培养了上百种动物细胞,不仅适用于传代细胞系,而且能使悬浮培养不能生长的很多原代细胞和二倍体细胞良好生长。因此微载体法应用前景广阔,不仅可用于生产疫苗、病毒抗原和单克隆抗体等,也是生产基因重组产品的重要手段。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















