第二节 常用溶液的配制
一、百分浓度
为每100份溶液中所含溶质或溶液的量,可以用重量或体积表示。溶液的百分浓度,一般可分为下列三种。
1.重量-体积百分浓度(以w/v表示)是以100ml溶液中所含溶质的克数所表示的溶液浓度,一般配制溶质为固体的溶液即以此法表示。如配制生理盐水,就是在100ml溶液中含有氯化钠0.85g。
2.体积-体积百分浓度(以v/v表示)是以100ml溶液中所含溶质的毫升数所表示的溶液浓度。一般多用于配制溶质为液体的溶液。如75%酒精溶液,就是在100ml酒精溶液中含纯乙醇75m1及水25ml。
3.重量-重量百分浓度(以w/w表示)是以100g溶液中所含溶质的克数所表示的溶液浓度。如过氧化氢水溶液的浓度即以此法表示。
二、摩尔浓度
用1L(1000m1)溶液中所含溶质的摩尔数来表示溶液的浓度叫做摩尔浓度。通常用字母mol/L表示。物质的量用克做单位来表示,在数值上同该物质的分子量相同,这个量叫做摩尔。例如,氯化钠的分子量为58.454,则1mol/L氯化钠的重量是58.454g。将58.454g氯化钠溶解于水,配制成1L溶液,就是1mo1/L氯化钠溶液。磷酸二氢钠(NaH2PO4·H2O)的分子量为138.0g,则其1mol/L的重量是138.0g。将69g磷酸二氢钠(NaH2PO4·H2O)溶解于水,配制成1L溶液,就是0.5mol/L磷酸二氢钠溶液。
摩尔及其计算:物质相互作用时,所需重量的比是一定的。例如,一个重量单位的氢与8个单位重量的氧化合而成水;8个重量单位的氧与3个重量单位的碳化合成二氧化碳。
某元素与8个重量单位的氧或一个重量单位的氢相化合或置换时所需的重量单位数,叫做该元素的摩尔量。
物质的量用克做单位来表示,在数值上同该物质的摩尔相同,这个量叫做摩尔量。
各种物质摩尔量计算的方法:

常用摩尔浓度溶剂的配制:摩尔浓度是1L(1000m1)溶液中所含溶质的摩尔数所表示的溶液浓度。通常用字母mol/L表示。
1.1mol/L草酸溶液的配制精确称取草酸(H2G2O4·2H2O,A.R)63.03g,置于干燥清洁烧杯内,加入少量蒸馏水,使其完全溶解后,倾入1000ml容量瓶内,再用蒸馏水将烧杯洗涤数次,洗液一并倾入容量瓶内,最后以蒸馏水加至刻度,混匀。此溶液可保存甚久,作为滴定碱溶液的基准溶液。
2.1mol/L硫酸溶液的配制量取浓硫酸(A.R或G.P)28ml,徐徐倾入已盛有蒸馏水约800m1的1000m1容量瓶内,随加随摇,注意发热(配制浓硫酸溶液时,切不可将水加入浓硫酸内,以免产生暴热,造成事故),冷却后以蒸馏水稀释至刻度,混匀,滴定。
滴定:准确吸取上述硫酸溶液20ml置250ml三角烧瓶内,加入蒸馏水50ml及1%酚酞指示剂2~3滴,以1mol/L氢氧化钠溶液滴定至粉红色,并以30s内不退色为止,记录氢氧化钠溶液的用量,并重复滴定一次。
计算:如果酸、碱二溶液用量相等,表示两者恰好为1mol/L。碱用量小于20ml,表示酸的浓度低于1mol/L,应加适量的浓硫酸后再滴定。碱用量多于20ml,表示酸浓度较高,应稀释。即碱量减去酸量,再被酸量除,结果为稀释1mol/L时每毫升加入蒸馏水0.05ml后为1mol/L。
3.1mol/L盐酸溶液的配制量取浓盐酸(A.R或G.P,比重1.18~1.19)100ml,置于已盛有蒸馏水的1000ml容量瓶内,再加蒸馏水至刻度,混匀。
滴定与计算:参考1mol/L硫酸配制法及滴定。
4.1mol/L硝酸溶液的配制量取浓硝酸(A.R比重1.42)63ml,缓慢地加入已盛有900ml蒸馏水的1000ml容量瓶内,加水至刻度,混匀后滴定。
滴定时用1mol/L氢氧化钠溶液,以酚红为指示剂,滴定方法同硫酸滴定法。
5.1mol/L醋酸溶液的配制取冰醋酸60ml,加水至1000ml,然后以1mol/L氢氧化钠溶液滴定,用酚红为指示剂。滴定法同硫酸滴定法。
6.1mol/L碳酸氢钠溶液的配制精确称取无水碳酸钠(A.R)530g,置于干燥清洁烧杯内,加蒸馏水少量,完全溶解后,倾入1000ml容量瓶内,并用蒸馏水洗涤烧杯数次,一并加入容量瓶内,再加蒸馏水至刻度,混匀。作为滴定酸溶液的基准溶液。
7.1mol/L氢氧化钠溶液的配制称取氢氧化钠(A.R或C.P)100g,放在三角烧瓶内(氢氧化钠溶解时发生高热,切不可在试剂瓶或量筒中溶解,以防容器炸裂而造成意外),徐徐加入蒸馏水200ml,并用玻璃棒搅拌,促其溶解,塞以橡皮塞,静置1周,使其中可能含有的碳酸盐沉淀。吸取上清溶液100ml,放在1000ml容量瓶内,加蒸馏水至刻度。均匀后滴定。
滴定:准确吸取1mol/L草酸溶液20ml,放于250ml三角瓶中,再加蒸馏水50ml,1%酚酞指示剂2~3滴,以上述氢氧化钠溶液滴定至溶液变为粉红色,并在30s内不退色为止。
计算:根据消耗氢氧化钠溶液的毫升数以修正氢氧化钠的浓度,即根据滴定所用的量可计算出此氢氧化钠溶液尚需稀释的量,配成相同摩尔浓度的溶液。例如,滴定20mol/L草酸溶液,共消耗19ml氢氧化钠溶液,则19ml氢氧化钠液需再加蒸馏水1ml,即成1mol/L氢氧化钠溶液。每次滴定须重复一遍,以保证准确性(以酸、碱溶液滴定时,必须以碱溶液滴定酸溶液中,不可相反滴定)。
8.0.1mol/L高锰酸钾溶液的配制称取干燥高锰酸钾约3.5g,加水至1000ml,充分混合后,置棕色试剂瓶中,静置暗处7d~10d,或加热至60℃左右待冷,紧塞瓶塞,静置暗处一昼夜,然后取出上清液,按下法滴定校正。
用容量吸管吸取0.1mol/L草酸溶液20ml及10%硫酸溶液20ml,浸在65℃~80℃温水的三角烧瓶中,以上述高锰酸钾溶液滴定,至溶液呈粉红色并可维持1min不退色为止。同样再取蒸馏水20ml及10%硫酸溶液20ml,也以高锰酸钾溶液滴定,作为空白对照。滴定草酸溶液时用去的毫升数,减去空白滴定时用去的毫升数,再以20ml减之,即为高锰酸钾溶液加至20ml时需加蒸馏水毫升数。稀释成0.1mol/L溶液后应重复滴定一次。高锰酸钾溶液性质颇不稳定,即便贮于棕色瓶内也应经常校正。
9.0.1mol/L重铬酸钾溶液的配制取重铬酸钾(A.R)粉末,置120℃烘箱内烤干,再移置干燥器内于室温下使冷却。精确称取4.9035g,溶于蒸馏水内使成1000ml,即得0.1mol/L重铬酸钾溶液。
10.0.1mol/L硫代硫酸钠溶液的配制称取硫代硫酸钠(Na2S2O3·5H2O,G.P)52g溶于新煮沸已冷却的蒸馏水内,使成1000ml,取此溶液与0.1mol/L碘溶液或0.1mol/L重铬酸钾溶液按下法滴定。
准确量取0.1mol/L重铬酸钾溶液30ml,置三角烧瓶内,加蒸馏水50ml,称取碘化钾2g并加入浓盐酸5ml,塞上瓶塞,放置10min,再加蒸馏水100ml稀释。以硫代硫酸钠溶液滴定析出之碘,当溶液已成淡黄绿色时,加入1%淀粉溶液2~3滴,并继续滴定至淀粉之蓝色消失为止,记录所消耗的硫代硫酸钠溶液的毫升数,再按滴定氢氧化钠溶液的方法计算和修正其浓度。
硫代硫酸钠溶液的浓度易被空气及溶于蒸馏水中的二氧化碳氧化而变淡。为使溶液稳定,可加入碳酸钠0.2g,紧塞瓶口,摇匀,置暗处2~3天,以除去水中的二氧化碳及可能来自蒸馏器的极微量的Cu2+。
11.0.1mol/L碘溶液的配制于1000ml容量瓶内加入蒸馏水100ml及碘化钾24g,待碘化钾完全溶解后,再加入纯碘片13.5g,溶解后再加蒸馏水稀释到刻度处,用0.1mol/L硫代硫酸钠液滴定。
准确吸取0.1mol/L硫代硫酸钠液25ml置三角烧瓶中,加淀粉液2ml~3ml,摇匀,随摇随加入碘溶液,由于碘分子被还原成碘离子的关系,起初滴下的碘溶液为无色。当硫代硫酸钠全部被碘氧化后,极微的过量碘溶液,可与淀粉液发生作用而呈蓝色,此即滴定终点。由用去碘溶液的毫升数,计算蒸馏水的加入量,从而校正成为0.1mol/L碘溶液。
12.1mol/L碘酸钾溶液的配制先将碘酸钾置于110℃干燥箱内,干燥2h后取出放冷。立即精确称取3.567g,置于100ml容量瓶中,加少量水溶解后,再补加蒸馏水至100ml,于棕色玻瓶中避光保存(须紧塞瓶盖),即为1mol/L碘酸钾溶液。
13.1mol/L氯化钠溶液的配制称取氯化钠(A.R)58.50g,放于1000ml容量瓶内,加少量的蒸馏水溶解后,再加水至刻度处。
14.1mol/L硝酸银溶液的配制称取硝酸银169.97g,放于1000ml容量瓶内,加少量蒸馏备水溶解后,继续加水至刻度。
三、溶液浓度稀释计算法
已知浓度的溶液,如欲稀释成其他浓度,可按下列方法计算。
稀释公式法
稀溶液的浓度∶浓溶液的浓度=浓溶液的体积∶稀溶液的体积。
则,浓溶液的体积×浓溶液的浓度=稀溶液的体积×稀溶液的浓度
例:欲配制10%葡萄糖溶液500ml,需用50%葡萄糖溶液多少毫升?
![]()
交叉法则
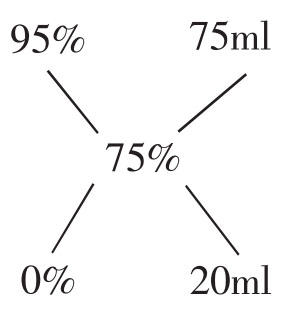
1.由已知浓度的溶液稀释成所需浓度的溶液:把所需的浓度放在两条直线的交叉点,已知浓度写在左上端,左下端写上蒸馏水的浓度0,然后把每一条线上的两个数字相减,将其差数写在该直线的另一端,如此右上端和右下端的数字,便分别表示出制备此溶液时,需用已知浓度的溶液和蒸馏水之份数。例如:现有95%酒精,怎样配成75%酒精?
即需将95%酒精75ml加水20ml,混合即成75%洒精95ml。
2.由两种已知浓度的溶液欲配制介于两者之间的所需浓度的溶液,可按下法进行:把所需浓度放在两条直线交叉点,已知高浓度的写在左上端,低浓度的写在左下端,然后把每一条直线上的两个数字相减,将其差数写在该直线的另一端。如此右上端和右下端的数字便分别是制备所需浓度的溶液时,需用每一浓度溶液的份数。
例如,由5%及50%两种葡萄糖溶液怎样配制10%葡萄糖溶液?
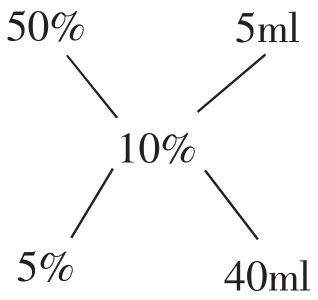
此即表示用50%葡萄糖溶液5ml和5%葡萄糖液40ml混合,即可配成10%葡萄糖溶液45ml。
四、不同单位浓度溶液换算方法
当量浓度与摩尔浓度的换算:
1.当量浓度=摩尔浓度×化合价
如1当量硫酸溶液相当于多少摩尔浓度?
代入上式:摩尔浓度=1÷2=0.5
2.当量浓度=克分子浓度×化合价
如0.66mol/L。磷酸溶液相当于多少当量浓度?
代入上式:当量浓度=0.667×3≈2
如化合价为1价,则当量浓度即等于摩尔浓度。
百分浓度(w/v)与当量浓度及摩尔浓度的换算:
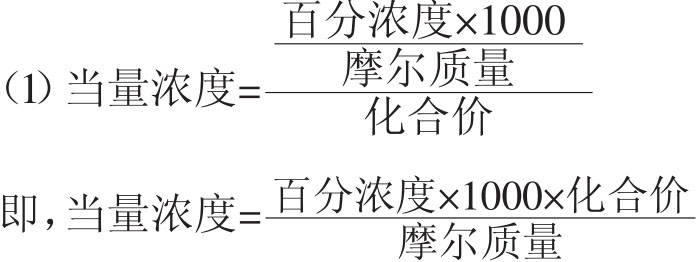
如22%(w/v)硫酸钠溶液相当于几个当量浓度?

如22%(w/v)硫酸钠溶液相当于几个当量浓度?
![]()
当量浓度及摩尔浓度与百分浓度(w/n)的换算:
![]()
如3.1mol/L硫酸钠溶液相当于百分浓度(w/v)多少?

如1.55mol/L硫酸钠溶液相当于百分浓度(w/v)多少?
![]()
容量分析中当量浓度与溶液体积之间的基本计算:当两种溶液互相反应达到终点时,它们的克当量数或毫克当量数应恰巧相等,可以下式表示之:
NV=NlVl
N为第一种溶液的当量浓度,V为第一种溶液的体积;N1为第二种溶液的当量浓度,V1为第二种溶液的体积。
例如,以1.250mol/L盐酸溶液滴定20ml氢氧化钠溶液,滴定恰到终点时,用去盐酸溶液18.94ml,则氢氧化钠溶液的当量浓度是多少?
![]()
即该氢氧化钠溶液的当量浓度是1.184mol/L。
五、常用缓冲液的配制
1.甘氨酸-盐酸缓冲液(0.05mol/L)
X ml 0.2mol/L甘氨酸+Y ml 0.2molL HCl,再加水稀释至
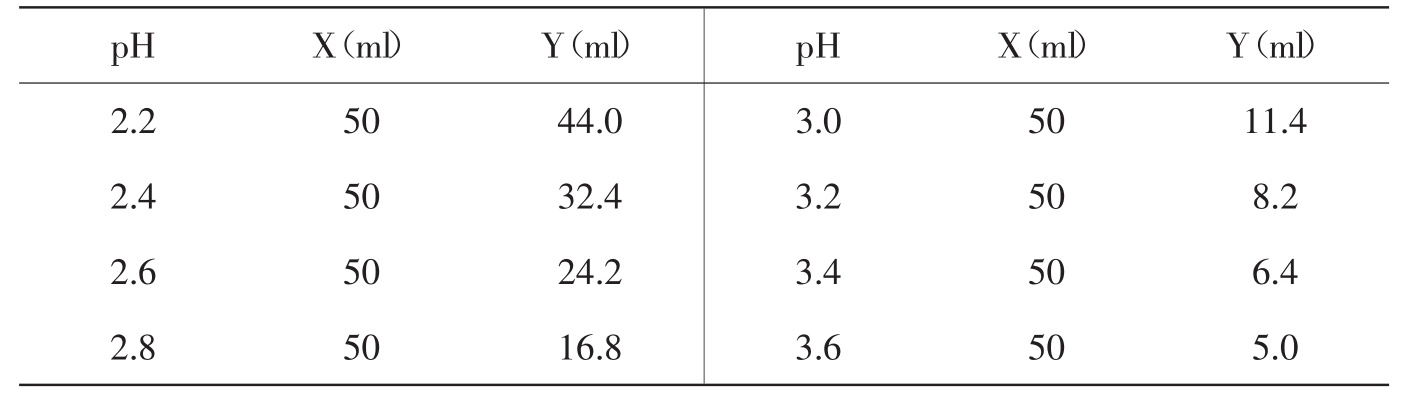
甘氨酸分子量为75.07,0.2mol/L甘氨酸溶液含15.01g/L。
2.邻苯二甲酸-盐酸缓冲液(0.05mol/L)
X ml0.2mol/L邻苯二甲酸氢钾+Y ml0.2mol/L HCl,再加水稀释到20m

邻苯二甲酸氢钾分子量为204.23,0.2mol/L邻苯二甲酸氢溶液含40.85g/L。
3.磷酸氢二钠-柠檬酸缓冲液

续表

Na2HPO4分子量为14.98,0.2mol/L溶液为28.40g/L。
Na2HPO4·2H2O分子量为178.05,0.2mol/L溶液含35.61g/L。
C4H2O7·H2O分子量为210.14,0.1mol/L溶液为21.01g/L。
4.柠檬酸-氢氧化钠-盐酸缓冲液
使用时可以每升中加入1g酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸-柠檬酸钠缓冲液(0.1mol/L)
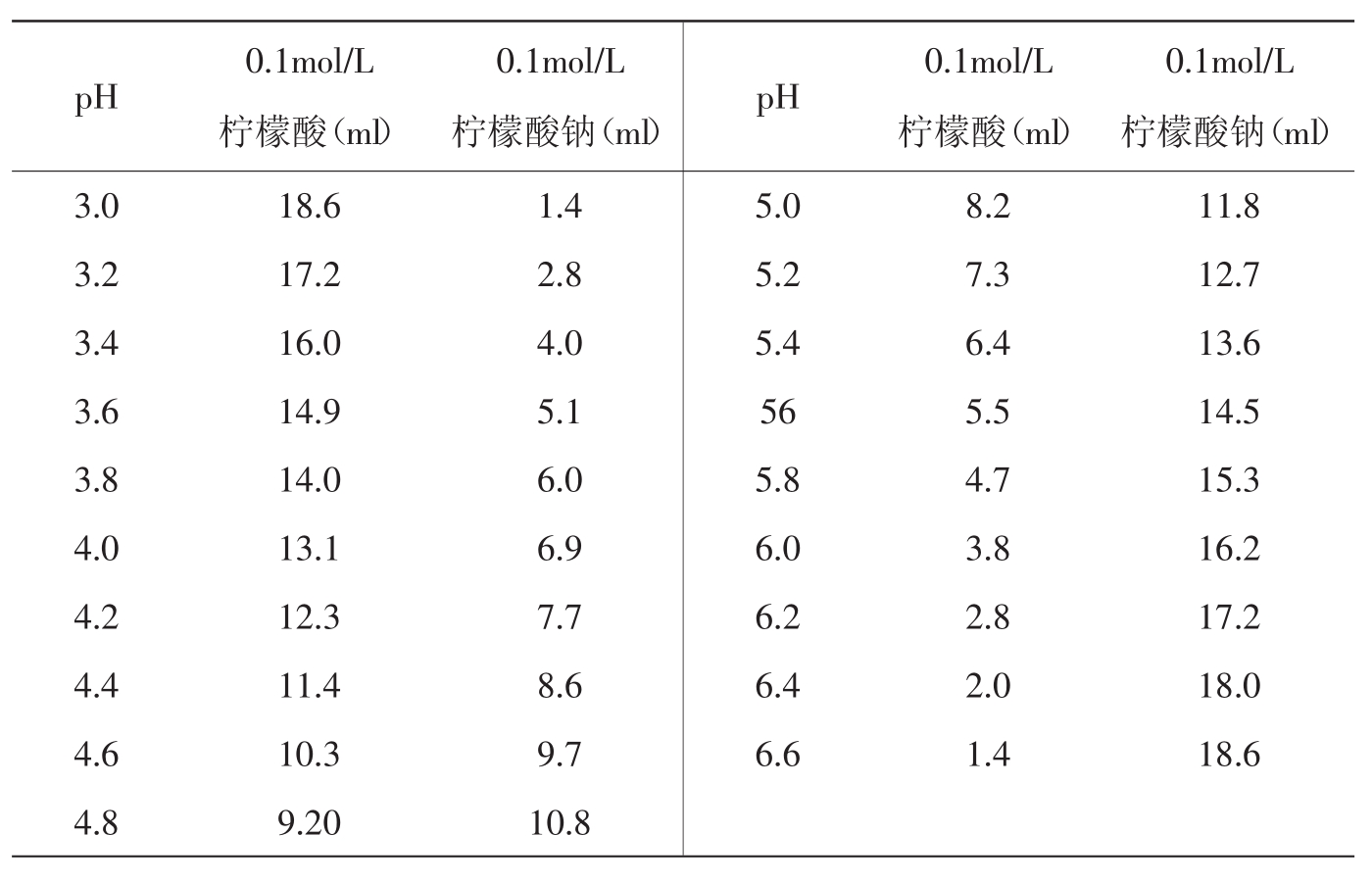
柠檬酸C6H8O7·H2O分子量为210.14,0.1mol/L溶液为21.01g/L。
柠檬酸钠Na3C6H5O7·2H2O分子量为294.12,0.1mol/L溶液为29.41g/ml。
6.乙酸-乙酸钠缓冲液(0.2mol/L)
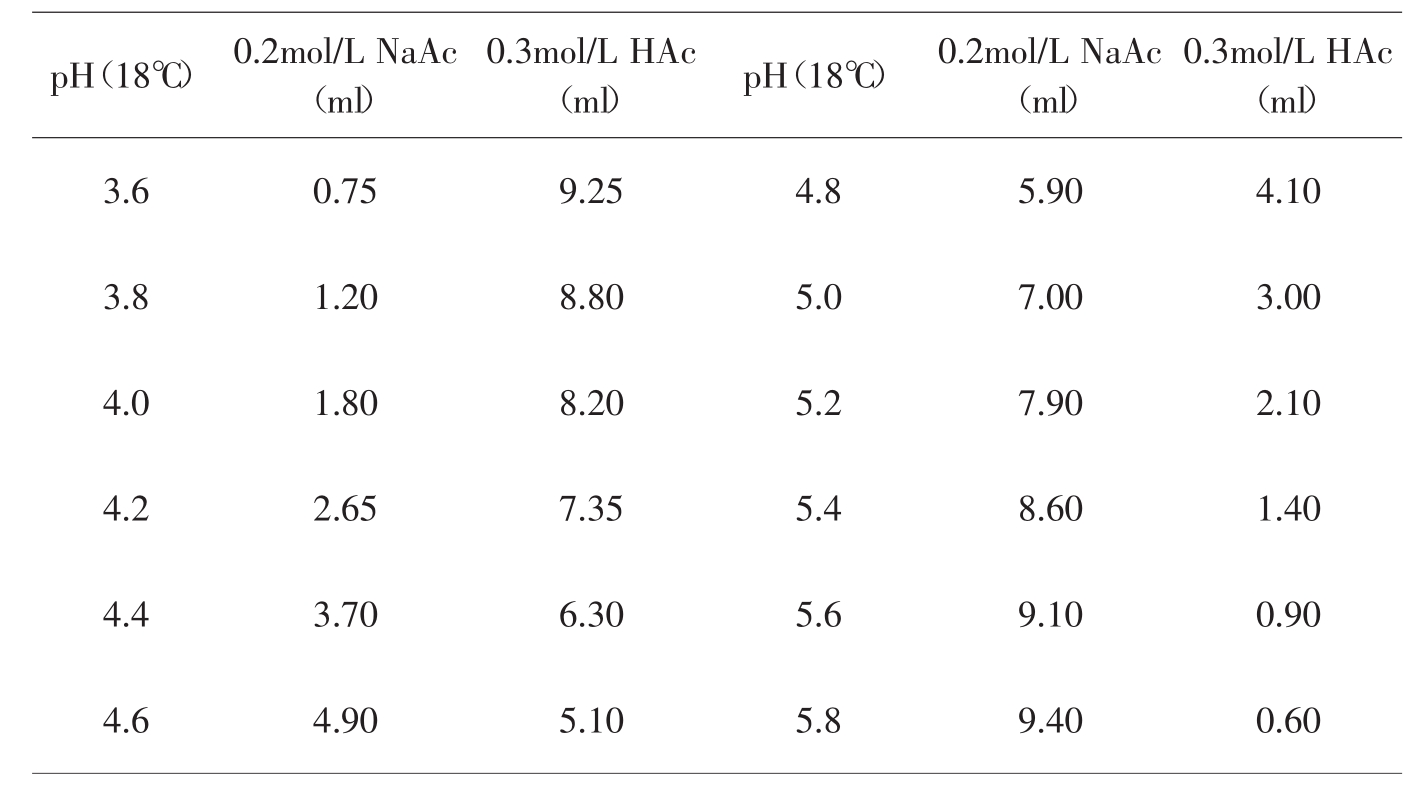
NaAc·3H2O分子量=136.09,0.2mol/L溶液为27.22g/L。
7.磷酸盐缓冲液
(1)磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L)
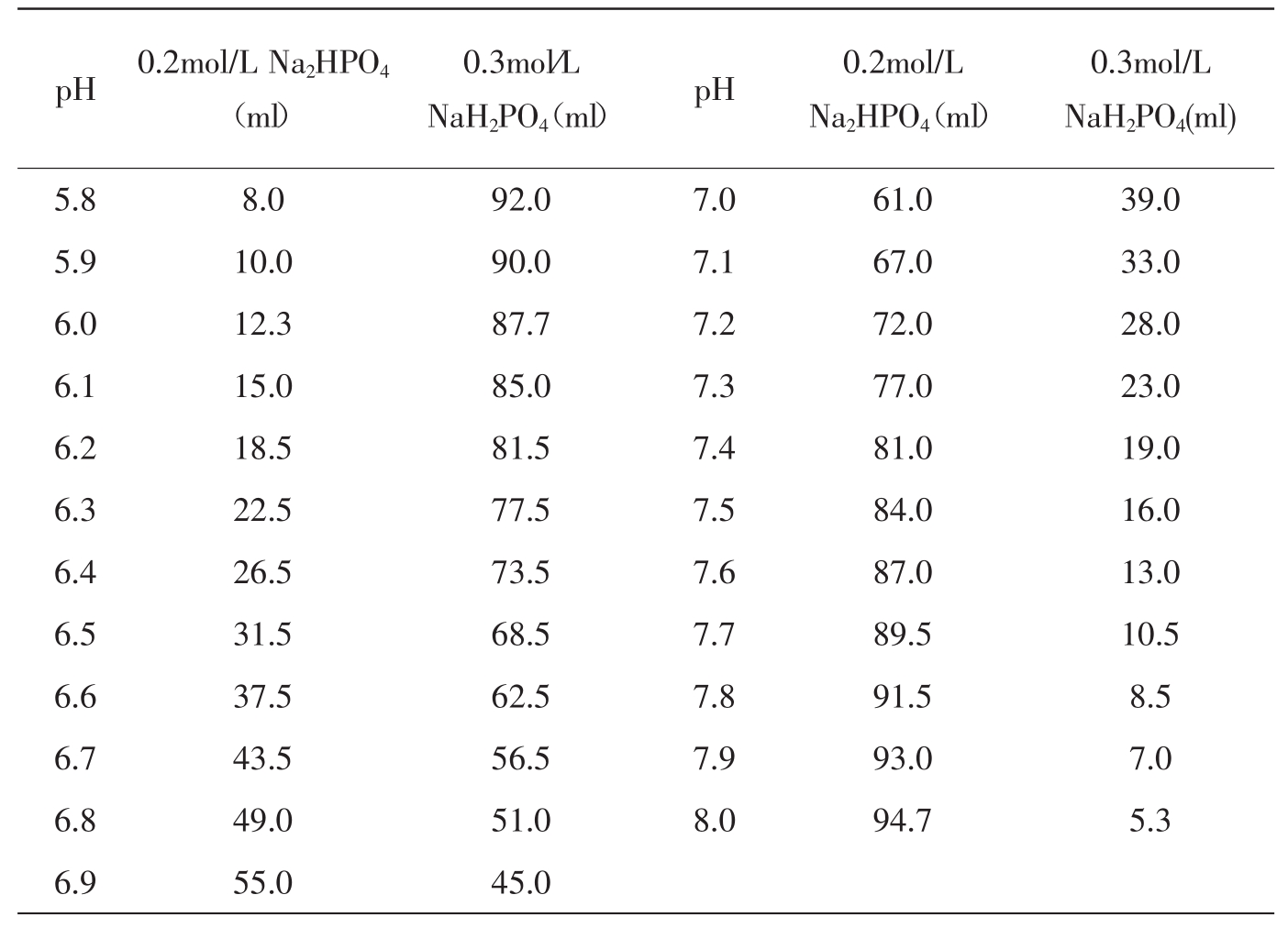
Na2HPO4·2H2O分子量为178.05,0.2mol/L溶液为85.61g/L。
Na2HPO4·12H2O分子量为358.22,0.2mol/L溶液为71.64g/L。
Na2HPO4·2H2O分子量为156.03,0.2mol/L溶液为31.21g/L。
(2)磷酸氢二钠-磷酸二氢钾缓冲液(1/15mol/L)

Na2HPO4·2H2O分子量为178.05,1/15mol/L溶液为11.876g/L。
KH2PO4分子量为136.09,1/15mol/L溶液为9.078g/L。
8.磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L)
Xml 0.2mol/L KH2PO4+Yml 0.2mol/L NaOH加水稀释至20ml

9.巴比妥钠-盐酸缓冲液(18℃)
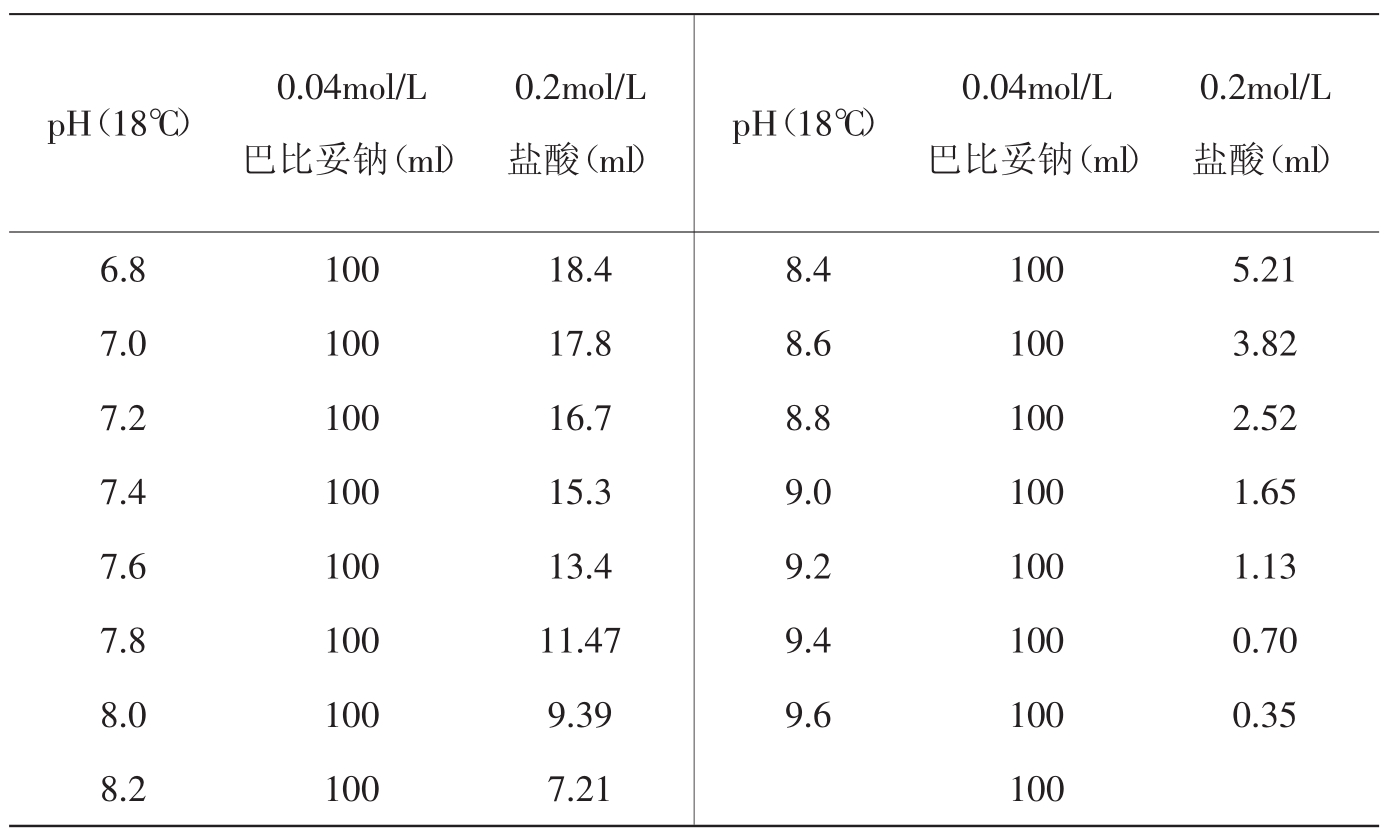
巴比妥钠盐分子量=206.18;0.04mol/L溶液为8.25g/L
10.Tris-HCl缓冲液(0.05mol/L)
50ml0.1mol/L三羟甲基氨基甲烷(Tris)溶液与Xml0.1mol/L盐酸混匀后,加水稀释至100ml。
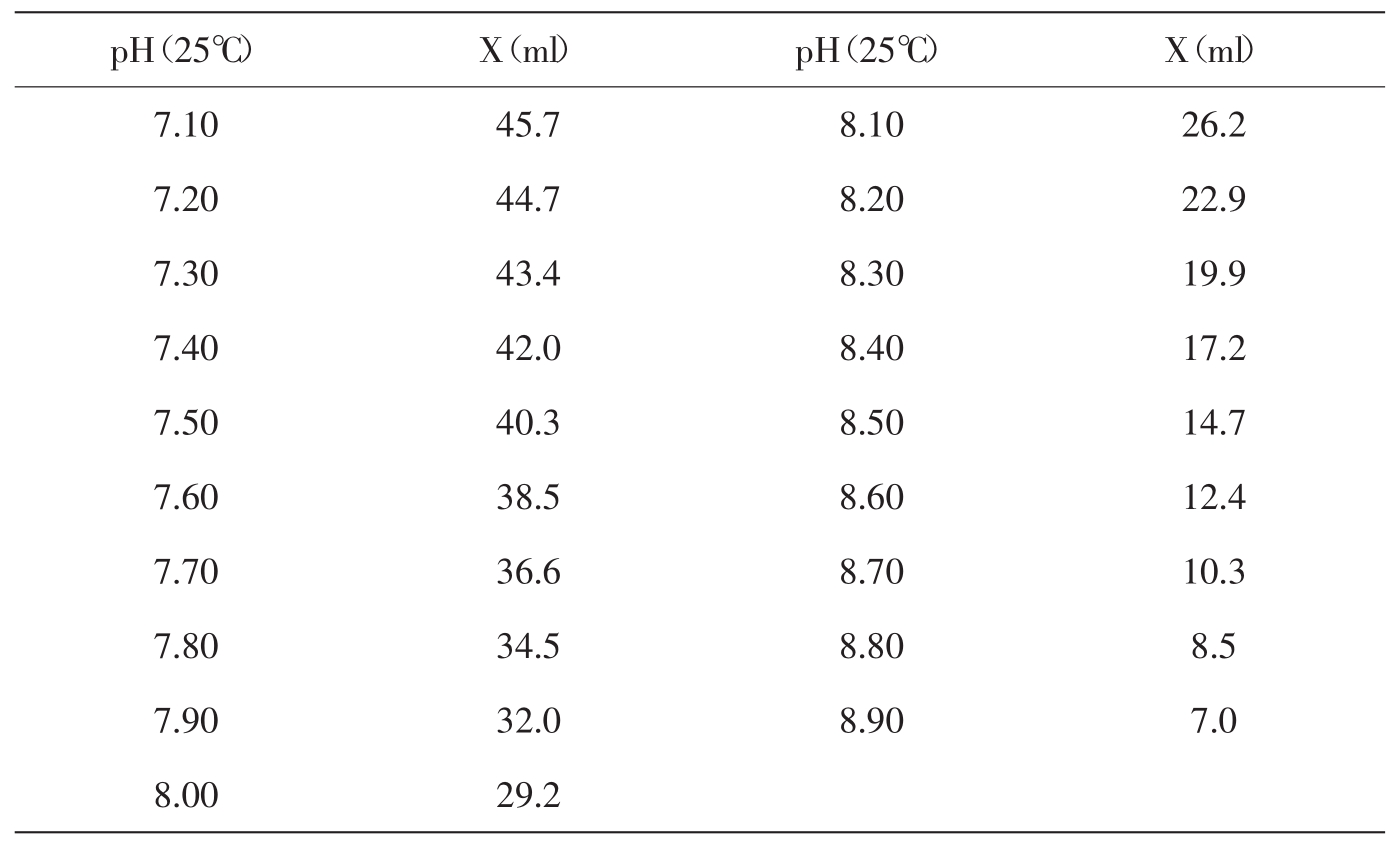
三羟甲基氨基甲烷分子量=121.14;0.1mol/L溶液为12.114g/L。Tris溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
11.硼酸-硼砂缓冲液(0.2mol/L硼酸根)

硼砂Na2B4O7·H2O,分子量=381.43;0.05mol/L溶液(=0.2mol/L硼酸根)含19.07g/L。
硼酸H2BO3,分子量=61.84,0.2mol/L溶液为12.37g/L。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸-氢氧化钠缓冲液(0.05mol/L)
Xml 0.2mol/L甘氨酸+Yml 0.2mol/LNaOH加水稀释至200ml

甘氨酸分子量=75.07;0.2mol/L溶液含15.01g/L。
13.硼砂-氢氧化钠缓冲液(0.05mol/ml硼酸根)
Xml 0.05mol/L硼砂+Yml 0.2mol/L NaOH加水稀释至200ml
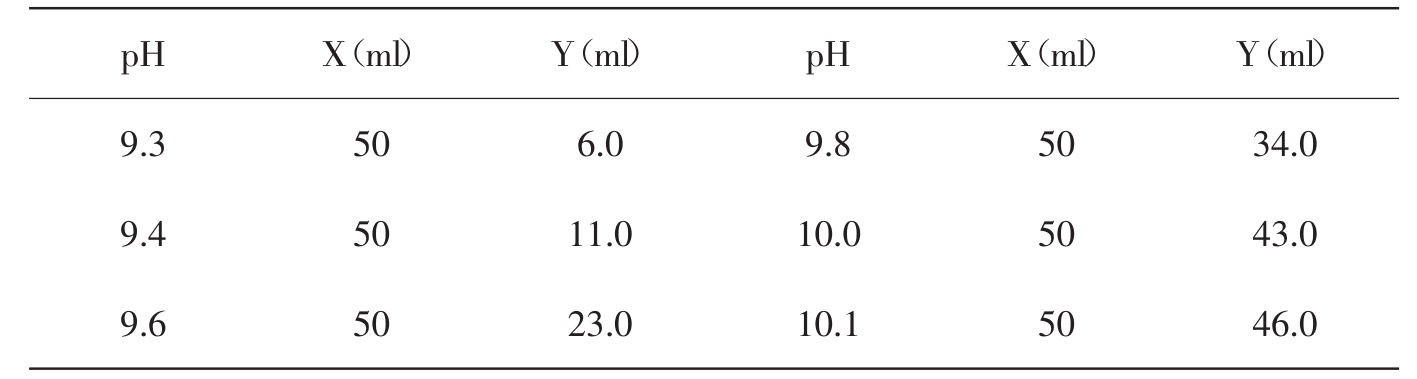
硼砂Na2B4O7·10H2O分子量=381.43;0.05mol/L硼砂溶液为19.07g/L。
14.碳酸钠-碳酸氢钠缓冲液(0.1mol/L)Ca2+、Mg2+存在时不得使用

Na2CO2·10H2O分子量=286.2;0.1mol/L溶液为28.62g/L。
NHCO3分子量=84.0;0.1mol/L溶液为8.40g/L。
15.“PBS”缓冲液

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















