4 结果及讨论
4.1 日照时间与变色深度
纳米TiO2粉体在日光或紫外光下照射一定时间后,色差值均小于1,肉眼观察不到变色现象。若将其与甘油按3∶97的质量比混合均匀后,移至太阳光下照射一定时间后,照射面开始出现变色现象,随着照射时间延长,变色程度加深,并逐渐渗入体系内部,如图1所示。
图1中,a为初始试样,b为照射2h后,c为照射4h后。若将变色试样移至室内,则颜色逐渐恢复至初始状态。颜色越深,恢复时间越长,b试样恢复至初始状态需要24h以上,c试样则需要更长时间。将纳米TiO2加入聚甘油基-2二聚羟基硬脂酸酯(PGPH)中,暴露于阳光下时,亦会出现与甘油类似的变色反应。



图1 变色程度与照射时间
4.2 晶型结构对与变色反应
为探索不同结构TiO2的光致变色现象,选取甘油作为溶剂,按二氧化钛:甘油=3:97的质量比例混合均匀,置于紫外箱中照射,样品距灯管10cm,20h后观察其颜色变化。实验样品为:(a)水合TiO2,即偏钛酸,其中TiO2为无定形结构;(b)锐钛型纳米TiO2;(c)混晶型纳米TiO2(R含量为80%);(d)金红石型纳米TiO2。实验结果如图2所示。

图2 TiO2在甘油中的光致变色现象(a)水合TiO2 (b)锐态型 (c)混晶型 (d)金红石型
从图2可知,从左到右,变色程度依次变浅。其中含有水合TiO2的体系变色最为严重,呈深蓝色;含有锐态及混晶的体系呈现浅蓝色;含有金红石型TiO2的体系没有观察到明显的蓝色现象。实验结果表明,甘油体系变色程度与TiO2晶型及结构有很大关系。
根据双注入机制理论,三价钛的产生与电子-空穴对的复合相互制约。非晶型水合TiO2由于不具有周期性,存在大量的结构缺陷,空位和微孔等缺陷比晶体结构的TiO2更多,这些结构缺陷和空位可以作为捕获剂使电子限域在其附近,电子不能自由移动,降低了电子-空穴对复合的几率,从而可以形成大量的Ti3+。锐钛型TiO2晶格内也具有较多的缺陷和位错,能更多地俘获电子,使得锐钛相中的电子-空穴对分离,利于Ti3+的存在。而金红石型TiO2是TiO2中最稳定的同素异构形式,具有较好的晶化态,只有较少的结构缺陷来俘获电子,电子-空穴对复合速率很快,Ti3+的形成率很低,所以纯的金红石TiO2一般不会产生明显的光致变色现象。混晶型TiO2由于同时具有金红石相和锐钛相,其变色程度介于两者之间。混晶(如P25)结构混杂增大了TiO2晶格内的缺陷密度,电子-空穴对复合率低于锐钛,其光致变色效果比锐态型更加明显。
4.3 变色现象光谱分析
(1)紫外可见光测试
以水合TiO2为例,检测其照射前后的可见光吸收光谱,结果如图3所示。

图3 水合TiO2分散于甘油中经不同光照时间后的可见光吸收光谱照射时间:a—0h;b—1.5h;c—2h;d—6h
从图3可以看出,紫外照射前,水合TiO2没有显示出明显的可见光吸收,经紫外照射后,吸收率随紫外照射时间的增加而缓慢增加,且在500~800nm比照射前有较宽的吸收,最大吸收值出现在700nm左右,可见光吸收峰较宽,其结果与小极子模型一致。
(2)XPS分析
分散于甘油中的纳米TiO2经紫外照射前后Ti的XPS图谱结果如图4所示。
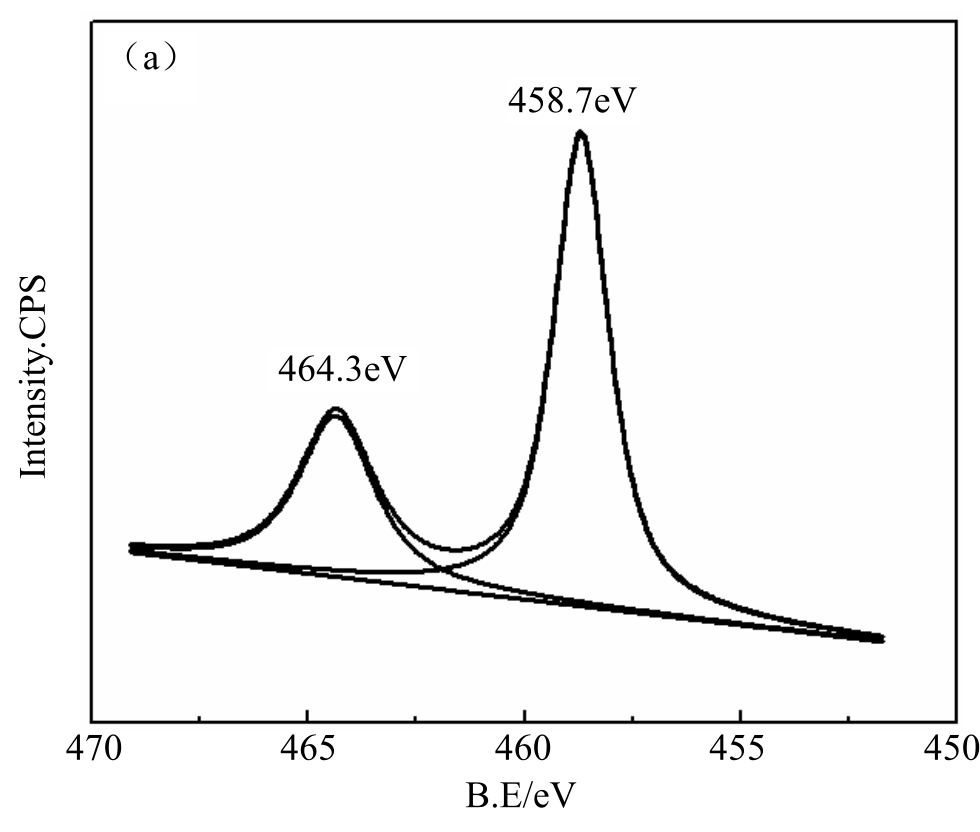

图4 样品的XPS图谱(a)光照前的水合TiO2(b)光照后的水合TiO2(c)光照后的金红石型
从图4(a)中可看出,Ti的2p轨道存在两个具有标准对称性的Ti 2p3/2(458.7eV)与Ti 2p1/2(464.3eV)分离轨道,两峰电子结合能相差5.6eV,表示Ti完全以Ti4+形式存在。而经紫外照射后,XPS结果(图4(b))显示Ti的2p轨道在更低能量处(457.2eV和462.5eV)出现了另外两个峰,表明有Ti3+的出现。金红石型纳米TiO2照射后Ti的XPS图谱如图4(c)所示,未发现Ti3+的存在。
TiO2在甘油、高浓度碳水化合物溶液、有机酸的乙醇溶液及含有少量烃类的乙醇溶液等条件下都有变色现象发生。Manuela Russo等人[7]通过研究甘油环境中水合TiO2的光致变色现象后认为甘油在光致还原Ti4+到Ti3+的过程中起到一个媒介作用,至少甘油可以使还原的产物稳定存在。他们还认为甘油可以通过氢键与Ti4+-OH基团作用,从而有利于光诱导Ti-O键裂解生成Ti3+和活性OH•。C.Renz等人[3]认为甘油在TiO2光致变色现象中起还原剂的作用,其氧化产物CO2以气泡的形式表现出来。实验中我们没有看到气泡产生,但也不能排除CO2的存在。文献认为甘油等醇类可以作为还原剂,与空穴结合后降低电子-空穴对复合率,但氧化产物含有醛类。这些观点都认为甘油的存在有利于Ti4+向Ti3+的转变,对TiO2的光致变色效应有增强效果,但更详细的机理还有待进一步研究。
4.4 光致变色现象的减弱或消除
根据双注入机理,纳米TiO2在化妆品中光致变色的原因是由于混晶(锐态的存在)和结晶不完整共同引起的,因此,采取消除锐钛型和非晶型TiO2,或在TiO2表面包覆完整无机氧化物膜层,以减少Ti3+物质的生成,可抑制变色现象。如混晶型纳米TiO2(金红石型含量为60%)经高温处理后全部转化为金红石型(XRD如图5所示),将得到的TiO2样品分散于甘油中,在日光下照射5h,未见明显变色现象。
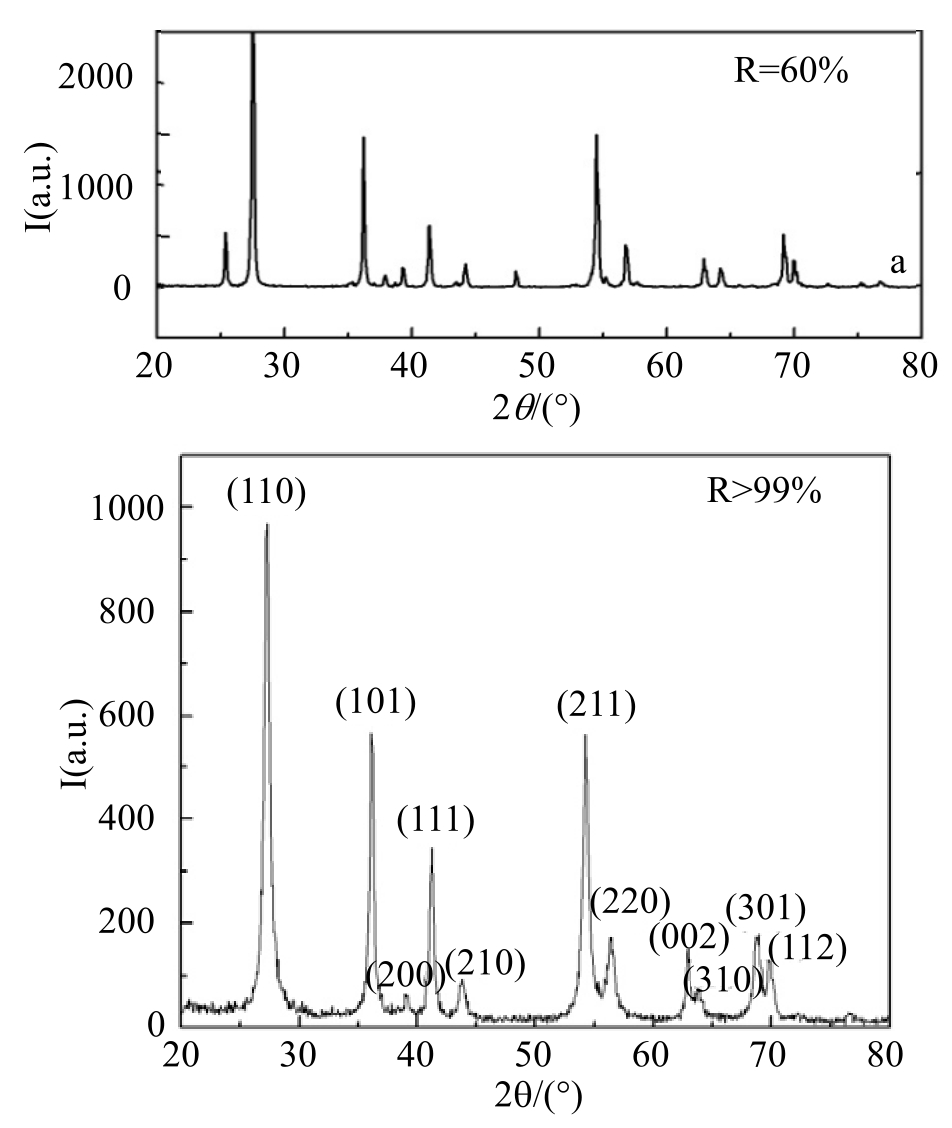
图5 TiO2的XRD图
若在混晶型纳米TiO2表面包覆一层致密的Al2O3膜后,与甘油混合在日光下照射5h,样品有轻微变色现象。
因此,采取煅烧方式,提高金红石型含量,减少了Ti3+物质的生成,可抑制变色现象;或在TiO2表面包覆致密的无机氧化物膜层,阻隔了纳米TiO2和周围介质之间的接触,减慢了水和氧扩散到可能与自由电子反应的表面,防止了自由基的形成,同时Al3+也起了晶格空穴陷阱的作用,促进电子/空穴重新结合,从而达到降低光致变色现象的效果。
4.5 化学变色现象
若将适量紫色的Ti3+溶液直接加入至甘油体系中混合均匀,未观察到体系显现蓝色现象。若预先在甘油体系中加入适量钛液,混合均匀后再加入适量铝粉并混合均匀,则体系立即出现均一的、深度的蓝色现象,其程度与经太阳光中强烈曝晒效果相当。因此可以认为,二氧化钛与甘油的混合体系经紫外光照射出现变色现象,是由于Ti3+与其他物质生成了一种新的蓝色物质,该物质具有不稳定性,易分解。这种有色物质的组成及结构有待进一步研究。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















