§ 4.6 割裂基因和尚邦法则
20世纪70年代中期基因结构研究的一个重大突破是割裂基因的发现。1972年,罗伯茨(R.J.Roberts)刚完成在哈佛大学的博士后研究,就受沃森之邀进入冷泉港实验室工作。他做了大量的限制性内切酶的分离鉴定工作,并把限制性酶用于多种病毒的基因组测序。1974年他开始腺病毒的mRNA测序,他和他的同事想通过mRNA 5′端的测序来确定腺病毒DNA的启动子序列,随着实验的一步步进展,在mRNA和DNA的序列比较过程中,他们发现了腺病毒基因被割裂的生物化学证据。接着,罗伯茨借助电子显微镜分析mRNA和DNA分子杂交图像,看到了与mRNA不能配对的DNA序列膨出形成单链的环,证实了腺病毒基因的确被不编码蛋白质的间隔序列所割裂。1993年他和麻省理工学院的夏普分享了诺贝尔生理学或医学奖。夏普的工作与罗伯茨完全独立但很相似,他的研究小组也在20世纪70年代中期做腺病毒mRNA的测序,并进行相关的功能研究,夏普发现在细胞核内合成的很长的RNA分子并没有出现在细胞质中,他猜测这个长RNA被细胞加工成了较短的mRNA,接着他也用mRNA和DNA的分子杂交分析和电镜观察证实了割裂基因的存在。
1977年10月—12月这短短的3个月中,先后有三个实验室发现了真核生物的割裂基因:一是美国国立卫生研究院的莱德(P.Leder)发现小鼠β珠蛋白基因是割裂的;二是法国巴斯德大学的尚邦(P.Chambon)发现鸡的卵清蛋白基因是割裂的;三是荷兰阿姆斯特丹大学的杰弗里斯(A.Jeffries)和弗拉维尔(R.Flavell)一起发现兔的β珠蛋白基因也是割裂的。下面我们以法国巴斯德大学的生化教授尚邦关于鸡卵清蛋白的工作为例,对割裂基因的发现过程做些介绍和分析。
20世纪70年代中期,尚邦开始用分子生物学的理论和方法来研究细胞分化问题。他选择的课题是雌激素(estoogens)和孕激素(progestins)怎样控制母鸡输卵管的分化和蛋清的主要成分卵清蛋白(ovalbumin)基因的表达。
卵清蛋白由386个氨基酸组成,由输卵管中高度分化的管状腺细胞分泌,但只有在雌性激素存在时,卵清蛋白基因才能得以转录。为了研究这个基因表达的调控,尚邦实验室的同事和研究生从管状腺细胞中分离到了卵清蛋白基因的mRNA(在这种细胞中约50%的mRNA是卵清蛋白的mRNA),全长为1 872个核苷酸。这个mRNA分子的5′端有64个核苷酸是不翻译的前导序列,3′端的650个核苷酸也不翻译,中间1 158个核苷酸编码卵清蛋白的386个氨基酸。以分离到的mRNA为样板,经逆转录酶作用可获得卵清蛋白mRNA的互补DNA(cDNA)。他们将cDNA克隆于质粒做进一步的结构和功能研究。
DNA结构分析的第一步往往是限制性内切酶谱分析。尚邦等很快发现在这个由逆转录途径获得的cDNA,或者说“卵清蛋白基因”,没有最常用的内切酶Eco R Ⅰ和Hin dⅡ的切点。为了比较上述逆转录“基因”和基因组中真正的卵清蛋白基因的结构(实际上是比较mRNA和DNA结构),尚邦的助手布雷瑟纳克(R.Breathnach)将从鸡的红细胞分离到的DNA用Eco R Ⅰ或HindⅡ处理,并预先估计这两种酶虽会将鸡的基因组DNA切成105~106个片段,但卵清蛋白基因由于不含Eco R Ⅰ的切割位点而应该是完整的,所以如果用逆转录得到的“卵清蛋白基因”作探针经DNA印迹杂交,应该出现一条杂交带。然而多次重复实验得到的都是4条带。会不会是红细胞基因组中卵清蛋白基因在发育过程中经过了基因水平的结构分化呢?布雷瑟纳克又用来自输卵管细胞的基因组DNA做了重复实验,结果仍然出现同样的4条带。在1977年的欧洲分子生物学会议上,布雷瑟纳克和尚邦报告了他们的工作,与会者却对他们的报告反应冷淡,甚至有人认为这是实验操作造成的人为产物。更重要的是他们自己也没有提出令人信服的理论假设来说明“多带”现象。会议以后,他们立刻对两种卵清蛋白基因做了详细深入的限制性内切酶的酶谱分析和比较。实验进一步证实来自cDNA的基因没有Eco R Ⅰ的切点,而来自基因组的卵清蛋白基因却能被Eco R Ⅰ切成三段:Eb、Ec和Ea(图4-14)。这清楚地表明编码卵清蛋白的基因型DNA序列本身没有Eco R Ⅰ切点,但它被某些带有Eco R Ⅰ切点的非编码序列隔开了。Hin dⅡ的酶谱分析也证实了间隔序列的存在。

图4-14 卵清蛋白基因cDNA和基因组DNA的结构比较(引自P.Chambon)
H:Hha Ⅰ;Hd:Hind Ⅲ;X:Xba Ⅰ;P:Pst Ⅰ;E:EcoRⅠ
不久,卵清蛋白基因的mRNA和基因组DNA的分子杂交的电镜照片完全证实了尚邦的设想。电镜照片揭示mRNA和基因组DNA有8个可配对的区段,这些是基因中编码蛋白质的外显子(exon)部分。另有7个在基因组DNA中存在,但在mRNA中没有同源序列的内含子(intoon)区段,这些区段在照片中呈现为环(图4-15)。可以看到mRNA和DNA虽然有很大的结构差异,但从5′端到3′端仍保持着完整一致的线性相关,而且这种线性相关还一直延伸到基因的蛋白产物。卵清蛋白基因全长7 700个碱基对,相当于mRNA的4倍,相当于外显子序列的7倍。
割裂基因这个关于真核基因结构的重大发现,很快为世界各国的多个实验室所证实,特别是瑞士巴塞尔免疫学研究所的里根川进(S.Tonegawa)发现免疫球蛋白基因也是割裂基因,并由此引发了免疫学的一场革命(详见本章§ 4.8节)。这一系列发现雄辩地证明在真核基因组内编码蛋白质的结构基因普遍存在着割裂现象。
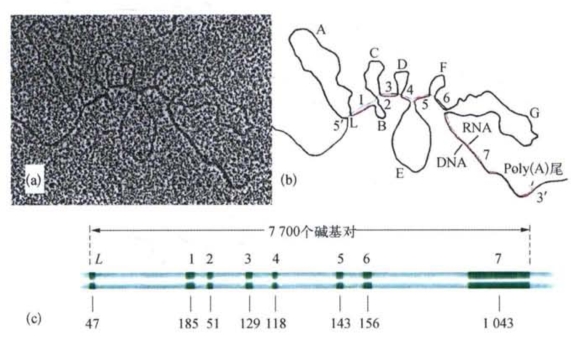
图4-15 卵清蛋白基因的mRNA和基因组DNA的分子杂交的电镜照片(引自P.Chambon)
(a)电镜照片;(b)电镜照片诠释图;(c)外显子和内含子的分布
割裂基因发现后最急待解决的问题是,一个编码序列被割裂的基因究竟是如何产生一个连续而不间断的mRNA?生物化学和细胞化学的实验研究表明,从转录的原始产物到转录产物的加工(processing),包括内含子的切除、外显子的拼接,还有加“帽”和接“尾”等一整套生物学反应。我们还是以鸡的卵清蛋白基因的表达为例来说明这一系列反应(图4-16)。
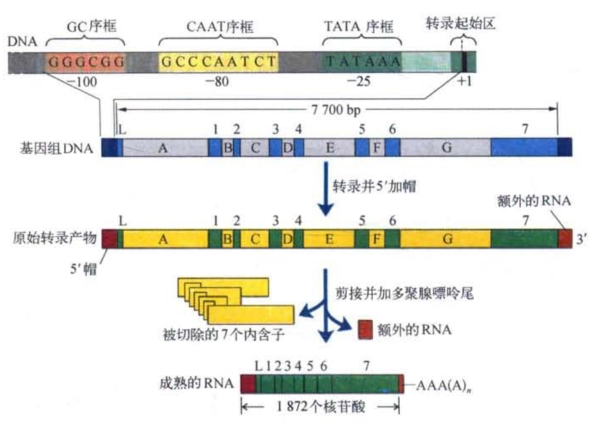
图4-16 真核细胞结构基因转录、加工和表达的示意
转录过程开始前,先由RNA聚合酶识别转录起始序列与5′端“上游”的转录起始区段(类似原核基因组中的促进子)并与之结合。位于转录起始点上游25~30个碱基对的TATA序框和位于转录起始点上游70~80个碱基对的CCAAT序框,很可能是转录酶识别和结合的关键序列,其中TATA序框又称戈德堡-霍格内斯序框(Goldberg-Hogness box),其作用相当于原核细胞DNA中的普里布诺序框(Pribnow box)。接着RNA聚合酶转录下整个基因的信息产生mRNA的前体,称为原始转录物。随后是原始转录物的修饰,主要是5′端加上三磷酸-7-甲基鸟嘌呤(m7Gppp)和3′端加上多聚腺嘌呤(polyA)。最后通过一系列的剪接步骤,切除不参与编码的内含子,把相邻的外显子拼接而成为成熟的mRNA。只有成熟的mRNA才能转移至细胞质作为编码基因的蛋白产物的信使。
那么,剪接又是如何进行的呢?尚邦等系统地分析了取自不同基因中介于内含子和外显子交界处的DNA区段的核苷酸序列,发现每一个内含子都是以GU(GT)开始,以AG结尾(图4-17)。据此,尚邦提出剪接酶的识别和拼接必定和内含子的GU-AG结构直接有关。以后的实验表明,鸡、兔、鼠、猴、人以及SV40病毒中的剪接信号序列都有GU-AG结构,甚至从A物种分离到的基因原始转录物,在B物种细胞中也能正确地剪接,产生成熟的mRNA。此后,GU-AG拼接就被称为RNA加工的尚邦法则,或者称为布雷瑟纳克-尚邦法则。

图4-17 真核基因中外显子和内含子间的剪接信号序列(引自P.Chambon)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















