课堂笔记
一、分类和命名
1.分类★ 根据环的数目、环的大小及杂原子数目的不同进行分类如下。

根据环中所含杂原子种类不同分为氮杂环、氧杂环和硫杂环。
2.命名
(1)有特定名称的杂环母核及其衍生物的命名和编号★★★
①单杂原子杂环,从杂原子开始编号。环上有取代基时,尽可能使其位次较小。环上连有标氢时,应给标氢尽可能低的编号,用位次加H(斜体大写)来表示。

②双杂原子杂环,应使杂原子有尽可能低的编号。杂原子不同时,按O、S、NH、N的顺序决定优先杂原子。

③稠杂环编号大多按照相应稠芳烃碳环母核的编号进行。但少数稠杂环如嘌呤、吩嗪等有特殊规定的编号。
(2)无特定名称的稠杂环的命名★
通常把稠杂环看作是两个单杂环并合在一起,一个环为基本环(即母环),另一个环为附加环(即取代环),两环名称中间加“并”字。示例如下。

具体命名原则略(自学)。
二、含1个杂原子的六元杂环
1.吡啶
(1)结构及芳香性★★★:与苯相似,吡啶环上的6个原子均为sp2杂化,各有1个电子分布在未参与杂化的、垂直于环平面的p轨道上,彼此侧面重叠形成6个原子6个电子共轭大π键,氮上的未共用电子对分布在sp2杂化轨道上。可见,吡啶的结构符合休克尔规则,具有芳香性。
由于氮原子的吸电作用,使环上电子云密度(尤其是邻对位)降低,为缺π(电子)杂环,环上电子云密度及键长的平均化程度都不如苯高,所以吡啶的芳香性和稳定性都比苯差。
(2)物理性质★:吡啶是具有特殊臭味的无色液体,沸点115℃,可与水、乙醇、乙醚等混溶,是性能良好的有机溶剂和脱酸剂,也是合成药物的重要原料。由于吡啶氮原子既有吸电子诱导效应,又有吸电子共轭效应,所以吡啶的极性较大。
(3)化学性质★★★
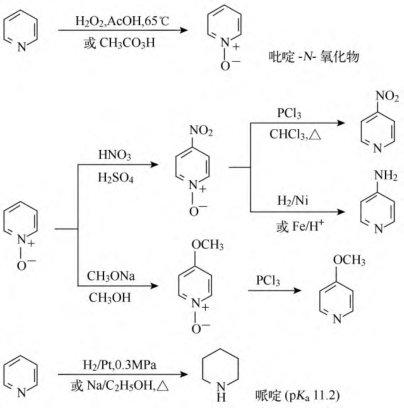
①碱性和成盐:吡啶氮原子上因有未共用电子对,所以有弱碱性(pKa5.19)和亲核性,可成盐。


②亲电取代反应:吡啶是缺π杂环,亲电取代反应比苯难,取代发生在β位。吡啶不发生傅-克反应。当α位、γ位有供电基时,亲电取代反应活性增强。

③亲核取代反应:吡啶比苯易发生亲核取代反应,主要发生在电子云密度较低的α位,其次是γ位。当α位、γ位有较好的离去基团时,亲核取代反应更容易发生。

④氧化还原反应:吡啶是缺π杂环,不易失去电子,难以被氧化,但烷基或芳基侧链可被氧化。

吡啶用过氧酸或过氧化氢氧化时,将得到合成上很有用的中间体吡啶-N-氧化物。吡啶-N-氧化物既易进行亲电取代反应,又能进行亲核取代反应,且都发生在γ位或α位。可用来制备那些直接用吡啶进行取代反应得不到的对位或邻位衍生物。
2.喹啉和异喹啉
(1)结构及物理性质★:两者结构与萘相似,平面型分子,形成10个原子10个电子共轭大π键,具有芳香性。
喹啉是无色油状液体,有类似于吡啶的臭味,沸点238℃。异喹啉为低熔点固体,有类似于苯甲醛的气味,熔点26℃,沸点243℃。两者都有和吡啶相同的氮原子,因此其碱性(pKa分别为4.9和5.42)与吡啶相近。但由于分子中增加了憎水的苯环,使水溶解度大大降低。
(2)化学性质★★★
①亲电取代反应:主要发生在电子云密度较大的苯环上,其反应活性比萘小,比吡啶大。喹啉主要在5位和8位取代,异喹啉主要在5位取代。

②亲核取代反应:主要发生在吡啶环上,其反应活性比吡啶大。喹啉主要在2位或4位取代,异喹啉主要在1位取代。

③氧化反应:只能被强氧化剂氧化,且主要发生在电子云密度较大的苯环上。被过氧化物氧化则生成N-氧化物。

④还原反应:比吡啶易被还原,且主要发生在电子云密度较小的吡啶环上。还原剂强时两环均被还原。

3.含氧原子的六元杂环★ 吡喃和吡喃酮均无芳香性(不符合休克尔规则)。

α-吡喃酮具有内酯和共轭二烯的性质,可发生水解、D-A反应等。示例如下。
三、含2个杂原子的六元杂环
1.哒嗪、嘧啶和吡嗪(统称二氮嗪)★★
(1)结构及物理性质:二氮嗪中2个氮原子的电子结构都与吡啶氮相同,均为平面型分子,且有6个原子6个电子的共轭大π键,都具有芳香性。
二氮嗪的碱性都比吡啶弱,虽然含有2个氮原子,却都是一元碱。
哒嗪和嘧啶能与水混溶,而吡嗪因结构对称没有极性,水溶解度略小。
(2)化学性质:亲电取代反应比吡啶难,卤代发生在5位,硝化、磺化、傅-克反应都难以进行。但当环上有羟基、氨基等强供电基时,硝化、磺化等反应也能发生。示例如下。

亲核取代反应比吡啶容易,取代主要发生在电子云密度较低的2位、4位、6位。当这些位置已连有卤素时,亲核取代反应活性增大。

二氮嗪不易被氧化,但侧链易被氧化。用过氧化物氧化则生成单氮氧化物,单氮氧化物既易发生亲电取代反应,又易发生亲核取代反应。

2.蝶啶★ 略(自学)。
四、含1个杂原子的五元杂环
1.吡咯、呋喃和噻吩
(1)结构与芳香性★★★:吡咯、呋喃和噻吩都是平面型分子,成环原子均为sp2杂化,4个碳原子各有1个电子在未参加杂化的p轨道上,杂原子有2个电子在p轨道上,p轨道彼此相互重叠形成5个原子6个电子共轭大π键,符合休克尔规则,都具有芳香性。
3个五元杂环中,都是5个原子共用6个电子,氮、氧、硫的给电子共轭效应大于吸电子诱导效应,结果使环上碳原子的电子云密度升高(与苯相比),均为多π(电子)杂环。由于它们的电子云密度和键长的平均化程度都不如苯,所以芳香性和稳定性都比苯差。因电负性大小顺序为O>N>S>C,故芳香性和稳定性大小顺序为:苯>噻吩>吡咯>呋喃。
(2)物理性质★:三者均为无色液体,吡咯有苯胺气味,呋喃有氯仿气味,噻吩有难闻的臭味。沸点高低顺序为吡咯(131℃)>噻吩(84℃)>呋喃(31℃)(因为吡咯分子间能形成氢键,噻吩的分子质量比呋喃大)。三者都易溶于有机溶剂而微溶于水,其水溶解度大小顺序为吡咯>呋喃>噻吩。分子都有极性,都不显碱性,且吡咯有弱酸性(pKa17.5)
(3)化学性质★★★
①亲电取代反应:三者为多π杂环,亲电取代反应比苯容易,反应主要发生在电子云密度较高的2位(即α位),其反应活性顺序为吡咯>呋喃>噻吩>苯。
A.卤代反应:需在较低温度且试剂浓度很低的条件下进行。
B.硝化反应:因吡咯和呋喃在氧化剂或强酸存在下,易发生氧化、水解、开环、聚合等反应,所以不能用混酸作为硝化试剂进行硝化,而只能用温和的非质子性硝化试剂硝乙酐(又称硝酸乙酰酯)在低温下进行硝化。噻吩在混酸中硝化时,反应激烈,有时会发生爆炸,所以也应采用硝乙酐作为硝化试剂。示例如下。
![]()
C.磺化反应:吡咯和呋喃要用温和的非质子性磺化试剂吡啶三氧化硫进行磺化,不能用硫酸。噻吩比较稳定,在强酸中不发生质子化,所以可直接用硫酸进行磺化,但产率较低。
2-噻吩磺酸可溶于浓硫酸,因此利用该性质可将从煤焦油中分离得到的粗苯(沸点80.1℃)中所含有的少量噻吩(沸点84℃)除去。
D.傅-克酰化反应:
![]()
吡咯具有类似于苯酚的性质,如可发生瑞穆尔-梯曼反应、偶合反应等。

②加成反应
![]()
呋喃共振能较小,稳定性较差,具有明显的共轭二烯性质,如可发生D-A反应。

③糠醛的反应:糠醛具有芳醛性质,可发生银镜反应、歧化反应、普尔金反应、与羰基试剂反应等。示例如下。

2.吲哚★ 吲哚为白色片状晶体,具有极臭的气味,熔点52℃,沸点253℃。吲哚比吡咯稳定,酸性(pKa17.0)比吡咯略强。但亲电取代反应活性不如吡咯,反应主要发生在3位,示例如下。

五、含2个杂原子的五元杂环
1.吡唑、咪唑、噻唑、唑和异唑★★
(1)结构与芳香性:这5个杂环可以看成是吡咯、呋喃、噻吩的氮取代物,即环上的2位或3位的CH换成了N原子。这个新增加的N原子与吡啶N原子一样,也采取sp2杂化,未参加杂化的p轨道上有1个电子,并参与形成5个原子6个电子共轭大π键,因此这5个杂环都具有芳香性。
(2)物理性质:咪唑和吡唑沸点远高于其他唑类,尤其咪唑明显高。这是因为咪唑和吡唑可通过分子间氢键分别形成线性多聚体和二聚体。水溶解度都比吡咯、呋喃、噻吩要大,因为环上增加了1个氮原子,也就增加了与水形成氢键的能力。
5个唑类化合物的碱性都比吡咯强,其中尤以咪唑碱性最强(pKa7.0,比吡啶碱性还强)。吡唑和咪唑的酸性也比吡咯强,是因为其共轭碱的负电荷离域程度高而稳定的缘故。
(3)互变异构及化学性质:在吡唑和咪唑环中,氮原子上的活泼氢可在2个氮原子间迁移,即存在互变异构现象。

唑类由于增加了1个吸电子的氮原子,环上电子云密度降低,稳定性比吡咯、呋喃、噻吩强,增强了抗氧化和抗酸的能力。可用混酸进行硝化,硫酸进行磺化。可用强氧化剂氧化侧链,而环不受影响。

2.嘌呤★ 嘌呤为无色针状晶体,熔点217℃,易溶于水和醇,难溶于大多数有机溶剂。嘌呤既有弱碱性又有弱酸性,其酸性(pKa 8.9)比咪唑(pKa14.2)强;其碱性(pKa2.4)比咪唑(pKa7.0)弱,但比嘧啶(pKa1.3)强。
嘌呤有9 H和7 H两种互变异构体。

六、喹啉及其衍生物的合成★★★
斯克劳普(Skraup)合成法 示例如下。

以取代苯胺和相应的取代硝基苯代替苯胺和硝基苯;α,β-不饱和醛酮代替甘油进行合成,可以得到喹啉衍生物。浓硫酸也可用浓磷酸代替,取代硝基苯也可用As2O5或H3AsO4代替。示例如下。
重点难点提示
1.杂环及其衍生物的命名。
2.吡啶的化学反应。
3.喹啉的化学反应。
4.吡咯、呋喃和噻吩的化学反应。
5.喹啉及其衍生物的合成。
测试及考研
1.用系统命名法命名下列化合物或根据名称写出结构式

(5)8-硝基-7 H-嘌呤 (6)2-羟基-4-氨基嘧啶
本题考点:熟悉重点杂环化合物的命名和结构。
2.单项选择题
(1)下列化合物中,碱性最强的是( )
A.喹啉 B.嘧啶 C.吡啶 D.哌啶
本题考点:哌啶是仲胺,比杂环化合物碱性都强。
(2)下列化合物中,碱性最强的是( )
A.咪唑 B.吡啶 C.吡唑 D.嘌呤
本题考点:在所介绍的这些重要杂环中咪唑的碱性最强。
(3)下列化合物中,碱性最强的是( )

本题考点:吡啶氮原子的邻对位上有供电基供电性越强,碱性越强。
3.判断题
(1)吡啶有1个氮原子,是一元弱碱。嘧啶有2个氮原子,所以是二元弱碱。( )
本题考点:二氮嗪都是一元弱碱,因为只有1个氮能结合质子。
(2)吲哚与混酸硝化时将得到3-硝基吲哚,而不是2-硝基吲哚。( )
本题考点:吲哚与吡咯相似,硝化反应只能选择硝乙酐作硝化试剂。
(3)吡咯、呋喃和吡喃均具有芳香性,并且进行亲电取代反应比苯容易。( )
本题考点:吡喃环上有饱和碳原子,不符合休克尔规则,没有芳香性。
(4)吡咯硝化主要在2位,吲哚和吡咯相似,硝化也主要在2位。( )
本题考点:与吡咯不同,吲哚进行亲电取代反应主要在3位。
4.完成下列反应,写出反应的主要产物
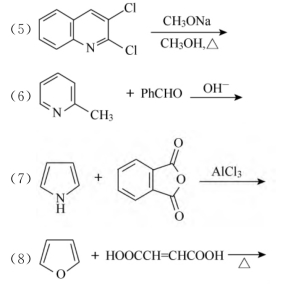
本题考点:对重点反应掌握的熟练程度。①喹啉硝化主要发生在5位、8位;②呋喃磺化要用吡啶三氧化硫;③α位比β位活泼,更易进行亲电取代反应,同时也符合甲氧基的定位原则;④甲氧基比甲基供电能力强,故由甲氧基定位;⑤卤素的邻对位有强吸电基时亲核取代反应活性增强;⑥邻位有强吸电基时甲基氢活性增强,能发生缩合反应;⑦吡咯与酸酐的傅-克酰化;⑧呋喃能发生D-A反应。
5.合成题(无机试剂任选)
由苯和乙醇合成2-甲基喹啉。
本题考点:斯克劳普合成法合成喹啉衍生物。
答案:
1.(1)1-甲基-5-苯基咪唑;(2)2,6,8-三羟基嘌呤;
(3)N,N-二甲基-3-吡啶甲酰胺;

2.(1)D;(2)A;(3)D
3.(1)×;(2)×;(3)×;(4)×。
4.


5.

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















