课堂笔记
一、羧酸衍生物的结构★
二、羧酸衍生物的命名★★★
酰卤:酰基名称+卤素名称。
酰胺:酰基名称+胺。
酸酐:羧酸名称+酐(混酐则简单酰基在前)。
腈:按主链碳原子数称某腈。
酯:羧酸名称+醇名称,改醇为酯,称为某酸某酯;多元醇酯,称为某醇某酸酯。
内酯和内酰胺:根据水解后生成羟基酸和氨基酸的主链碳原子数,称为某内酯和某内酰胺,母体名称前要标明羟基和氨基的位置。
分子中含多个官能团时,需选择优先官能团作母体,其优先次序如下。
RCOOH>RSO3H>(RCO)2O>RCOOR′>RCOX>RCONH2>RCN>RCHO>RCOR′>ROH>ArOH>RNH2>RC≡CH>RCH=CH2>RH
三、羧酸衍生物的物理性质★
低级酰卤和酸酐是具有刺激气味的无色液体,高级的为固体;低级酯是易挥发并有芳香气味的无色液体;除甲酰胺和某些N-取代酰胺为液体外,其他酰胺均为固体。酰胺分子间可通过氢键缔合,所以其沸点和熔点比分子量相近的其他类化合物都高,氮上氢被取代后,熔沸点均显著降低。低级酰胺溶于水;酰氯和酸酐不溶于水,低级的遇水分解;酯在水中溶解度很小。
四、羧酸衍生物的化学性质★★★
1.水解、醇解和氨(胺)解反应
通式:
HNu=H2O、ROH、NH3(R′)
L=X、OCOR′、OR′、NH2(R′)
反应活性:酰卤>酸酐>酯>酰胺≈腈氨(胺)>醇>水
该类反应反过来可看成是在水、醇、氨(胺)分子上引入酰基,故又称酰化反应,羧酸衍生物是酰化试剂,酰化试剂的酰化能力为酰卤>酸酐>酯>酰胺≈腈。
(1)水解反应

其中,酯和腈的水解较有意义,但都需要酸或碱催化且长时间回流,这是制备羧酸的两种方法。酰卤不需催化剂和加热,很易水解,反应剧烈。酸酐室温下温和水解,加热时水解速度加快。通常酰卤和酸酐是要防止水解的,不用两者制备羧酸。
(2)醇解反应
酰卤、酸酐的醇解常用于制备那些用酯化反应难以制备的酯,示例如下。
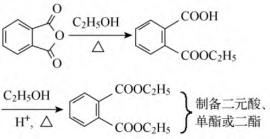
酯的醇解又称为酯交换反应,反应可逆。常用于制备一些难以合成的酯(如酚酯、烯醇酯),或从廉价易得的低级酯制备高级酯,或从低沸点醇的酯制备高沸点醇的酯,示例如下。
腈在酸存在下醇解也生成酯,最重要的应用就是制备丙二酸二乙酯。
(3)氨解反应

酰卤、酸酐和酯的氨解可用来制备酰胺,示例如下。


(4)水解、醇解、氨(胺)解的反应机制:亲核加成-消除机制,相当于亲核取代反应。
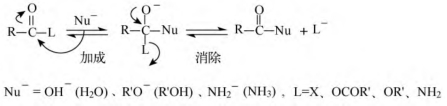
由反应机制可知,离去基团L-的离去能力(X->R’COO->R’O->![]() )决定了羧酸衍生物水解、醇解或氨解(即亲核取代)的反应活性(酰卤>酸酐>酯>酰胺)。而烃基或取代基不同的同类羧酸衍生物,其水解、醇解或氨解的反应活性则取决于以下2个主要因素:①羰基碳带正电荷越多(如连吸电基),反应越快;②羰基碳所连基团体积越小,反应越快。如下列酯的反应活性如下。
)决定了羧酸衍生物水解、醇解或氨解(即亲核取代)的反应活性(酰卤>酸酐>酯>酰胺)。而烃基或取代基不同的同类羧酸衍生物,其水解、醇解或氨解的反应活性则取决于以下2个主要因素:①羰基碳带正电荷越多(如连吸电基),反应越快;②羰基碳所连基团体积越小,反应越快。如下列酯的反应活性如下。
要重点掌握酯的酸性水解机制和碱性水解机制。
①酯的碱性水解机制如下。
特点:酰氧键断裂。最后一步不可逆,反应较彻底,水解效果好。
②伯、仲醇形成的酯的酸性水解机制如下。
特点:酰氧键断裂。反应可逆,此水解恰好是酯化反应的逆反应,反应不完全,需增加某种反应物浓度或不断移走产物等手段提高产率。
叔醇形成的酯酸性水解时,因空间位阻太大难以加成,所以是烷氧键断裂,反应经碳正离子过程。此机制了解即可。叔醇的酯化,是它的逆反应。
2.与金属有机化合物的反应
羧酸衍生物与格氏试剂反应经过酮,最后生成叔醇。只有酰卤因反应活性比酮大,通过控制反应条件能得到酮。而酸酐、酯与格氏试剂反应只能得到叔醇。酯与格氏试剂反应是制备叔醇常用的好方法。
3.还原反应 LiAlH4可将酰卤、酸酐和酯还原成伯醇,而将酰胺和腈还原成胺。

酯还能被Na/ROH试剂还原成伯醇,称为鲍维特-勃朗克(Bouveault-Blanc)还原,示例如下。
酰氯用低活性钯催化氢化可得到醛,称为罗森孟德(Rosenmund)还原,示例如下。
4.酰胺的特殊性质
(1)酸碱性:酰胺水溶液呈中性。酰亚胺呈弱酸性,与碱可成盐。
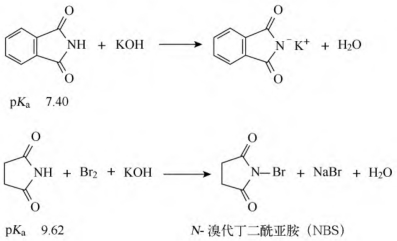
(2)霍夫曼(Hofmann)降解反应

(3)脱水反应
五、羧酸衍生物的制备★★
1.羧酸及羧酸衍生物相互转化
![]()
2.贝克曼(Beckmann)重排 肟存在顺反异构体,但可相互转化,其中E构型较稳定。肟在酸存在下将重排生成酰胺。
反应机制如下。

3.拜尔-魏立格(Baeyer-Villiger)氧化

[O]为CH3CO3H、Cl3CCO3H、PhCO3H、H2O2等
六、羧酸衍生物涉及碳负离子的反应及其在合成中的应用
1.酯缩合反应★★★
(1)克莱森(Claisen)酯缩合
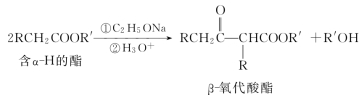
①反应结果:一分子酯的α-氢被另一分子酯的酰基取代,生成β-氧代酸酯(或称β-羰基酸酯)。


③注意:只有一个α-H的酯缩合时,需用更强的碱如NaH、NaCPh3等反应才能顺利进行。示例如下。
(2)狄克曼(Dieckmann)酯缩合
(3)交叉酯缩合

(4)分子间酯缩合和酮酯缩合

酮的α-氢酸性比酯的α-氢酸性强,所以酮先与碱作用生成碳负离子,然后与酯进行亲核加成反应。某些酮酸酯还能发生分子内的酮酯缩合,示例如下。
2.酯缩合反应在有机合成中的应用★★ 酯缩合反应可制备β-氧代酸酯、1,3-二酮(β-二酮)、1,3-二酯等化合物,将得到的含有酯基官能团的缩合产物再经碱性水解、酸化、脱羧步骤则可制备链状或环状的酮、二酮等,示例如下。
3.乙酰乙酸乙酯及其在合成中的应用★★★
(1)酮式和烯醇式互变异构:因乙酰乙酸乙酯分子中的亚甲基上的H受两个吸电基的影响,显示一定的酸性,pKa11,因此这个酸性氢可重排到酮羰基氧上,形成烯醇式结构。
可见,乙酰乙酸乙酯既有酮的性质(如与亲核试剂加成等),又有烯醇的性质(如与FeCl3显色,与卤素发生亲电加成等)。
一般烯醇式含量大于1%的化合物都能与FeCl3显色,如1,3-二酮(β-二酮)类、丙二醛、硝基乙烷、丙二腈和乙酰乙酸乙酯等。
(2)酮式分解和酸式分解
①酮式分解
②酸式分解
(3)在合成中的应用:强碱作用下先在乙酰乙酸乙酯的亚甲基上进行烷基化或酰基化,然后再进行酮式分解可制备各种甲基酮类或β-二酮类化合物;若进行酸式分解则可制备各种取代乙酸。但后者因副产物较多,所以乙酰乙酸乙酯主要用于取代丙酮的制备。示例如下。

4.丙二酸二乙酯及其在合成中的应用★★ 丙二酸二乙酯分子中亚甲基上的H受两个酰基的影响,也显示一定的酸性,pKa13,因此也可在强碱作用下在亚甲基上引入烷基或酰基,然后再经水解、酸化、加热脱羧来制备取代乙酸。示例如下。

5.麦克尔加成★★★
(1)含活泼亚甲基的化合物:指亚甲基上连有硝基或连2个酰基、羧基、氰基、酯基等吸电基的具有一定酸性的化合物。
(2)α,β-不饱和化合物:指具有共轭体系的α,β-不饱和醛、酮、酯、腈等。
(3)催化剂碱:氨基钠、醇钠、氢氧化钠(钾)、季铵碱、三乙胺、哌啶、吡啶等。
(4)加成结果:因1,4-加成后是烯醇式结构,再经互变异构结果相当于3,4-加成。示例如下。
6.达参(Darzen)反应★★
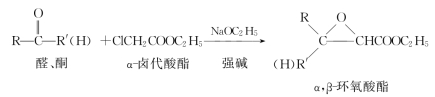
α,β-环氧酸酯再经水解、酸化、加热脱羧,则可制备比原料多一个碳的醛、酮。
示例如下。
7.克脑文格尔(Knovenagel)反应★★★
示例如下。
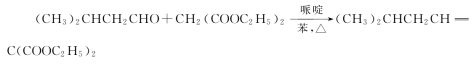
8.普尔金(Perkin)反应★★★
示例如下。
上述这些缩合反应和类缩合反应其反应机制有相似之处,即在碱作用下,一分子反应物生成碳负离子,然后对另一分子反应物进行亲核加成。
1.碳酸衍生物★★

氨基甲酸乙酯
碳酰氯具有酰氯的典型性质,如易发生水解、醇解和氨(胺)解反应,是重要的有机合成原料。
脲具有弱碱性,能水解,醇钠存在下能与丙二酸酯反应生成丙二酰脲(巴比妥酸),示例如下。

胍是有机强碱,其碱性与氢氧化钾相当。
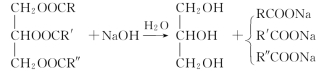
2.油脂★ 油脂是高级脂肪酸甘油酯的混合物,其碱性水解反应称为皂化反应,水解所得钠盐可用于制造肥皂等洗涤用品。
3.原酸酯★ 原酸酯是指原酸的烷基或芳基衍生物,原酸是羧酸的羧羰基与水的加成物,示例如下。
原酸酯是一类反应活性很高的化合物,是制备缩醛或缩酮的常用试剂。
重点难点提示
1.羧酸衍生物的亲核取代反应及其反应活性比较。
2.羧酸衍生物的还原反应、格氏试剂反应及霍夫曼降解反应。
3.贝克曼重排反应及反应机制。
4.酯缩合反应及反应机制。
5.乙酰乙酸乙酯及其在合成中的应用。
6.麦克尔加成反应、达参反应、克脑文格尔反应和普尔金反应。
测试及考研
1.单项选择题
(1)下列化合物哪个不与三氯化铁显色( )
A.丙二酸二乙酯 B.乙酰乙酸乙酯
C.丙二腈 D.2,4-戊二酮
本题考点:掌握具有烯醇式结构且含量大于1%的化合物。
(2)下列酯哪个不适合与乙酸乙酯进行交叉酯缩合反应( )
A.碳酸二乙酯 B.苯甲酸乙酯
C.苯乙酸甲酯 D.3-吡啶甲酸甲酯
本题考点:只有无α-H的羧酸酯与有α-H的乙酸乙酯进行交叉酯缩合才有意义。
(3)苯甲醛与丙二腈进行克脑文格尔反应需选择下列哪种试剂作催化剂( )
A.乙醇钠 B.哌啶
C.氢氧化钠 D.氨基钠
本题考点:进行克脑文格尔反应需要弱碱作催化剂。
(4)普尔金反应适合于制备下列哪类化合物( )
A.烯烃 B.β-二酮
C.α,β-不饱和酸 D.α,β-不饱和醛
本题考点:了解普尔金反应的产物。
(5)下列化合物哪个能与Br2/NaOH发生霍夫曼降解反应( )
A.N-甲基苯胺 B.苯胺
C.N-甲基苯甲酰胺 D.苯甲酰胺
本题考点:N原子上无取代基的酰胺才能发生降解反应。
(6)下列化合物碱性最强的是( )
A.亚氨基脲 B.硫代碳酰胺
C.碳酰胺 D.碳酰氯
本题考点:熟悉碳酸衍生物的名称,胍(亚胺基脲)是有机强碱。
2.比较题
(1)下列化合物与乙胺反应时,速率由快到慢的排序是( )
A.苯甲酰胺 B.苯甲酰氯
C.苯甲酸乙酯 D.苯甲酸酐
本题考点:不同类羧酸衍生物的亲核取代反应活性。
(2)下列化合物水解时,速率由快到慢的排序是( )
A.对羟基苯甲酸乙酯
B.对乙酰基苯甲酸乙酯
C.对硝基苯甲酸乙酯
D.对溴苯甲酸乙酯
本题考点:同类羧酸衍生物取代基不同时对亲核取代反应活性的影响。
(3)下列化合物α-H酸性由大到小的排序是( )
A.丙二酸二乙酯 B.乙酰乙酸乙酯
C.乙酸乙酯 D.1,3-环己二酮
本题考点:吸电基不同对α-H酸性影响就不同。
3.完成下列反应,写出反应的主要产物
![]()
![]()


本题考点:对重点反应掌握的熟练程度。①酸酐的胺解;②酯与格氏试剂反应制备叔醇;③羧酸间接还原成醛,罗森孟德还原;④LiAlH4还原酯和酰胺,不还原双键;⑤狄克曼酯缩合;⑥酮酯缩合;⑦克脑文格尔反应;⑧普尔金反应。
4.合成题(用给定原料合成目的产物,无机试剂及溶剂任选)
(1)由不多于2个碳的化合物合成2,7-辛二酮
本题考点:乙酰乙酸乙酯在有机合成中的应用。
(2)由丙二酸二乙酯和不多于4个碳的有机物合成环戊烷羧酸
本题考点:丙二酸二乙酯在有机合成中的应用。
5.推导结构题
(1)化合物A(C5H8O2),与NaHCO3、CrO3、2,4-二硝基苯肼、Br2等均不发生反应。A在酸性水溶液中加热则生成B(C5H10O3)。B与2,4-二硝基苯肼、Br2也不发生反应,但与NaHCO3作用有气体生成,用CrO3处理生成C(C5H8O4),B用酸处理并加热脱水则又转变成A。试推测A、B、C的结构。
本题考点:本题测试综合能力,检测对重点反应的掌握情况。A不与NaHCO3、CrO3、2,4-二硝基苯肼、Br2等反应,说明分子中不存在醛酮羰基、碳碳双键、醇羟基、羧基,那含2个氧的基团就可能是酯。A酸性水解后仍是5个碳,推测A是内酯,由此推测出A、B、C结构。
(2)化合物A(C8H4O3),在水中会发生水解生成一个酸性化合物。A与氨水作用后再酸化,得到化合物B(C8H7NO3),B有酸性,可与碱成盐。将B用溴和氢氧化钠溶液处理,然后再酸化得到C(C7 H7NO2),C既能与酸成盐,也能与碱成盐。试推测A、B、C的结构。
本题考点:本题测试综合能力,检测对重点反应的掌握情况。A能水解生成酸性化合物,且含3个氧,不饱和度大,推测是含苯的酸酐,A含8个碳很易推测是邻苯二甲酸酐。由此推测出A、B、C结构。也可由B、C的分子式及其性质直接推测B和C。
答案:
1.(1)A;(2)C;(3)B;(4)C;(5)D;(6)A。
2.(1)B>D>C>A;(2)C>B>D>A;(3)D>B>A>C。

5.(1)

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















