3.5.3 影响化学平衡移动的因素
3.5.3.1 浓度对化学平衡移动的影响
在一定温度下,反应达到平衡时,Q= 。由于
。由于 不变,所以此时若提高反应物的浓度(或分压力)或者降低生成物的浓度(或分压力),Q都将变小,使Q<
不变,所以此时若提高反应物的浓度(或分压力)或者降低生成物的浓度(或分压力),Q都将变小,使Q<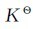 ,原有的平衡将被破坏,平衡向着生成物的方向移动,直到Q=
,原有的平衡将被破坏,平衡向着生成物的方向移动,直到Q= ,即重新建立新的平衡。反之,平衡将逆向进行。
,即重新建立新的平衡。反之,平衡将逆向进行。
例如,对于反应:CO(g)+H2O(g)→CO2(g)+H2(g)
增大水蒸气的通入量,可以提高CO的平衡转化率。工业生产中经常用增大廉价、易得的反应物浓度的方式,来提高贵重反应物的转换率。当然也可以减小产物的浓度,使平衡正向移动,同样达到提高反应物转化率的目的。例如煅烧石灰石时,如果将生成的CO2吹出,可使平衡正向移动,有利于提高CaCO3的转化率。
例3.12 对于例题3.9:
(1)计算SO2Cl2的分解分数。
(2)若在原来的平衡体系中再加入0.10mol的Cl2,计算SO2Cl2的分解分数。
(3)若反应起始时就加入0.50mol的SO2Cl2及0.10mol的Cl2,SO2Cl2的分解分数又是多少?由此可得出什么结论。
(2)加入0.10mol的Cl2后,平衡朝着生成SO2Cl2的方向移动,设SO2Cl2的浓度又增加了xmol·L-1。
计算结果表明,若增大生成物的浓度,平衡向着增大反应物浓度的方向进行,使反应物的分解分数降低。
(3)设反应达平衡时SO2的浓度为ymol·L-1,则
计算结果表明:在相同的条件下,体系达到平衡时的组成与达到平衡的具体途径无关。此外,在计算“平衡转化率”或某反应物(或产物)浓度(或分压)时,两套平衡常数均可以用,且使用实验平衡常数更方便,故IUPAC未予废除。
3.5.3.2 压力对化学平衡的影响
压力的变化对固体和液体的体积影响甚微,所以对只有固体和液体物质参加的化学反应,系统压力发生改变后,化学平衡基本不移动。但对于有气体参加的化学反应,在恒温条件下,若改变某一种气体的分压力或体系的总压力,通常会引起化学平衡的移动。压力的变化对化学反应平衡的影响可分为下面几种情况。
1.恒温恒容条件下物质分压的变化 对于恒温恒容条件下的反应,增大反应物或减小生成物的分压,都将导致Q< ,则平衡正向移动;反之,平衡逆向移动。这一影响与浓度对化学平衡的影响有相似之处。
,则平衡正向移动;反之,平衡逆向移动。这一影响与浓度对化学平衡的影响有相似之处。
例如下列气相可逆反应:
aA+bB→gG+hH
在密闭容器里,平衡时
如果在恒温条件下将反应系统的体积变为原来的1/m倍,则系统的总压将变为原来的m倍,此时的反应商为:
此时又可以分两种情况讨论:
(1)当m>1时,即压缩系统,使系统压力增大。
1)对于Δn>0,即气体分子数增加的反应,mΔn>1,则Q> ,平衡逆向移动,即向气体分子数减少、压力降低的方向移动。
,平衡逆向移动,即向气体分子数减少、压力降低的方向移动。
2)对于Δn<0,即气体分子数减少的反应,mΔn<1,则Q<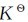 ,平衡正向移动,即向气体分子数减少、压力降低的方向移动。
,平衡正向移动,即向气体分子数减少、压力降低的方向移动。
3)对于Δn=0,即反应前后气体分子数不变的反应,mΔn=1,则Q= ,平衡不移动。
,平衡不移动。
(2)当m<1时,即膨胀系统,使系统压力减小。
1)对于Δn>0的反应,即气体分子数增加的反应,mΔn<1,则Q< ,平衡正向移动,即向气体分子数增多、压力增大的方向移动。
,平衡正向移动,即向气体分子数增多、压力增大的方向移动。
2)对于Δn<0的反应,即气体分子数减小的反应,mΔn>1,则Q> ,平衡逆向移动,即向气体分子数增多、压力增大的方向移动。
,平衡逆向移动,即向气体分子数增多、压力增大的方向移动。
3)对于Δn=0的反应,即反映前后气体分子数不变,mΔn=1,则Q= ,平衡不移动。
,平衡不移动。
综上所述,对于Δn=0,即反应前后气体分子数不改变的反应,在一定温度下改变总压力,平衡不移动。对于Δn≠0的反应,如恒温下压缩反应系统,相当于增大压力,反应向气体分子数减少使压力下降的方向移动;如果恒温下使反应系统膨胀,相当于减小压力,反应向气体分子数增加使压力上升的方向移动。此原理被广泛应用于化工生产中,以提高反应物的转化率,如合成氨的反应在高压下进行,并通入过量的氮气,不断引出生成的氨气,以提高氢气的转化率。
2.惰性气体的影响 惰性气体是指不参与化学反应的气体。在恒温条件下向达到平衡的系统引入惰性气体时,情况分为两种。
(1)若体积不变,系统的总压力增加,但各反应物和产物的分压不变,Q= ,平衡不移动。
,平衡不移动。
(2)若保持总压不变,则系统的体积增大,各反应物和产物的分压相应的减小。若Δn≠0,则Q≠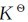 ,平衡向气体分子数增多、压力增大的方向移动。
,平衡向气体分子数增多、压力增大的方向移动。
例3.13 一容器中加入1.0L的气体PCl5,在一定的温度和压力下,PCl5有50%离解为PCl3和Cl2气体。试判断在下列不同的条件下,PCl5的解离度变化情况:
(1)减小压力使PCl5的体积变为2.0L。
(2)保持压力不变,加入Cl2使体积增大到2.0L。
(3)保持体积不变,加入Cl2使压力增加1倍。
(4)保持压力不变,加入N2使体积增大到2.0L。
(5)保持体积不变,加入N2使压力增加1倍。
解:PCl5分解按下式进行:
PCl5(g)→PCl3(g)+Cl2(g)
该反应Δn=1>0,是气体分子数增加的反应。平衡时,有下列关系式:
当PCl5有50%分解时,PCl5、PCl3和Cl2的平衡分压相等。
(1)减小压力使PCl5的体积变为2.0L,体积增大,相当于膨胀系统,各物质分压都减小,即m<1,则Q< ,平衡向气体分子数增多、压力增大的方向移动,即正向移动,PCl5解离度增加。
,平衡向气体分子数增多、压力增大的方向移动,即正向移动,PCl5解离度增加。
(3)加入Cl2使压力增加1倍,而体积不变,产物Cl2的分压增大,PCl5和PCl3的分压不变,故Q> ,所以平衡逆向移动,PCl5解离度减小。
,所以平衡逆向移动,PCl5解离度减小。
(5)加入的N2不参加化学反应,虽然压力增大1倍但体积不变,因此PCl5、PCl3和Cl2的分压都不变,Q= ,不影响化学平衡,PCl5解离度不变。
,不影响化学平衡,PCl5解离度不变。
由该题可以看出,考虑压力对平衡的影响时,归根结底是考虑各分压变化对Q值的影响。
3.5.3.3 温度对化学平衡的影响
浓度和压力的改变,虽然能使化学平衡移动,但平衡常数依然不变,而温度的变化对化学平衡的影响却使标准平衡常数改变。对任意化学反应:
因此,温度升高,平衡向吸热的方向移动;反之,平衡向放热的方向移动。
3.5.3.4 催化剂对化学平衡的影响
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















