浓度可以影响化学平衡,但是它不能改变标准平衡常数的数值。根据反应商J,可以推测化学平衡移动的方向。
对于任意稀溶液中的反应:

或简写
式中c(D)、c(H)、c(E)、c(F)分别为D、H、E、F在任意时刻的物质的量浓度。此时的J称为浓度商。
如果体系处于平衡状态,V正=V逆,J=K■。如果某种条件的改变,能使V正≠V逆,J≠K■,这将导致平衡发生移动。如果增大反应物浓度或减小生成物浓度,将使J<K■,体系将向减小反应物浓度和增大生成物浓度的方向移动。随着反应物浓度的不断减小和生成物浓度的不断增加,J值不断变大,当J重新等于K■时,体系又在新的浓度基础上建立起新的平衡。相反,如果增大生成物浓度或减小反应物浓度,这将使J>K■,体系将向减小生成物浓度和增大反应物浓度的方向移动。总之,在平衡体系中,如果其他条件不变,增大(或减小)其中某物质的浓度,平衡就向减小(或增大)该物质浓度的方向移动。因此,我们就可以用J与K■的比较来判断反应进行的方向了。即:
J<K■,反应正向自发进行
J=K■,反应处于平衡状态
J>K■,反应逆向自发进行
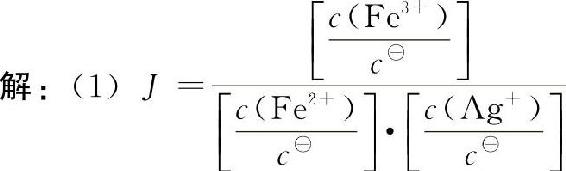
【例5-2】含0.100mol·L—1AgNO3、0.100mol·L—1Fe(NO3)2和0.0100mol·L—1Fe(NO3)3的溶液中发生如下反应:Fe2++Ag+■■■Fe3++Ag,298.15K时,K■=2.98。求:
(1)反应向哪个方向进行;
(2)平衡时Ag+、Fe2+、Fe3+的浓度各为多大;
(3)Ag+的转化率;
(4)如果保持Ag+、Fe3+的浓度不变,而使Fe2+的浓度变为0.300mol·L—1,求在新条件下Ag+的转化率。
或简写
J<K■,所以,反应向正方向进行。
(2)Fe2++Ag+■■■Fe3++Ag
初始浓度/(mol·L—1) 0.100 0.100 0.0100
平衡浓度/(mol·L—1) 0.100—x 0.100—x 0.0100+x
或简写
即:
(3)
(4)设在新条件下Ag+的转化率为α2。则
平衡时:
或简写成
对于可逆反应,若提高某一反应物的浓度或降低产物的浓度,都可使J<K■,平衡将向着减少反应物浓度和增加产物的浓度的方向移动。在生产中,常利用这一原理来提高反应物的转化率。二、压力对化学平衡的影响
由于压力对固体和液体体积的影响极小,所以压力改变对固体和液体反应的平衡体系几乎没有影响。对于有气体参加的反应来说,与浓度的变化一样,压力改变可能使平衡发生移动,但也不能改变标准平衡常数。改变压力对化学平衡移动的影响通常有以下几种情况:
1.改变某气体物种的分压
对于任意气体混合物反应:
式中,p(D)/p■、p(H)/p■、p(E)/p■、p(F)/p■分别为D、H、E、F在任意时刻的分压。此时的J又可称为分压商。
如果改变某气体的分压,则与改变其物质浓度的情况相同。如增大反应物的分压或减小产物的分压,这时反应商J<K■,平衡将向正反应方向移动,使反应物的分压减小和产物的分压增大。如减小反应物的分压或增大产物的分压,这时J>K■,平衡将向逆反应方向移动,使反应物的分压增大和产物的分压减小。总之,【在平衡体系中,如果其他条件不变,增大(或减小)其中某物质的分压,平衡就向减小(或增大)该物质分压的方向移动,使改变的影响减弱】。
2.改变体系的总压力
以下列气体反应为例来进行讨论:
eE(g)+fF(g)■■■dD(g)+hH(g)平衡时,
如保持其他条件不变,只改变体系的总压力使之为原来的m倍,各气体的分压也将都变为原来分压的m倍,这时,
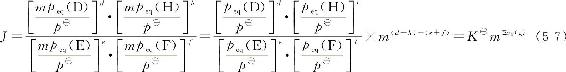
式中,m>1时,为增大体系的总压力;m<l时,为减小体系的总压力。由式(5-7)可知,不论体系的总压力如何改变,当∑BνB(g)=0时,J=K■。也就是说,如果反应前后的气体分子总数相等时,其平衡状态不受体系总压力改变的影响。
当∑BνB(g)<0,即(e+f)>(d+h)时,为气体分子总数减少的反应。若m>1(加压)时,J<K■,平衡向正反应方向,即向气体分子总数减少的方向移动。若m<1(减压)时,J>K■,平衡向逆反应方向,即向气体分子总数增多的方向移动。
当∑BνB(g)>0,即(e+f)<(d+h)时,为气体分子总数增多的反应。若m>1(加压)时,J>K■,平衡向逆反应方向,即向气体分子总数减少的方向移动。若m<1(减压)时,J<K■,平衡向正反应方向,即向气体分子总数增多的方向移动。
3.惰性气体的影响
惰性气体的加入,对化学平衡是否有影响,要视具体情况而定。【恒温、恒容条件下,对化学平衡无影响;恒温、恒压条件下,惰性气体的加入,使反应体系体积增大,造成各组分气体分压的减小,化学平衡向气体分子总数增多的方向移动】。
【例5-3】反应:CO(g)+H2O(g)■■■CO2(g)+H2(g)已知在308K时,K■=1.0。将0.30molCO、0.30molH2O、0.10molH2和0.10molCO2装入1L的密闭容器中,使之在该温度下反应,计算平衡移动方向和达到平衡时各物质的分压及CO的平衡转化率。解:按题意,各物质的分压
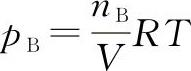
,因为此反应的∑νB=0,所以计算时可用物质的量代替分压:
K■=1.0,J<K■,平衡向正反应方向移动。
设新生成CO2的物质的量为xmol,则:
CO(g)+H2O(g)■■■CO2(g)+H2(g)
初始时物质的量/(mol) 0.30 0.30 0.10 0.10
平衡时物质的量/(mol) 0.30—x 0.30—x 0.10+x 0.10+x
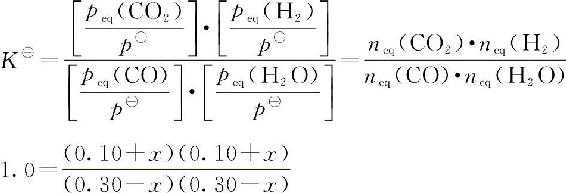
解得:x=0.10
平衡时:
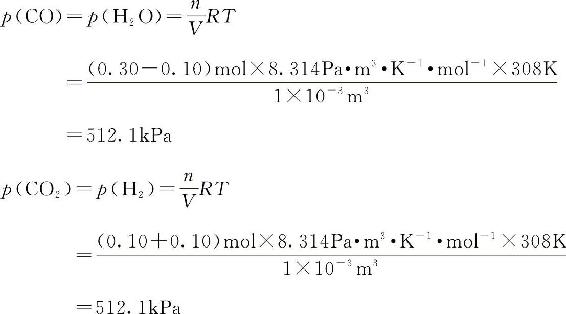
CO的平衡转化率为:
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















